抗人细胞角蛋白7(CK7)单克隆抗体的制备及鉴定
曾 璇,吴 意,刘如石,曾冰洁,扶春艳,杨玉皎,郑 姣*,钟志宏*
(1. 湖南师范大学医学院,长沙 410013;2. 湖南师范大学免疫诊断试剂湖南省工程研究中心, 长沙 410013;3. 湖南师范大学附属第一医院(湖南省人民医院)临床检验科, 长沙 410005;4. 湖南省株洲市妇幼保健院产科,株洲 412008)
细胞角蛋白是一种复杂的中间丝蛋白质,是角质细胞中的主要骨架蛋白,主要存在于上皮细胞,可为上皮细胞提供机械凝聚力和抗创伤性。目前,细胞角蛋白家族包含20多种不同的多肽[1-2]。根据摩尔目录[3],细胞角蛋白被分为酸性细胞角蛋白(Ⅰ型)和碱性细胞角蛋白(Ⅱ型)两个亚组。细胞角蛋白1(cytokeratin 1,CK1)的相对分子质量最大(68 kD),细胞角蛋白9(cytokeratin 9,CK9)的相对分子质量最小(40 kD)。细胞角蛋白存在于良性和恶性上皮细胞,且大部分恶性肿瘤上皮组织中都被证实存在细胞角蛋白。
细胞角蛋白7(cytokeratin 7,CK7)是相对分子质量为54 kD的碱性角蛋白,存在于各种导管细胞及腺上皮细胞中。在肺、乳房、子宫内膜、卵巢、子宫颈、唾液腺、甲状腺癌、胆管癌、胰腺癌等组织中均有CK7的表达[4-8]。有研究发现,在与人类乳头瘤病毒(human papilloma virus,HPV)相关的宫颈癌中也有CK7的表达[9]。另有研究表明,CK7有助于原发性肺、结肠直肠癌和转移性肺、结肠直肠癌的鉴别,且有助于转移性病变的诊断区分。在转移性癌症患者中,CK7有助于肿瘤原发部位的确定和预后评估[2,10-13]。因此,制备抗CK7单克隆抗体并用于临床免疫组化检测CK7的表达,对癌症的诊断和预后有重要意义。
目前,CK7作为一种肿瘤标志物已得到临床的普遍重视,国内研究工作主要集中于其临床免疫组化检测。目前医院使用的高质量CK7 单克隆抗体大多依赖于国外进口,价格较高,使其检测成本较高,未能在临床检测中推广使用。本试验通过对CK7多肽序列进行分析,合成针对优势表位的C14多肽免疫小鼠,制备单克隆抗体,并进行免疫组化鉴定,为CK7的基础研究及制备特异性好和灵敏度高的国产化低成本免疫组化诊断试剂提供试验基础。
1 材料与方法
1.1 材料
1.1.1 CK7多肽片段和动物
CK7多肽片段(14个氨基酸,简称C14多肽)由上海强耀生物合成,其纯度>95%,将其与血蓝蛋白(kyhole limpet hemocyanin,KLH)偶联;BALB/c小鼠购自湖南斯莱克景达实验动物有限公司。
1.1.2 组织样本和伦理批准
组织标本取自湖南师范大学第一附属医院,室温干燥保存备用,试验经湖南师范大学伦理委员会批准。
1.1.3 主要试剂
HRP-羊抗鼠二抗由厦门大学夏宁邵教授惠赠;KLH购自Sigma;SP2/0骨髓瘤细胞系保存于本实验室;培养基1640购自Gibco;胎牛血清 (fetal bovine serum,FBS) 购自ExCell Bio;次黄嘌呤-氨基蝶呤-胸苷培养基 (hypoxanthine-aminopterinthymidine,HAT)、次黄嘌呤和胸苷(hypoxanthine -thymidine,HT)、弗氏完全和不完全佐剂、聚乙二醇(PEG1 500)购自Sigma-Aldrich;聚氰基丙烯酸正丁酯(bicinchoninic acid,BCA)蛋白检测试剂盒、硫酸铵、Protein A/G亲和柱购自生工生物。使用的所有化学品购自生工生物技术公司,均为分子生物学级或更高级别。
1.2 方法
1.2.1 C14多肽序列
通过对CK7的氨基酸序列进行优势表位预测,选择抗原性最强的多肽来制备抗CK7单克隆抗体。该多肽片段由14个氨基酸组成,简称C14多肽,氨基酸序列为KYEDEINHRTAAEN。
1.2.2 C14偶联蛋白动物免疫
将偶联后的C14多肽溶解后与弗氏完全佐剂以1∶1的体积比充分乳化。取5只4~6周龄BALB/c雌鼠采用皮下多点注射的方法进行免疫,共免疫4次,每两周进行一次免疫,剂量为每只50 μg。对达到免疫效价的小鼠,在细胞融合前3 d,对脾脏进行加强免疫,剂量为每只20 μg。每次免疫前取5只小鼠的眼球静脉血,检测血清中抗体滴度变化。
1.2.3 细胞融合、阳性杂交瘤细胞筛选与亚克隆
将生长状态良好的SP2/0骨髓瘤细胞与免疫小鼠的脾脏细胞分别用无血清1640培养基洗涤至无明显颗粒后,以1∶5到1∶10的数量比进行混合,离心弃上清。轻摇离心管使细胞均匀分散后,缓慢加入1 mL 37℃预热的PEG 1500并轻轻吹打混匀,60 s后,立即加入预热的20 mL 1640培养基终止融合,然后加入20% FBS-HAT-1640培养基悬浮细胞并混匀。
将混匀后的培养基均匀铺于96孔板中,置于5% CO2、37℃的培养箱中培养,每天跟踪观察,融合后7~10 d用10% FBS-HT-1640培养液换液,当克隆长至孔底面积的1/3~1/2时,通过有限稀释法对细胞集落数目少且阳性值高的孔进行克隆化。经过4次亚克隆后即得到能稳定分泌特异性单克隆抗体的细胞株,再转移至24孔细胞培养板中扩大培养,取细胞上清进行单克隆抗体效价检测和亚型鉴定。
1.2.4 单克隆抗体效价测定
将C14多肽用碳酸氢盐缓冲液稀释至质量浓度为1 μg/mL,用酶联免疫吸附(enzyme linked immunosorbent assay,ELISA)板包被,4℃过夜。洗板1次后,加入封闭液,37℃放置2 h。洗板5次,加入3株单克隆抗体(0.5 mg/mL),从1∶1 000开始进行倍比稀释,稀释6个梯度,空白为磷酸盐缓冲溶液(phosphate buffer saline,PBS),设置重复对照,37℃孵育30 min。洗板5次,加入HRP-羊抗鼠二抗,37℃孵育30 min。洗板5次,最后加3,3′,5,5′-四甲基联苯胺(3,3′,5,5′-Tetramethylbenzidine,TMB)底物显色剂,37℃反应10 min。加终止液,于450 nm/630 nm双波长处检测光密度(optical density,OD)值。
1.2.5 单克隆抗体的纯化
选用6周以上的BALB/c小鼠,在接种杂交瘤细胞1~2周前,将0.5 mL的液体石蜡注射入小鼠腹腔。收集生长良好的杂交瘤细胞,离心洗涤1次,无血清培养液中重悬,将细胞密度调整为每毫升1×106~2×106个,每只小鼠腹腔注射细胞悬液0.5 mL。7~12 d后,小鼠腹部明显膨大后消毒腹部皮肤,用注射器抽取腹腔腹水。离心吸取淡黄色腹水进行分装,-20℃保存备用。
将饱和硫酸铵溶液以1∶1的体积比缓慢加入抽取的腹水中,混匀,直到出现白色沉淀。离心去上清,用一定体积的PBS(pH 7.45)溶液溶解沉淀,透析平衡至20倍体积的结合缓冲液(Protein A Sefinose Kit中提供)中以除去高浓度的离子。
将试剂盒中的亲和柱保存,垂直安装好,用5 mL结合缓冲液先预平衡亲和柱。加入样品1 mL,用30 mL的结合缓冲液连续穿透亲和柱,控制1 mL/min流速;再用10~15 mL的洗脱缓冲液对亲和柱冲洗,并收集蛋白峰进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)鉴定。亲和层析纯化后收集的抗体透析平衡至PBS(pH 7.45)中,4℃透析12 h,分装后保存备用。
1.2.6 单克隆抗体亚型鉴定
将C14多肽用碳酸氢盐缓冲液稀释至质量浓度为1 μg/mL,ELISA板包被,4℃过夜。洗板1次后加入封闭液,37℃放置2 h。洗板5次,加入3株单克隆抗体的杂交瘤细胞培养上清液,37℃孵育30 min 。洗板5次,分别加入抗IgG1、IgG2a、IgG2b、IgG3、IgM的抗体,37℃孵育30 min。洗板5次,最后加TMB 底物显色剂,37℃反应10 min。加终止液,450 nm/630 nm双波长处检测吸光度值。
1.2.7 单抗相对亲和力测定
将C14多肽用碳酸氢盐缓冲液稀释至质量浓度为1 μg/mL, ELISA 板包被,4℃过夜。洗板1次后加入封闭液,37℃放置2 h。洗板5次,加入纯化的单克隆抗体(0.5 mg/mL),从1∶1 000开始进行倍比稀释,稀释12个梯度,PBS缓冲液为空白,设置重复对照,37℃孵育30 min。洗板5次,加入HRP-羊抗鼠二抗,37℃孵育30 min。洗板5次,最后加入TMB底物显色剂,37℃反应10 min,加入终止液终止反应,最后用酶标仪双波长(450 nm/630 nm)进行检测。
1.2.8 免疫组化检测抗体效价
制备标本,将收集的临床膀胱上皮癌组织和肾嫌色细胞癌组织石蜡标本连续切片,放于载玻片,在65℃烤箱烤片30 min;脱蜡1 h;用3%H2O2进行内源性过氧化物酶阻断,反应15 min。将切片浸入0.01 mol/L枸橼酸钠修复缓冲液,微波炉中加热至沸腾,冷却,重复2次;5%牛血清白蛋白(albumin from bovine serum,BSA)室温封闭1 h,吐温-20磷酸盐缓冲液(phosphate buffered saline Tween-20,PBST)洗涤3次,每次5 min;滴加以1∶200、1∶1 000、1∶5 000梯度稀释的7A8(初始质量浓度为0.49 mg/mL)一抗,37℃、1 h,或者4℃过夜,PBST洗涤3次,每次5 min;滴加二抗,37℃、1 h,PBST洗涤3次,每次5 min;3,3-二氨基联苯胺(Diaminobenzidine,DAB)显色,室温反应约5 min;流水冲洗,苏木精复染2 min,盐酸酒精分化;常规脱水,树胶封片,镜检。
1.2.9 免疫组化检测抗体反应性
制备标本,将收集的临床膀胱上皮癌组织、肾上皮癌组织、肾嫌色细胞癌组织石蜡标本连续切片10片,直肠腺癌组织和正常肠远端切缘组织石蜡标本连续切片5片后,放于载玻片上进行烤片,脱蜡后再用3% H2O2进行内源性过氧化物酶阻断。将切片浸入0.01 mol/L枸橼酸钠修复缓冲液,微波炉中加热至沸腾,冷却,重复2次;5% BSA室温封闭1 h,PBST洗涤后滴加以1∶1 000稀释的7A8一抗;PBST洗涤后滴加二抗;PBST洗涤后DAB室温显色;流水冲洗,苏木精复染后进行盐酸酒精分化;常规脱水,树胶封片,镜检,对结果进行分析,并评价筛选的抗CK7的7A8单克隆抗体。
2 结果与分析
2.1 间接ELISA检测偶联多肽的免疫原性
用间接ELISA检测免疫小鼠血清中抗体效价,免疫前血清作为阴性对照,一般以2.1倍阴性值设定为临界值。小鼠体内IgG抗体水平随着加强免疫,血清阳性值快速增高(图1),说明用KLH偶联的C14多肽能在小鼠体内引起较强免疫反应,具有良好的免疫原性;在第4次免疫之后,百万倍稀释后小鼠血清中IgG效价均已达到制备单克隆抗体的要求。

图1 百万倍稀释后免疫小鼠血清效价Fig. 1 The antibody titers in mice serum after diluted million
2.2 细胞融合、阳性杂交瘤细胞筛选与抗体效价检测
将SP2/0骨髓瘤细胞与免疫小鼠脾脏细胞以1∶5到1∶10的数量比混合,使细胞分散均匀后,将1 mL 37℃预热的PEG 1500缓慢加入并轻轻混匀,60 s后,立即加入预热的1640培养基终止融合,同时加入20% FBS-HAT-1640培养基混匀并悬浮细胞。
将融合后的培养基均匀铺板,于5% CO2、37℃培养,融合后7~10 d换液,再用间接ELISA法对杂交瘤细胞上清液中抗体效价进行检测。采用有限稀释法对阳性克隆进行4次亚克隆后,从50多个阳性克隆中筛选到了3株能稳定分泌抗CK7多肽的单克隆抗体杂交瘤细胞株,此3株单抗第4次亚克隆后,均为阳性,命名为7A8、3H5和6E10。对单克隆抗体效价进行检测,3株抗体效价均达到1∶64 000,即7.8 ng/mL(图2)。
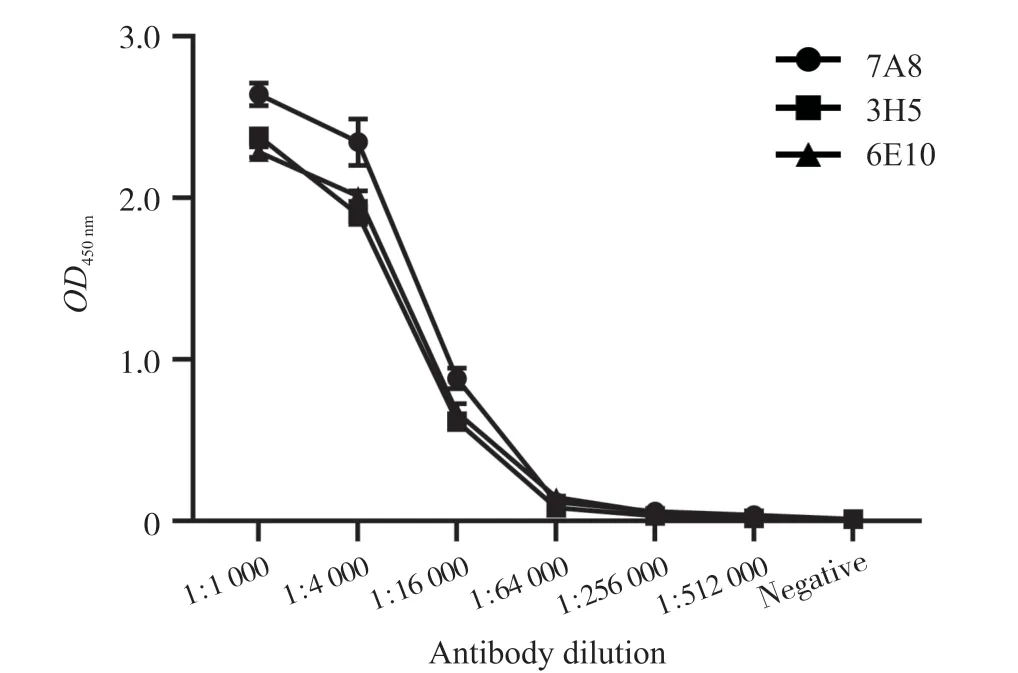
图2 7A8单克隆抗体效价测定Fig. 2 Titer detection of 7A8 monoclonal antibodies.
2.3 单克隆抗体的纯化
将3株杂交瘤细胞株进行培养,取约106个杂交瘤细胞注入BALB/c小鼠腹腔, 8~10 d后可明显看到小鼠腹部膨大,待小鼠腹水达到一定的抗体滴度后,抽取腹水。腹水首先经50%饱和硫酸铵沉淀初步纯化,然后用Protein A亲和柱纯化,收集洗脱峰。将纯化后的腹水抗体制备蛋白样品并进行SDS-PAGE电泳,如图3所示出现了3条条带:25 kD的轻链、50 kD的重链和约100 kD的条带,不煮沸时主要为100 kD的条带,而煮沸后50 kD重链条带质量浓度明显变强(Lane 3、4)。纯化后的抗体主要是25 kD的轻链和50 kD的重链,凝胶上基本没有其他杂蛋白条带。这说明经亲和柱层析后单克隆抗体纯度达到了后续试验的要求。
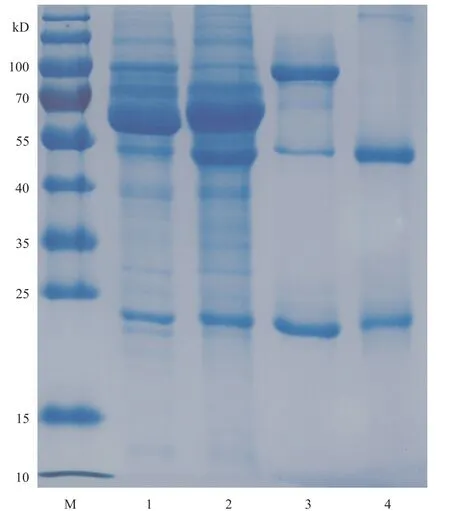
图3 单克隆抗体纯化鉴定 Fig. 3 Identification purity of monoclonal antibody
2.4 单克隆抗体亚型鉴定
取细胞上清,对抗体亚型用间接ELISA鉴定。IgM抗体只产生在第1次免疫后,进行多次免疫后产生的均为IgG抗体。本研究对小鼠进行4次免疫后所获得单克隆抗体均为IgG,与理论相符。经鉴定,单克隆抗体7A8、3H5和6E10亚型均为 IgG2b(图4)。

图4 单克隆抗体亚型鉴定Fig. 4 Subtype identification of monoclonal antibodies
2.5 单抗相对亲和力测定
纯化后单克隆抗体亲和力与其稀释度的关系如图5所示。曲线开始趋于平坦表明抗原与抗体的结合变化不大,即达到饱和,把此时的OD值当作100%,将7A8、3H5和6E10单克隆抗体达到50%饱和时的质量浓度值作为其相对亲和力。单克隆抗体亲和力越小则所需的质量浓度越大,故相对亲和力大小 :7A8>3H5>6E10(表1和图5)。因此,将7A8单克隆抗体用于后续免疫组化鉴定。

表1 纯化抗体的相对亲和力Tab. 1 Relative affinities of purified antibodies
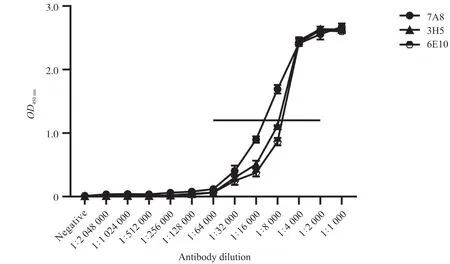
图5 单克隆抗体相对亲和力测定Fig. 5 Determination of relative affinity of monoclonal antibodies
2.6 免疫组化测定抗体效价
自制的7A8(0.49 mg/mL)单克隆抗体以1∶200、1∶1 000、1∶5 000梯度稀释后,分别对临床收集的膀胱上皮癌组织和肾嫌色细胞癌组织进行免疫组化检测,并于显微镜下观察结果。如图6所示,1∶1 000(0.49 μg/mL)稀释后能够更好地对膀胱上皮癌组织和肾嫌色细胞癌组织进行染色,且染色较深,效果更好。目前医院常用的CK7检测试剂盒中抗体质量浓度为2~5 μg/mL,高于本研究筛选获得的7A8单克隆抗体的使用质量浓度0.49 μg/mL,表明本研究7A8抗体灵敏度高,可用于后续临床检测。

图6 7A8单克隆抗体的免疫组化效价鉴定(400ⅹ)Fig. 6 Immunohistochemical titer identification of 7A8 monoclonal antibody (400ⅹ)
2.7 免疫组化鉴定临床组织样本
对临床收集的膀胱上皮癌组织、肾上皮癌组织、肾嫌色细胞癌组织、直肠腺癌组织和正常肠远端切缘组织石蜡标本连续切片后进行免疫组化检测,并通过显微镜观察结果。如表2和图7所示,自制的7A8单克隆抗体以1∶1 000(0.49 μg/mL)稀释后能够较好地对各组织进行染色,膀胱上皮癌组织、肾上皮癌组织、肾嫌色细胞癌组织标本均表达CK7且与筛选的7A8单克隆抗体反应较好,染色较深,与不表达CK7的直肠腺癌组织和正常肠远端切缘组织不反应,表明7A8单克隆抗体特异性较好。

图7 7A8单克隆抗体的免疫组化分析Fig. 7 Immunohistochemical assay of 7A8 monoclonal antibody

表2 CK7在不同组织中的表达 Tab. 2 Expression of CK7 in different tissues
3 讨论
细胞角蛋白的相对分子质量为40~68 kD,广泛存在于上皮细胞中[14]。细胞角蛋白的不同亚型在上皮细胞中以组织特异性方式表达,具有极高的保守性和组织分化特异性。细胞角蛋白与上皮细胞的增殖分化密切相关,是一种常用的肿瘤免疫组织化学标记物,阳性表达见于上皮细胞、间皮细胞等。
CK7是细胞角蛋白家族中一种低相对分子质量蛋白,主要用于上皮组织肿瘤的特异性诊断[15]。研究表明,CK7可以在胰腺、胆管和胆囊中表达,此外在尿路上皮等其他上皮细胞中也有表达[16-17]。由于CK7主要存在于扁平结肠黏膜发育不良病变细胞中,将抗CK7抗体应用于免疫组化鉴定中,是鉴别诊断上皮发育不良的的有用工具。有研究发现,CK7表达还可作为局部晚期宫颈癌同步放化疗反应的预测因素[1,18]。临床工作中通常采取多个指标联合检测提高诊断效率,更有利于对疾病的诊治[19]。将CK7和CK20联合检测,原发性肺肿瘤患者CK7染色结果为强阳性,而CK20为阴性,在癌症转移患者中CK7染色也为阳性。因此,CK7可以作为免疫组化诊断指标,具有明显的诊断、预后和治疗意义[20]。
本研究目的在于获得 CK7 优质单克隆抗体。合成的针对优势表位的 C14 多肽,由14个氨基酸组成,氨基酸序列为 KYEDEINHRTAAEN。该多肽抗原性值最高,制备的抗CK7单克隆抗体用于临床样本检测时具有高特异性。C14多肽对小鼠进行免疫,表现出良好的抗原反应性和免疫原性。本研究经细胞融合和亚克隆筛选出灵敏度高、特异性好的单克隆抗体,并对抗体的性质进行了鉴定,筛选到特异性好、灵敏度高且稳定分泌抗CK7单克隆抗体的细胞株。这为研发免疫组化等方法检测CK7抗原提供了基础,同时也为免疫诊断试剂盒的研制提供了原材料。
将获得的抗C14多肽单克隆抗体建立免疫组化检测方法。收集膀胱上皮癌组织、肾上皮癌组织、肾嫌色细胞癌组织石蜡标本连续切片10片、直肠腺癌组织和正常肠远端切缘组织石蜡标本连续切片5片后进行免疫组化检测CK7。阳性标本均表现出很好的特异性和灵敏度,阴性标本和正常组织均不与本研究制备的7A8单克隆抗体反应,表现出很好的特异性,为相关肿瘤的诊断及治疗提供有效的方法。目前医院常用的CK7检测试剂盒中抗体的质量浓度为1 mg/mL,以1∶200到1∶500稀释,即抗体质量浓度为 2~5 μg/mL,均高于本研究筛选获得的7A8单克隆抗体使用的质量浓度0.49 μg/mL。这表明该单克隆抗体灵敏度高,且本研究的单克隆抗体对阳性标本、阴性标本和正常组织检测结果与医院常用试剂盒检测结果一致,表现出很好的特异性,可用于后续临床检测的研究。目前,国内CK7单克隆抗体市场紧缺,CK7作为肿瘤检测指标还未全面推广。因此,本研究获得的拥有自主知识产权的针对优势表位的单克隆抗体可以特异性快速地识别组织标本中的CK7抗原,很大程度上降低了检测费用,提高了检测效率,具有较好的应用前景,为国内CK7的临床诊断及研究提供了有效的原材料。

