630 nm LED照射促进TRPV1表达诱导 成纤维样滑膜细胞凋亡
吴 昊,刘倩楠,刘海亮,张凤民,宋武琦
(哈尔滨医科大学医学微生物学教研室,哈尔滨医科大学伍连德研究所,哈尔滨 150081)
类风湿关节炎(rheumatoid arthritis,RA)的病理表现主要有成纤维样滑膜细胞增生、间质大量炎性细胞浸润及软骨和骨组织的破坏[1]。全世界RA 患者约占总人口的1.40%,我国发病率为0.20%~0.93%,致残率达15%[2]。处于类风湿性关节病理状态下的成纤维样滑膜细胞大量增生后,其迁移性和移动性增强,侵犯软骨并破坏关节软骨,从而进一步加重病情[3]。研究表明,成纤维样滑膜细胞的过度增殖与凋亡的失衡是类风湿性关节炎的发病机制之一[4]。目前,对于RA的治疗方法包括药物治疗、外科手术治疗和物理疗法[5]。物理疗法中光疗法作为辅助治疗手段广泛应用于临床[6]。
瞬时受体电位通道(transient receptor potential,TRP)家族是一种非选择性的阳离子通道,并且对各种物理刺激和化学刺激高度敏感,包括磷酸化、机械力和渗透压[7]。TRP最初是在果蝇的光感受器中发现的,并在哺乳动物中拥有6种亚型:TRPV、TRPM、TRPA、TRPC、TRPP和TRPM[8-9]。通过激动剂、阻断剂、敲除小鼠基因等手段,瞬时受体电位香草素1 (transient receptor potential vanilloid 1,TRPV1)的作用也被不断阐明[10-12]。随着研究的进行,TRPV1被证明具有抑制炎症、抑制细胞增殖、促进细胞凋亡等作用,并且是多种疾病的治疗靶点[13-17]。
光生物调节法(photobiomodulation,PBM)是一种新的物理疗法,它利用的是低剂量光照传递到内源性靶点的发色团,与刺激外源性发色团的光动力疗法相反[18]。PBM也被称为低水平激光治疗(lowlevel laser therapy,LLLT),与传统激光疗法相比,其优点是具有非侵入性,可以将光的能量密度降低到对机体不产生任何损伤[19]。目前为止,LLLT已被证实有抗炎、促进细胞凋亡、促进伤口愈合与骨的再生等功效[20-23]。LLLT的光源分为激光和LED。其中LED作为第四代光源,具有节能、环保、电光转化效率高等优点,在LLLT中的应用越加普遍。
虽然该领域已有许多相关研究成果,但光疗法的机制还不明确,它涉及的通路也并不完善。有研究证实,通过810 nm激光照射鼠胚成纤维细胞时,在0.003 J/cm2剂量下,NF-κB被明显活化,证明光照会影响到NF-κB信号通路[24]。也有研究发现,LLLT可以通过PI3K-Akt信号通路来抑制凋亡,其主要机理是激活Akt,并在增强Akt与GSK-3β互作的同时,降低GSK-3β与Bax的相互作用,从而抑制凋亡[25]。但也有人证实,LLLT通过调控Akt/mTOR信号通路,增强肿瘤细胞的侵袭性[26]。除机制不完善外,光疗的双相效应也是其中一大难点,各项参数的设置也尚未明确。本研究使用TNF-α诱导的人成纤维样滑膜细胞(MH7A)作为类风湿性关节炎体外模型,研究630 nm LED光照对成纤维样滑膜细胞的作用及其机制。
1 材料与方法
1.1 细胞培养
人成纤维样滑膜细胞系购自北纳生物科技有限公司。用含有10%胎牛血清 (fetal bovine serum,FBS)和1%双抗的DMEM培养基(Dulbecco’s modified Eagle medium,DMEM)培养细胞。
本试验共6个组别,分别是阴性对照组(NC组)、无TNF-α刺激的LED光照组(LED组)、TNF-α刺激组(TNF组)、TNF-α刺激的LED光照组(LEDTNF组)、TNF-α及TRPV1抑制剂SB366791刺激组(TNF+SB366791组)和TNF-α及TRPV1抑制剂SB366791刺激的LED光照组(LED-TNF+SB366791组)。当MH7A细胞于培养箱过夜培养12 h后,NC组和LED组换成新的10% DMEM完全培养液,TNF组和LED-TNF组换成含10 ng/mL TNF-α(PeproTech,美国)的10% DMEM完全培养液。为抑制TRPV1活性,TNF+SB366791组和LED-TNF+SB366791组换成含10 μmol/L SB-366791(MCE,美国)及10 ng/mL TNF-α的10% DMEM完全培养液。
1.2 630 nm LED红光照射
本试验所用LED灯由创盈光电科技(北京,中国)有限公司研制,研究采用39 J/cm2的能量密度。相关参数如表1所示。
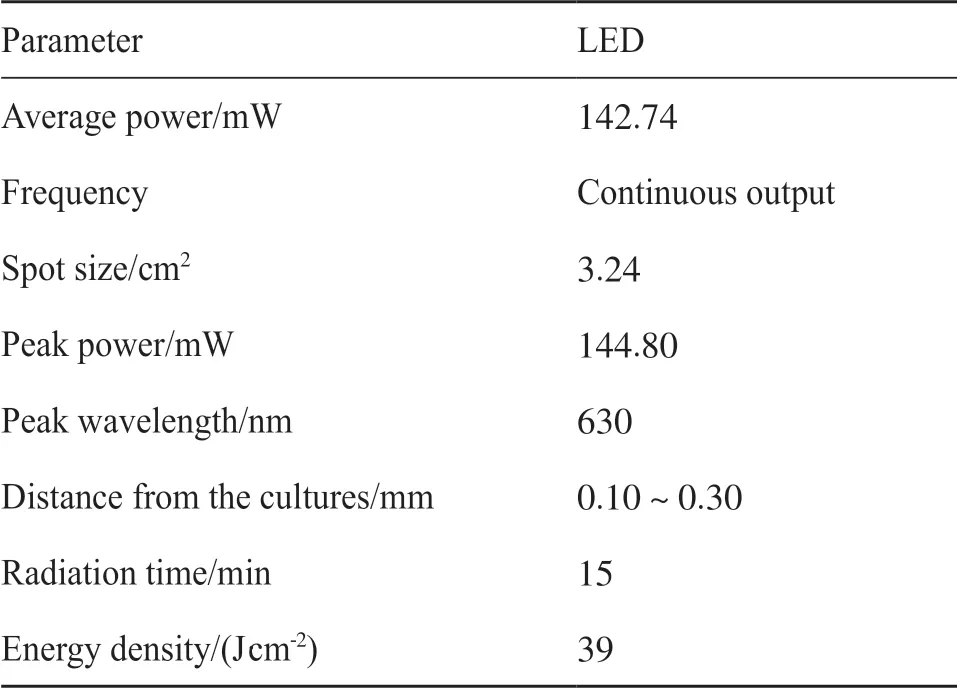
表1 LED光疗相关参数Tab. 1 Related parameters of the LED light used in the experiment
6 h后开始第一次630 nm LED红光照射,每隔1.5 h照射一次,每次照射时间为15 min,共照射5次,随后收集样品进行相关检测。LED相关照射组放在通风的生物安全柜内室温照射,无照射组用锡纸完全包裹也放在通风的安全柜中,照射流程如图1所示。

图1 LED光照流程Fig. 1 The flow chart of LED light irradiation
1.3 CCK-8法检测630 nm LED照射对MH7A细胞活力的影响
将适量密度的MH7A细胞用胰酶消化成细胞悬液后,通过细胞计数板计算细胞密度。根据每孔体系100 μL且细胞数量为1×104个计算出所需要的细胞悬液体积和10% DMEM完全培养基的体积,然后接种于96孔板。630 nm LED差异照射结束后,立刻向96孔板每孔加入10 μL的CCK-8溶液。于细胞培养箱中孵育1 h后,立刻使用酶标仪测定450 nm 处的吸光度。
1.4 凋亡检测试剂盒(TUNEL法)检测630 nm LED照射对MH7A细胞凋亡的影响
收集对数生长期的细胞进行胰酶消化处理,离心获取细胞沉淀后用DMEM完全培养液重悬,进行细胞计数,每孔加入500 μL细胞悬液,每孔接种细胞数量为1×105个。利用630 nm LED照射处理,末次照射后立即收取细胞,用1×磷酸盐缓冲溶液(phosphate buffer saline,PBS)洗涤细胞,用4%多聚甲醇进行固定,4℃过夜,按照说明书(凯基生物,中国)进行TUNEL试验。试验结束后利用荧光显微镜观察,用ImageJ软件计算荧光强度。
1.5 线粒体膜电位检测试剂盒(JC-1)检测630 nm LED光照后MH7A细胞线粒体膜电位的变化
将处于对数生长期的MH7A细胞用胰酶消化成细胞悬液后,通过细胞计数板计算细胞密度。根据每孔细胞数量为3×105个的体系计算出所需要的细胞悬液体积和10% DMEM完全培养基的体积,然后接种于6孔板。630 nm LED差异照射结束后,按照说明书(Biosharp,中国)进行JC-1试验。试验结束后利用荧光显微镜进行观察。
1.6 CASP3和CASP9活性检测
收集照射好的细胞,参考CASP3活性检测试剂盒(碧云天,中国)和CASP9活性检测试剂盒(碧云天,中国)的说明书进行相关操作,并取少量样品测定蛋白质量浓度。由于这两种活性检测试剂盒中有高浓度的二硫苏糖醇(Dithiothreitol,DTT)成分,所以采用考马斯亮蓝法检测待测样品中的蛋白质量浓度,具体操作参考试剂盒说明书(碧云天,中国)。
1.7 实时荧光定量PCR(quantitative real-time PCR,RT-qPCR)
收集照射好的细胞,按照RNA极速提取试剂盒(HaiGene,中国)说明书提取RNA,使用Nanodrop 2000仪器进行RNA质量浓度测定,根据测得的RNA质量浓度进行RT-qPCR。使用HiFiScript cDNA Synthesis Kit(Invitrogen,美国)进行逆转录,逆转录RNA的量为1 μg。使用SYBR green qPCR Master Mix(TaKaRa,日本)进行荧光定量PCR试验。具体反应程序和体系参考说明书。引物序列如表2所示。

表2 RT-qPCR引物序列Tab. 2 The primer sequences of RT-qPCR
1.8 Western blot检测630 nm LED照射对MH7A细胞中TRPV1蛋白表达的影响
收集照射好的细胞,用适量的蛋白裂解液提取蛋白。蛋白裂解液由含1%苯甲基磺酰氟(phenylmethylsulfonyl fluoride,PMSF)的RIPA裂解液(碧云天,中国)配置而成。用BCA 蛋白浓度测定试剂盒(碧云天,中国)进行蛋白质量浓度测定后,将样品置于10%丙烯酰胺凝胶电泳(sodium dodecyl sulfatepoly-acrylamide gel electrophoresis,SDS-PAGE)凝胶上分离,然后转移到聚偏氟乙烯(polyvinylidene fluoride,PVDF)上转膜(20 V 恒压,2 h)。PVDF膜浸泡在5%脱脂奶粉的TBST中室温封闭2 h。4℃一抗孵育过夜,TRPV1抗体1∶1 000稀释,β-actin抗体1∶2 000稀释。1×TBST洗膜3次,每次15 min。二抗1∶2 500稀释室温孵育1 h,用1×TBST洗膜3次,每次15 min。用ECL Western Bloting Substrate(Thermo)进行显色。
1.9 统计学分析
所有试验均重复3次及以上,RT-qPCR等结果运用GraphPad Prism(version 5.1)软件进行非配对t检验统计学分析;试验数据均以平均值±标准差(±s)表示,以P<0.05为差异具有统计学意义(*P<0.05,**P<0.01,***P<0.001)。
2 结果与分析
2.1 630 nm LED照射对MH7A细胞活力的影响
我们通过CCK-8探究630 nm LED照射对MH7A细胞活力的影响,结果如图2所示。在有TNF-α刺激和无TNF-α刺激的MH7A细胞中,630 nm LED都可以显著性抑制MH7A细胞的活力。
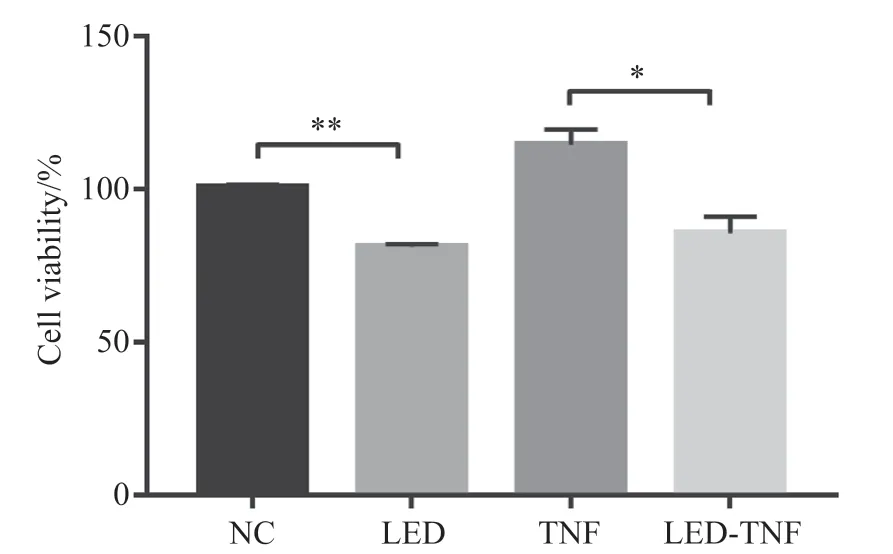
图2 CCK-8试验分析630 nm LED照射对MH7A细胞活力的影响Fig. 2 The effects of 630 nm LED irradiation on MH7A cell activity was analyzed by CCK-8 assay
2.2 630 nm LED光照诱导MH7A细胞凋亡
通过TUNEL细胞凋亡检测试剂盒探究630 nm LED照射对细胞凋亡情况的影响,结果如图3所示。结果表明,在有TNF-α刺激和无TNF-α刺激的MH7A细胞中,630 nm LED照射均能增加细胞的 绿色荧光强度。这提示630 nm LED 照射能够诱导MH7A细胞凋亡。
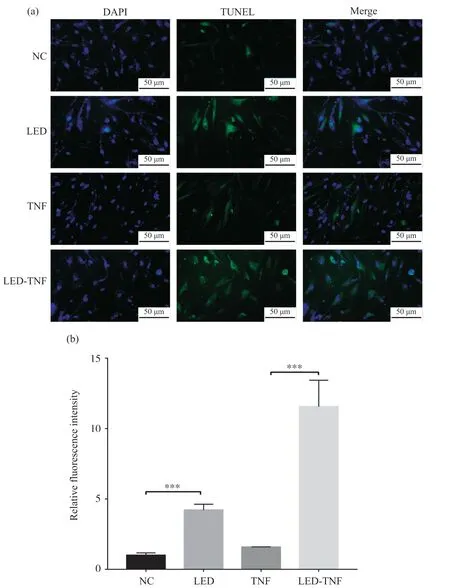
图3 630 nm LED照射诱导MH7A细胞凋亡Fig. 3 630 nm LED irradiation induce of MH7A cells apoptosis
2.3 线粒体膜电位检测试剂盒(JC-1)检测630 nm LED光照后MH7A细胞线粒体膜电位的变化
我们通过JC-1探究630 nm LED照射对MH7A细胞线粒体膜电位的影响,结果如图4所示。在有TNF-α刺激和无TNF-α刺激的MH7A细胞中,630 nm LED光照后线粒体聚合物(红光)明显下降,单体(绿光)明显增加,说明线粒体膜电位明显下降。因此,630 nm LED红光可以降低MH7A细胞的线粒体膜电位。

图4 630 nm LED照射后MH7A细胞线粒体去极化Fig. 4 Mitochondrial depolarization in MH7A cells after 630 nm LED irradiation
2.4 630 nm LED照射对CASP3、CASP9活性的影响
我们通过CASP3、CASP9活性检测试剂盒探究630 nm LED照射对MH7A细胞CASP3、CASP9的酶活性的影响,结果如图5所示,630 nm LED光照后,CASP3和CASP9的酶活性显著增加。

图5 照射后MH7A细胞CASP3和CASP9活性的相对水平Fig. 5 Relative levels of CASP3 and CASP9 activity in MH7A cells after irradiation
2.5 630 nm LED照射对MH7A细胞TRPV1的mRNA转录水平的影响
通过RT-qPCR检验TRPV1在630 nm LED红光照射下的变化情况,结果如图6所示。被TNF-α刺激后,630 nm LED红光可以促进TRPV1的mRNA表达;在无TNF-α刺激的MH7A细胞中,LED组中TRPV1的mRNA变化水平同NC组相比略有上升,然而没有统计学意义。
2.6 Western blot检测630 nm LED红光对MH7A细胞TRPV1表达的影响
通过Western blot 检测630 nm LED红光对MH7A细胞TRPV1蛋白表达的影响,结果如图7所示。被TNF-α刺激后,630 nm LED红光可以促进MH7A细胞中的TRPV1蛋白合成;在无TNF-α刺激的MH7A细胞中,LED组的TRPV1蛋白表达水平同NC组相比有升高趋势,但无统计学意义。

图7 630 nm LED照射后MH7A细胞中TRPV1的相对蛋白水平Fig. 7 Relative protein levels of TRPV1 in MH7A cells after 630 nm LED irradiation
2.7 TRPV1拮抗剂对630 nm LED照射的MH7A细胞活力的影响
我们通过CCK-8探究TRPV1拮抗剂SB-366791对630 nm LED 照射的MH7A细胞活力的影响,结果如图8所示。630 nm LED 照射降低TNF-α刺激下MH7A细胞活力,但630 nm LED照射对于TNF-α刺激的TRPV1拮抗剂处理的细胞活性无影响,证明在TNF-α刺激条件下,630 nm LED照射通过TRPV1调控细胞活力,并且TRPV1拮抗剂对TNF-α刺激的细胞活性无影响。
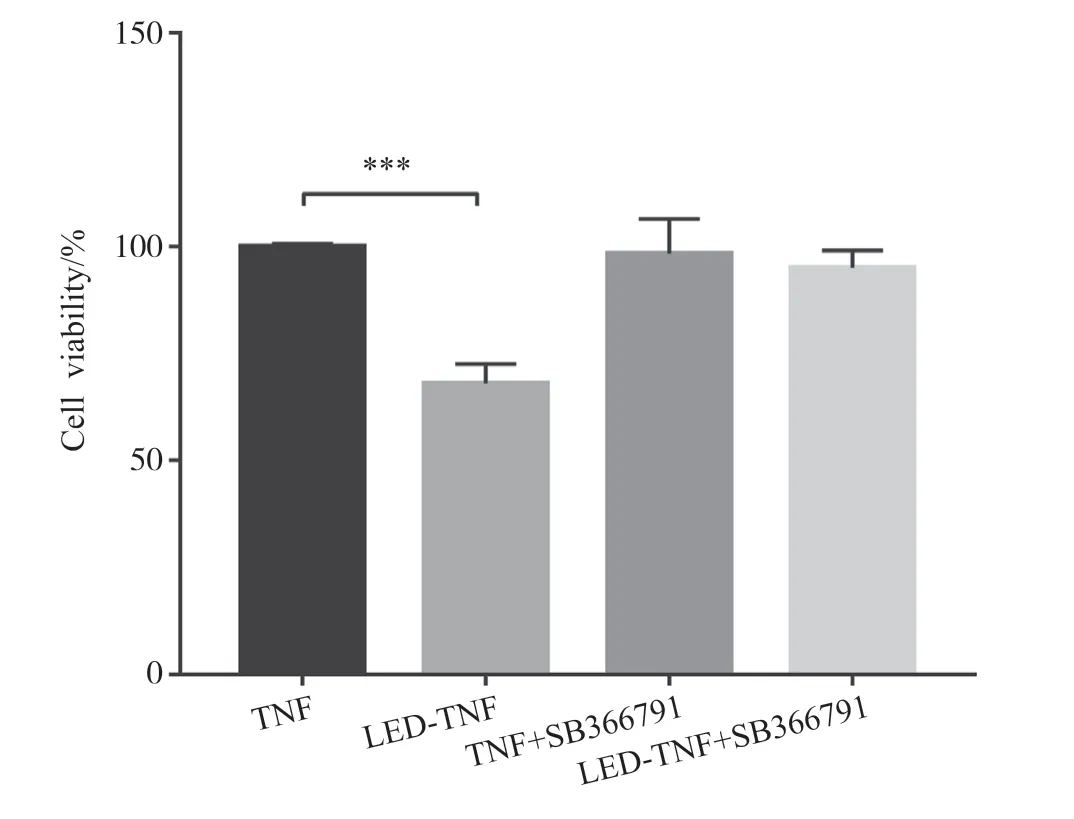
图8 TNF-α和SB-366791刺激后MH7A细胞的CCK-8结果Fig. 8 CCK-8 results of MH7A cells with TNF-α and SB-366791 stimulation after irradiation
2.8 TRPV1拮抗剂抑制630 nm LED照射诱导的MH7A细胞凋亡
TUNEL结果如图9所示,630 nm LED照射增强了TNF-α刺激下MH7A细胞绿色荧光强度,TRPV1拮抗剂SB-366791处理后MH7A细胞荧光强度与TNF-α单独刺激相比无明显变化。TNF-α刺激条件下,SB-366791处理细胞后,630 nm LED照射未增强MH7A细胞绿色荧光强度。结果表明,TRPV1拮抗剂抑制630 nm LED照射诱导的成纤维滑膜细胞凋亡。
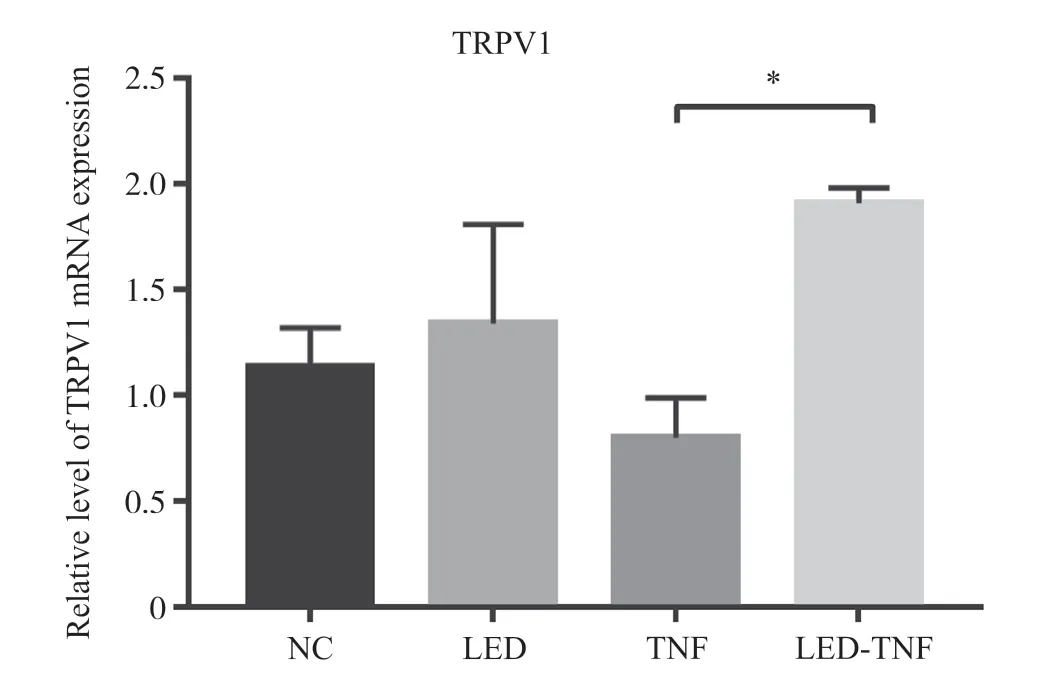
图 6 630 nm LED红光照射后MH7A细胞中TRPV1 mRNA的相对水平Fig. 6 Relative mRNA levels of TRPV1 in MH7A cells after 630 nm LED red light irradiation
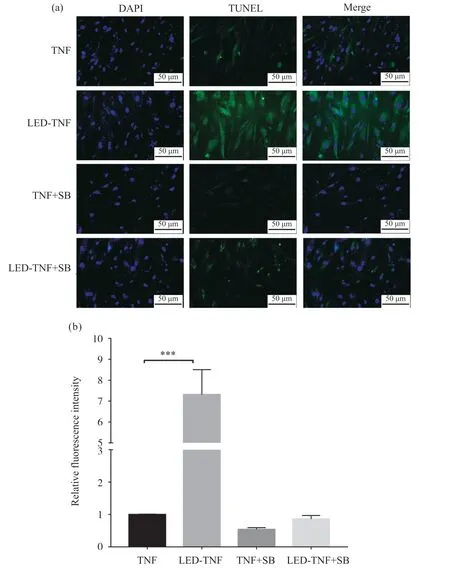
图9 630 nm LED照射TNF-α和SB-366791刺激后MH7A细胞的TUNEL结果Fig. 9 TUNEL results of MH7A cells with TNF-α and SB-366791 stimulation after irradiation
3 讨论
本研究所用的MH7A细胞是采用SV40 T抗原基因稳定转染类风湿性关节炎成纤维样滑膜细胞( rheumatoid arthritis fibroblast-like synoviocytes,RAFLS)后所建立的一种永生化细胞。与原代RA-FLS细胞相比较,MH7A细胞具有生长快、营养要求较低、易离体培养等优点。因此,我们通过TNF-α处理的MH7A细胞作为类风湿性关节炎的炎症环境模型,来探讨630 nm LED红光对类风湿性关节炎的治疗机制。
研究表明,成纤维样滑膜细胞的过度增殖与凋亡的失衡是类风湿性关节炎发病机制之一,诱导这种细胞凋亡有望成为一个新的治疗目标[4]。在对类风湿性成纤维样滑膜细胞凋亡的研究中,一些潜在治疗机制也随之诞生,如Fas配体信号通路、NF-κB信号通路、PI3K-Akt信号通路和P53信号通路等[27]。
PBM也被称为LLLT,与传统激光疗法相比,其优点是具有非侵入性,可以将光的能量密度降低到对机体不会产生任何损伤[6]。目前为止,低水平激光疗法已被证实对RA疾病有治疗效果。Yamaura等[28]利用810 nm波长的激光照射RA-FLS,发现5 J/cm2的辐射可以降低RA滑膜细胞中TNF-α和IL-1β的mRNA水平;在25 J/cm2的剂量下激光照射治疗能够降低细胞内的TNF-α、IL-1β和IL-8蛋白水平。此外,Meng等[29]进一步证实了630 nm LED可以通过PI3K-Akt-mTOR途径抑制RA成纤维样滑膜细胞的增殖。
本研究中我们做了CCK-8、JC-1、TUNEL相关凋亡试验,证实了630 nm LED红光可以抑制MH7A细胞的增殖活力,降低线粒体膜电位,诱导细胞凋亡。同时,我们利用CASP3活性检测试剂盒和CASP9活性检测试剂盒,进一步证明了630 nm LED红光可以增加CASP3和CASP9的酶活性。综上所述,630 nm LED红光可以促进类风湿性关节炎MH7A细胞凋亡。
自20世纪末期,TRPV1蛋白被成功克隆出来后,人们对该蛋白的结构和功能进行了广泛的研究[30]。TRPV1是第一个被发现的TRPV亚家族成员,也是迄今为止研究最广泛的成员。TRPV1与凋亡密切相关。已有研究证实,细胞膜TRPV1受体的正变构调节和内质网定位的TRPV1通道的激活都与促凋亡通路有关[30-32]。TRPV1介导的凋亡效应开始于受体与外源性激动剂的结合,以及通过非配体手段(如磁场)激活受体。由于TRPV1是配体门控的阳离子通道,激动剂结合导致Ca2+和Na+内流进入细胞。值得注意的是,TRPV1对Ca2+的亲和力大于Na+[33]。当TRPV1被激活后,钙离子的内流就会增加,而钙离子内流是凋亡的关键因素。有研究进一步证实,TRPV1也可通过线粒体途径控制凋亡,辣椒素(激动剂)对TRPV1的激活导致毛细血管扩张性共济失调症突变基因(ataxia telangiectasia mutated,ATM)中的丝氨酸-苏氨酸激酶磷酸化和激活,从而诱导下游的Fas通路[34-35]。而ATM激活可以上调Fas/CD95死亡受体,该受体与TRPV1共簇形成死亡信号复合物。该复合物在TRPV1介导的细胞凋亡中的作用是能够将没有活性的pro-CASP8裂解成有活性的CASP8,进而导致线粒体功能障碍[35]。
TRPV1作为一种离子通道,可被多种刺激因素激活,包括温度、渗透压变化、化学刺激。近来研究表明,TRPV1也可以被光激活。Wang等[36]发现,用蓝光(415 nm)、绿光(540 nm)照射人类脂肪来源干细胞可以显著增加钙离子内流和ROS的产生,并且这种效果可以被TRPV1的阻断剂抑制,进而证实了蓝光和绿光可以激活TRPV1离子通道。
在探讨TRPV1在关节炎致病作用的研究中,相关报道表明,WIN(合成大麻素,抗炎药物)激活CB2、TRPV1、TRPA1和尚未确定的靶点来减少类风湿关节炎成纤维样滑膜细胞中炎症介质的产生[37];同时,也有研究表明,TRPV1可以通过钙通道依赖的ROS和线粒体去极化来介导大鼠成纤维样滑膜细胞死亡[38]。因此,TRPV1可能是类风湿性关节炎潜在的治疗靶点。在本研究中,我们使用630 nm LED红光照射TNF-α刺激后的MH7A细胞,通过Western blot试验发现,在炎症环境下,630 nm LED红光可以促进TRPV1蛋白和其mRNA的表达。为了进一步验证630 nm LED红光通过TRPV1促进MH7A细胞凋亡,我们使用了TRPV1的拮抗剂SB-366791。CCK-8试验表明,630 nm LED红光虽然可以抑制TNF-α刺激的MH7A细胞的活力,但这种抑制效果会被TRPV1拮抗剂削弱。同样,TUNEL试验也表明,630 nm LED红光虽然可以促进TNF-α刺激的MH7A细胞凋亡,但这种效果会被TRPV1拮抗剂削弱。
综上,我们的研究结果表明,630 nm LED红光通过调控TRPV1促进炎症状态下的MH7A细胞凋亡,这对辅助缓解RA滑膜炎症有一定作用。

