结直肠癌组织钙离子结合蛋白14、16的表达及与预后的关系研究
苗金鱼,何丽彩,刘 媛,张建锋,王春艳,王敬然,丁秋蕾,边浩鹏
1.石家庄市人民医院检验科,河北石家庄 050000;2.河北省优抚医院外一科,河北石家庄 050000;3.河北医科大学第四医院普外科,河北石家庄 050000;4.石家庄市人民医院肿瘤科,河北石家庄 050000;5.石家庄市人民医院普外科,河北石家庄 050000
结直肠癌(CRC)是当今世界上第四大致命癌症,每年有近90万人死于CRC,并且CRC的发病率有逐年升高的趋势[1]。目前,CRC的治疗以手术治疗、辅助或新辅助化疗及放疗为主,但对于晚期转移性患者,即使积极进行综合治疗,其预后仍较差[2]。深入研究CRC的发生机制,寻找新的CRC标志物,对于CRC的早期诊断、个体化治疗的选择和预后预测具有重要的临床价值。钙离子结合蛋白14(S100A14)、钙离子结合蛋白16(S100A16)均属于S100钙离子结合蛋白家族成员,均位于人类一号染色体,具有典型的EF-手型钙离子结合基序,以同源二聚体或异源二聚体复合物形式发挥功能[3]。S100A14 、S100A16参与多种调控机制和途径,通过与自分泌的酶、受体、细胞骨架、转录因子和核酸相互作用,影响钙稳态、代谢、增殖、凋亡、迁移、分化、炎症等生理、病理学过程[4]。近年来研究发现,S100A14、S100A16参与乳腺癌等恶性肿瘤的发生、发展过程,影响肿瘤细胞迁移和侵袭、细胞生长和细胞死亡、肿瘤细胞与肿瘤微环境的相互作用等生理、病理过程[5-6]。有研究报道,肿瘤细胞中S100A14与S100A16之间存在相互协同作用,共同参与肿瘤的恶性进展[7]。由于S100A14通过激活趋化因子配体2,促进肿瘤转移,CRC中也存在趋化因子配体2激活的现象,推测S100A14在CRC中可通过相似机制发挥作用[5,8]。本研究通过检测CRC组织中S100A14、S100A16的表达情况,并探讨两者与患者临床病理参数及预后的关系,以期明确S100A14、S100A16在CRC中表达的临床意义。
1 资料与方法
1.1一般资料 选取2015年2月至2018年2月石家庄市人民医院(下称本院)收治的136例CRC患者为研究对象。其中男82例,女54例;年龄39~78岁,平均(68.52±8.27)岁;肿瘤位置:直肠54例,结肠82例;病理类型:黏液腺癌及其他33例,管状腺癌103例;TNM分期:Ⅰ~Ⅱ期103例,Ⅲ期33例;肿瘤分化程度:高、中分化94例,低分化42例;肿瘤大小:≤4 cm者55例,>4 cm者81例。纳入标准:(1)术后病理检查确诊为CRC;(2)初次诊治;(3)一般健康状况良好,卡氏评分>70分;(4)具备手术指征,均完成CRC根治术。排除标准:(1)伴心肺功能衰竭;(2)临床资料不完整;(3)伴严重心脑血管疾病或精神障碍疾病。患者及其家属均知情同意本研究并已签署同意书,本研究通过本院医学伦理委员会审核通过。
1.2免疫组织化学法检测 将手术切除的癌组织及癌旁组织(距离癌组织边缘2 cm以上)用10%中性甲醛固定过夜,石蜡包埋组织后切片机切片,60 ℃烤片2 h;二甲苯脱蜡两遍;梯度乙醇水化;高压锅法柠檬酸盐缓冲液中进行抗原热修复;3%过氧化氢阻断内源性过氧化物酶15 min;封闭液封闭2 h;兔抗人多克隆抗体37 ℃孵育2 h,S100A14、S100A16一抗稀释比1∶500,抗体购自英国Abcam公司,货号:ab251779、ab130419;山羊抗兔二抗孵育1 h;辣根过氧化物酶标记三抗孵育1 h;DAB显色;苏木素复染5 min;梯度乙醇脱水,中性树胶封片后,倒置显微镜400倍下观察(型号:CKX53,厂家:日本奥林巴斯株式会社)。免疫组化染色结果用染色面积评分乘以染色强度评分表示,由两位病理科医师共同阅片诊断并打分。染色面积:无染色为0分,染色面积<25%为1分,25%~50%为2分,>50%为3分;染色强度:无染色为0分,淡黄色为1分,深黄色为2分,褐色为3分。二者乘积小于3分为阴性,大于等于3分判定为阳性[9]。
1.3随访 所有患者自出院开始进行随访,以电话或者门诊复查方式进行随访,随访截至2021年2月。随访终点为患者死亡或随访结束。
1.4统计学处理 采用SPSS20.0软件进行统计分析。计数资料采用例数或百分率表示,组间比较采用χ2检验。以Spearman秩相关分析S100A14与S100A16表达的相关性。采用Kaplan-Meier法及Log-rank检验分析不同S100A14、S100A16表达情况CRC患者的生存情况。COX比例风险回归分析影响CRC患者预后的危险因素。以P<0.05为差异有统计学意义。
2 结 果
2.1CRC组织及癌旁组织中S100A14、S100A16表达 CRC组织中S100A14、S100A16阳性表达率明显低于癌旁组织中S100A14、S100A16的阳性表达率,差异有统计学意义(P<0.05)。见表1。

表1 CRC组织及癌旁组织中S100A14、S100A16表达[n(%)]
2.2CRC组织中S100A14、S100A16表达的相关性 利用Spearman秩相关分析CRC中S100A14、S100A16表达的相关性,结果显示S100A14与S100A16表达呈正相关(r=0.595,P<0.001)。
2.3CRC组织中S100A14、S100A16表达与临床病理参数的关系 CRC组织中S100A14、S100A16表达与TNM分期、肿瘤分化程度有关(P<0.05),与年龄、性别、病理类型和肿瘤位置、肿瘤大小无关(P>0.05)。见表2。

表2 CRC组织中S100A14、S100A16表达与临床病理参数的关系[n(%)]
2.4CRC组织中不同S100A14、S100A16表达患者生存预后比较 136例CRC患者中,失访2例,死亡40例,存活94例,3年生存率为70.15%(94/134)。S100A14阳性表达患者41例,死亡5例,3年生存率为87.80%(36/41);S100A14阴性表达患者93例,死亡35例,3年生存率为62.37%(58/93)。S100A14阴性表达患者3年生存率明显低于阳性表达患者,差异有统计学意义(χ2=6.532,P=0.011)。S100A16阳性表达患者37例,死亡4例,3年生存率为89.19%(33/37);S100A16阴性表达患者97例,死亡36例,3年生存率为62.89%(61/97)。S100A16阴性表达患者3年生存率明显低于阳性表达患者,差异有统计学意义(χ2=7.270,P=0.007)。见图1。
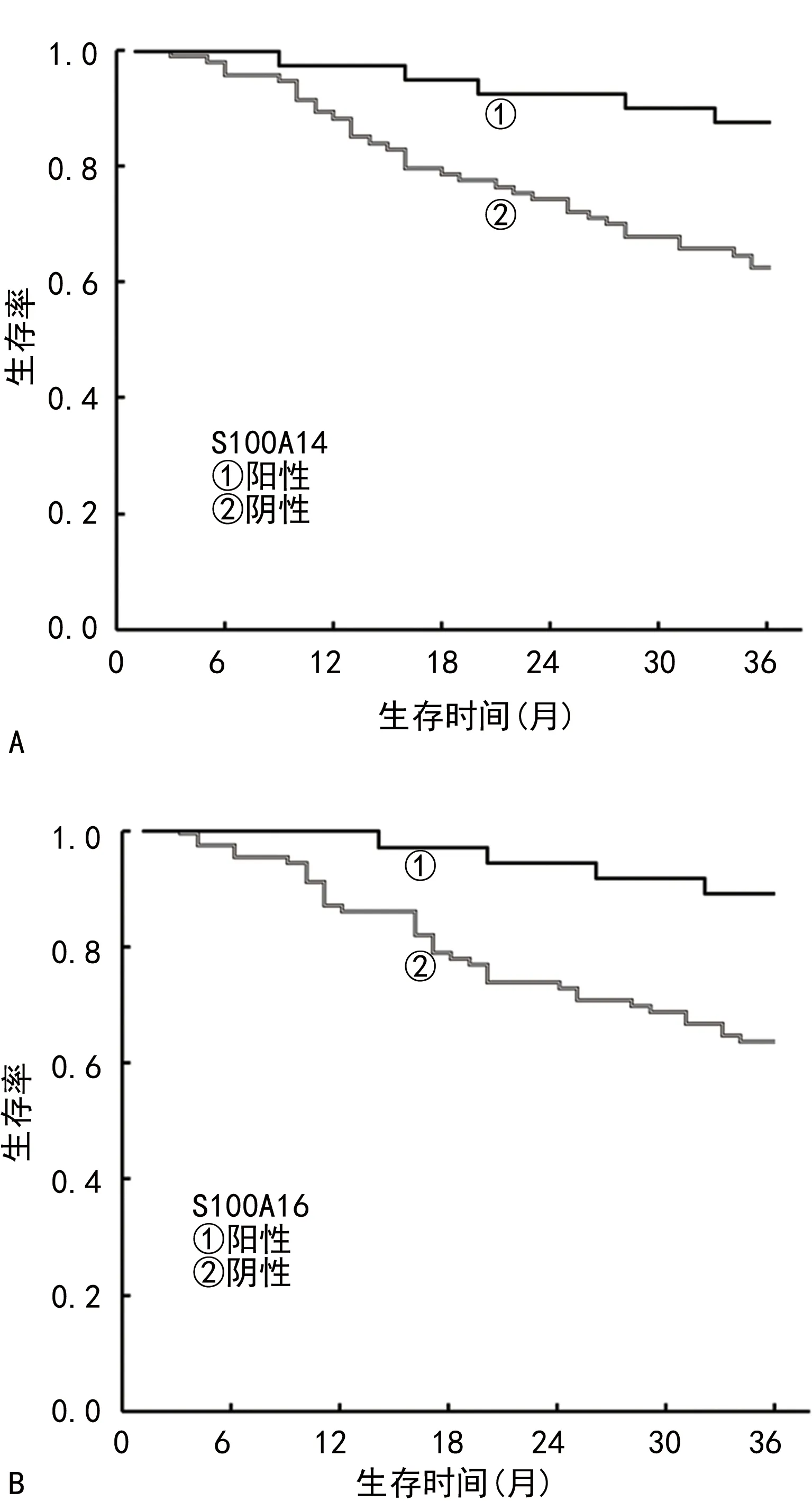
图1 不同S100A14、S100A16表达情况CRC患者的生存曲线
2.5COX比例风险回归分析影响CRC患者预后的危险因素 以CRC患者为样本,建立COX比例风险回归模型。以CRC患者的生存预后为因变量(赋值:1=死亡,0=生存,t=生存时间),自变量包括CRC患者的年龄、性别、肿瘤大小、病理类型、肿瘤位置、肿瘤分化程度、TNM分期、S100A14、S100A16,分析结果表明TNM分期Ⅲ期、S100A14阴性、S100A16阴性是影响CRC患者预后的危险因素(P<0.05,HR>1)。见表3。

表3 影响CRC患者预后的Cox比例风险回归分析
3 讨 论
CRC约占全世界每年诊断的癌症和癌症相关死亡人数的10%,它是女性中第二常见的癌症,男性中第三常见的癌症[1]。多种因素均能够增加CRC的发病风险,包括人口老龄化、炎性肠病及家族遗传病史等,吸烟、饮酒等不良生活方式也影响CRC的发生[10]。深入探索CRC的疾病机制,寻找CRC预后判断的肿瘤标志物具有重要意义。目前认为,CRC的发生与染色体不稳定性、微卫星不稳定性和CpG岛甲基化有关,涉及促癌基因如原癌基因KRAS、磷脂酰肌醇3激酶(PI3K)等的过度激活和抑癌基因APC、TP53等的失活。例如APC突变导致β-连环蛋白易位到细胞核并驱动与肿瘤发生和侵袭有关的基因的转录[11],而 KRAS 和PI3K的突变导致MAP激酶的持续激活,从而促使细胞增殖[12]。因此,寻找影响CRC发生发展过程中关键驱动基因的表达变化,有利于CRC的预后判断。
S100家族蛋白由 21 种不同的亚型组成,包括S100A、S100B、S100P及S100Z。17 种 S100A亚家族蛋白(包括 S100A14、S100A16等)位于染色体 1q21 上的2Mb区域内[4]。大多数S100家族蛋白能够通过影响晚期糖基化终产物受体、表皮生长因子受体通路和p53通路,在多种恶性肿瘤中发挥促进肿瘤增殖和转移的作用[13-14]。S100A14蛋白编码基因包含2 165个碱基,编码104个氨基酸,主要表达在结直肠黏膜、胃、卵巢及输卵管等组织[7]。有研究发现,S100A14在乳腺癌、宫颈癌等肿瘤中异常表达,并能够促进肿瘤的增殖[5,15]。本研究中,CRC组织中S100A14的表达显著下调。目前CRC中调控S100A14表达的机制尚不清楚。ZHANG等[16]学者发现,肿瘤中S100A14的表达受到非编码RNA如微小RNA-153-5p的调控,微小RNA-153-5p的表达能够降低S100A14 mRNA的稳定性,抑制其表达。HE等[17]研究发现,在CRC中miR-153-5p能够通过抑制抑癌基因Bcl-2的表达,促进肿瘤细胞耐药性的形成,导致肿瘤进展。推测CRC中S100A4可能是新的miR-153-5p下游靶点,值得深入研究。本研究结果显示,S100A14的表达与TNM分期、肿瘤分化程度有关,表明CRC中S100A14的表达下调促进肿瘤的进展。SAPKOTA等[18]学者报道,S100A14能诱导肿瘤细胞G1期阻滞,S100A14表达降低后,其G1期阻滞能力降低,促进口腔鳞癌细胞的增殖,并且肿瘤抑制蛋白p53的功能发挥也依赖于S100A14,敲低肿瘤细胞中S100A14的表达,p53的抑癌能力也显著下调。进一步研究S100A14对CRC患者预后的影响,结果显示S100A14阴性表达的CRC患者预后较差,且S100A14阴性表达是CRC患者不良预后的危险因素,表明S100A14可用于CRC的预后判断。
S100A16是S100钙结合蛋白家族成员,参与多种信号通路的调节,如细胞外信号调节激酶、Notch和核因子κB通路等,并参与染色体重排,与宫颈癌、非小细胞肺癌等恶性肿瘤的发生和进展密切相关[19-20]。本研究中,CRC组织中S100A16表达降低,可能与CRC中S100A16的表观遗传学修饰有关。研究表明,S100A16基因启动子区域的CpG岛的高甲基化状态,诱导S100A16基因的表达沉默,负性调控S100A16表达[21]。本研究中,CRC组织中S100A16的表达与TNM分期、肿瘤分化程度有关。提示S100A16的表达降低促进CRC的发生、发展。有文献报道[22],S100A16一方面通过抑制JNK/p38 MAPK 信号通路的激活进而抑制肿瘤细胞的增殖,另一方面,S100A16通过抑制肿瘤细胞的上皮间质转化,抑制肿瘤细胞的迁移和侵袭等恶性生物学行为[7]。此外,ZHANG等[23]发现,S100A16通过PI3K/AKT通路抑制白血病细胞的细胞增殖,S100A16的低表达与成人B细胞急性淋巴细胞白血病较高的复发率和较短的无复发存活时间相关。本研究中,S100A16阴性表达的CRC患者预后较差,亦表明检测CRC组织中S100A16的表达有助于患者的预后判断。
本研究中,CRC中S100A14与S100A16的表达呈正相关,表明其在CRC的发生、发展中可能存在相互协同的生物学功能。TANAKA等[24]学者在乳腺癌中发现,S100A14与S100A16在细胞内空间分布上,均以钙非依赖性方式结合定位于细胞质和细胞膜中的肌动蛋白上,两者之间的相互协同作用促进细胞骨架动力学的变化,影响肿瘤细胞的迁移和侵袭能力。但目前CRC中两者的具体作用机制有待深入探索。
综上所述,CRC组织中S100A14、S100A16表达降低,两者表达呈正相关。S100A14、S100A16表达与TNM分期、肿瘤分化程度有关,两者共同促进CRC的恶性发展。此外,TNM分期Ⅲ期、S100A14阴性、S100A16阴性是影响CRC患者预后的危险因素。S100A14、S100A16可用于评估CRC患者生存预后,值得临床深入探索。

