血清TL1A升高对ANCA相关血管炎活动度的临床价值
陈雪礼,薛国辉,华 琳,刘晓峰,李观华,张启贵,晏慧民
九江市第一人医院:1.检验科;2.肾内科,江西九江 332000
抗中性粒细胞胞浆抗体(ANCA)相关性血管炎(AAV)是寡免疫复合物沉积介导的免疫性坏死性血管炎[1-2],患者存在不可逆器官损伤的风险[3]。AAV的疾病活动度不仅影响治疗方案的选择,还提示了疾病的复发率或难治性,因而准确地定义AAV的活动度非常重要。目前,伯明翰血管炎活动性评分(BVAS)、医师全局评估、疾病程度指数和五因素评分(FFS)等可用于评估 AAV 疾病活动性[4-6]。但这些指标的主观性和复杂性使其难以应用于临床实践,因而发掘新的客观评价标志物至关重要[7]。此外,AAV的确切发病机制尚不清楚。已有证据表明靶向与 CD4+T 辅助细胞亚群分化相关的细胞因子可有效改善抗髓过氧化物酶抗体(MPO)肾小球肾炎[8]。其中T淋巴细胞17(Th17)细胞可诱导白细胞介素-8(IL-8)和CXCL-1的分泌,而这些细胞因子可促进ANCA靶抗原的表达。而在抗MPO肾小球肾炎动物模型中,IL-17缺陷发挥保护作用[9]。这些研究均表明Th17参与了AAV的致病机制,但其调控机制不明。有研究发现肿瘤坏死因子配体相关分子1A (TL1A)可调控Th17分化[10],据此本文推测TL1A可能在AAV中发挥作用,但报道甚少。本研究将通过分析AAV患者TL1A的表达变化及其与Th17细胞相关细胞因子和临床参数间的关系,为AAV的发病机制研究提供新的方向。
1 资料与方法
1.1一般资料 选取2019年9月至2022年2月于本院就诊并确诊为AAV的患者51例为AAV组,所有患者均符合美国风湿病学会关于AAV的分类标准及2012年Chapel Hill 共识会议关于AAV的定义[11-12]。另选取同期于本院体检中心行健康检查的50例体检健康者作为对照组。两组人群年龄和性别构成比比较,差异均无统计学意义(P>0.05),具有可比性。纳入的AAV病例中MPO-AAV 42例,蛋白酶-3(PR-3)-AAV 9例。所有患者均被告知本研究的目的、并签署知情同意书,研究经过医院伦理委员会批准。AAV病例纳入标准:(1)AAV初诊患者;(2)纳入研究前6个月内无激素使用史;(3)无感染、重大心血管疾病、过敏性疾病、肿瘤及其他自身免疫性疾病。排除标准:(1)非初诊患者;(2)就诊前6个月内使用过免疫抑制剂或非甾体抗炎药等药物;(3)既往和当前合并急慢性感染、免疫性疾病及肿瘤等疾病。记录AAV患者的活动度评分即2003版伯明翰血管炎评分(BVAS-2003)。本研究经本院医学伦理委员会讨论通过。
1.2标本采集及处理 抽取所有受试者清晨空腹静脉血4 mL,其中2 mL分装于乙二胺四乙酸(EDTA)抗凝管中,淋巴细胞分离液分离外周血单个核细胞(PBMC),用于流式细胞术检测。另2 mL静脉血分装于干燥管中,4 000 r/min,离心10 min分离血清并于-80 ℃冰箱保存,用于酶联免疫吸附试验(ELISA)检测。
1.3流式细胞术检测Th17细胞 用RPMI 1640调整PBMC浓度至2.0×106/mL,接种于6孔板中,加入25 ng/mL佛波酯、500 ng/mL离子霉素及1.7 μg/mL莫能霉素,37 ℃ 5% CO2培养箱中孵育4 h。然后取出细胞加入抗CD3和CD4抗体各10 μL,充分混匀后室温避光孵育20 min,用PBS 清洗2次后,1 200 r/min离心去上清液,加入固定剂固定15 min,PBS清洗1次后离心去上清液,加入破膜剂室温孵育5 min离心去上清液。加入抗IL-17抗体10 μL,室温避光孵育20 min,离心去上清后加入500 μL PBS重悬后上机检测。圈定CD3+CD4+细胞群,进一步分析 Th17细胞群,其表型定义为CD3+CD4+IL-17+。
1.4ELISA测定血清TL1A、IL-17和IL-23的水平 血清TL1A、IL-17和IL-23测定均采用ELISA法,所需试剂盒均购自美国R&D公司,分别为Human TL1A/TNFSF15 DuoSet ELISA(DY1319-05)、Human IL-17 Quantikine ELISA Kit(D1700)和Human IL-23 Quantikine ELISA Kit(M2300),所有步骤均严格参照试剂盒操作说明书执行。
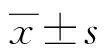
2 结 果
2.1纳入患者的基线特征 纳入研究的AAV患者基线资料见表1。平均年龄为(53.17±16.89)岁,其中男16例(31.37%)。15例为肉芽肿性多血管炎、26例为显微镜下多血管炎和10例嗜酸性肉芽肿性多血管炎。在临床表现中,肾脏表现是最常见的(82.35%),其次是肺部(68.63%)和系统性(41.18%)表现。AAV患者BVAS-2003疾病活动度评分为(16.32±7.81)分。
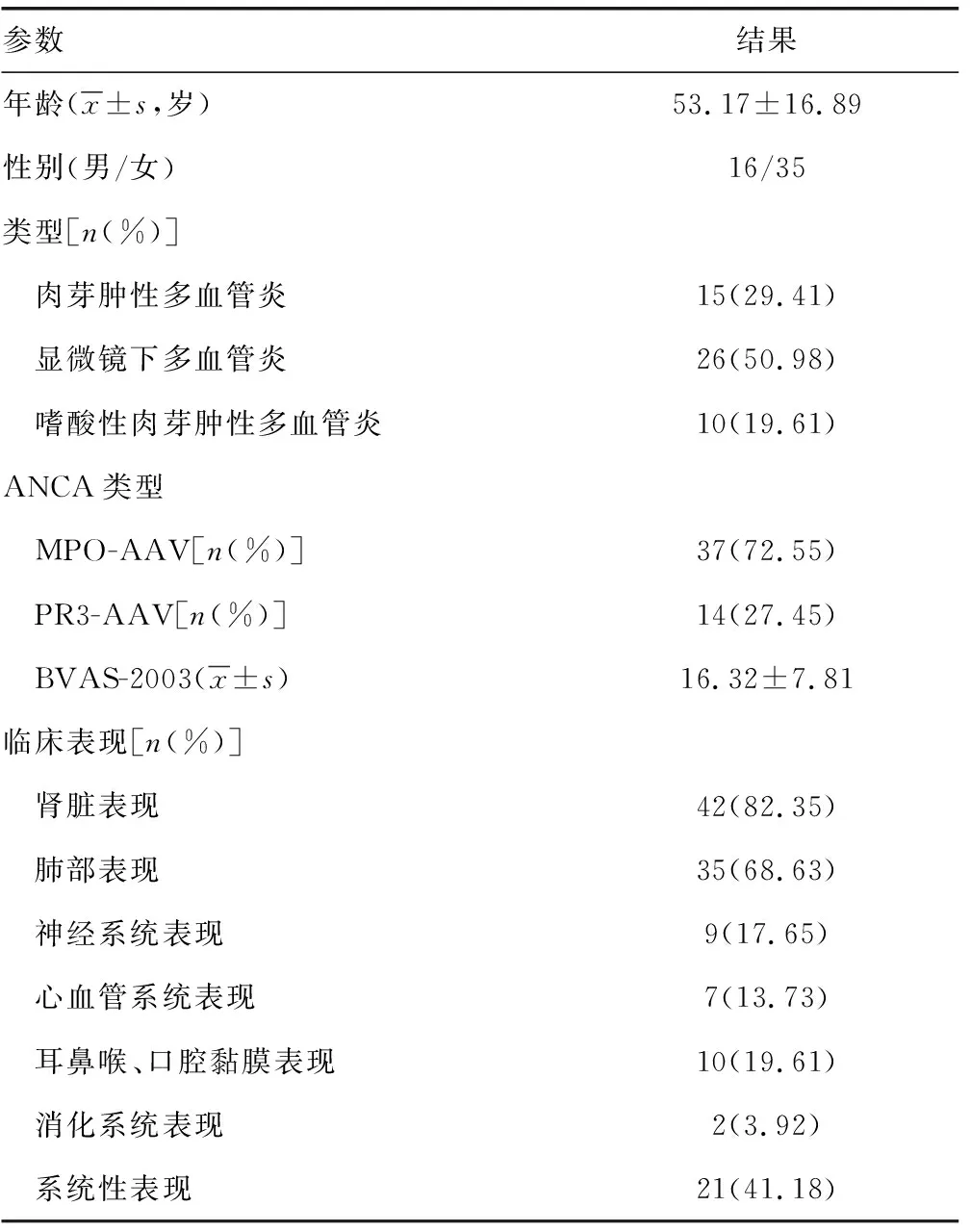
表1 纳入的AAV患者临床基线特征
2.2AAV组与对照组实验室一般资料比较 与对照组相比,AAV组的白细胞计数(WBC)、中性粒细胞计数(NEU)、血尿素氮(BUN)、肌酐(Cr)、尿酸(UA)和C反应蛋白(CRP)均明显升高,差异均有统计学意义(均P<0.05)。此外,AAV组相较对照组具有更低水平的血红蛋白浓度(Hb)、淋巴细胞计数(LYM)、血清清蛋白(ALB)和肾小球滤过率(GFR),差异均有统计学意义(均P<0.05)。见表2。
表2 AAV组与对照组实验室一般资料比较
2.3AAV患者血清TL1A、Th17、IL-17及IL-23的变化 ELISA结果显示,与对照组相比,AAV组具有更高水平血清IL-17(5.67±2.16vs.2.72±1.34)、IL-23(12.12±4.91vs.7.14±2.93)和TL1A(22.52±7.72vs.10.16±4.45),差异均有统计学意义(均P<0.05)。而流式细胞术结果显示Th17细胞频率在AAV患者中同样显著高于对照组,差异有统计学意义(P<0.05)。见图1。

图1 AAV患者血清的变化注:A为IL-17;B为IL-23;C为TL1A;D、E为Th17。
2.4TL1A与实验室指标及活动度评分BVAS-2003的相关性分析 Spearman相关性分析结果显示AAV患者中血清TL1A与血清IL-17、Th17频率、CRP及BVAS-2003均呈显著正相关(均P<0.05)。而与GFR呈显著负相关性(P<0.05)。与其他指标间的相关性并不显著(均P>0.05),见图2。
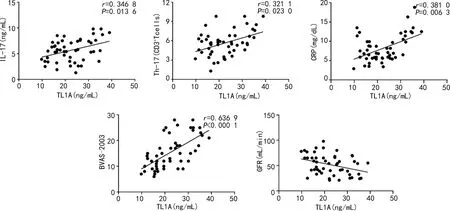
图2 TL1A与IL-17、Th17、CRP、BVAS-2003及GFR间的相关性
2.5以BVAS-2003为标准绘制血清TL1A的ROC曲线 BVAS 评分总分15 分以上为活动期,反之则为缓解期,本研究中活动期患者22例,缓解期患者30例。据此绘制TL1A预测疾病活动期的ROC曲线,血清TL1A预测AAV疾病活动期具有较好的价值,其曲线下面积(AUC)高达0.87(95%CI:0.775 9~0.966 3,P<0.001),最佳cut off值为19.95 ng/mL,灵敏度为90.48%,特异度为72.41%。并与IL-17、IL-23、Th17及CRP进行比较,TL1A预测AAV疾病活动期的AUC最大,见图3。

图3 血清TL1A、IL-17、IL-23、Th17及CRP预测AAV活动性的ROC曲线
3 讨 论
在临床实践中,急性期反应物如CRP和 ANCA 滴度是评估当前 AAV 活动度的最常见的生物标志物[15]。然而,由于这些实验室变量的低特异性,需要新的和便捷的替代生物标志物来更加准确地评估AAV 的疾病活动性。目前,研究证实T细胞介导的免疫反应在AAV发病机制中扮演重要角色,有报道发现AAV 患者肾脏活检组织中可见大量T 细胞浸润,肉芽肿组织亦可见大量淋巴细胞浸润[16]。其T 细胞处于持续的活化状态,激活的T 细胞可通过细胞毒效应、聚集和激活巨噬细胞等多种途径而引起组织损伤[8]。AAV 患者的Th17细胞及相关效应细胞因子异常上调,这可能是引起AAV炎症产生的重要原因。以往研究显示在AAV患者中产生IL-17的淋巴细胞数量增加,活动期血清IL-17水平更高[17]。此外,在AAV患者的肾小球和肾间质中观察到IL-17阳性细胞存在,并证实AAV患者的肾组织中IL-17 mRNA表达增加[18]。近期越来越多的证据表明Th17活化在 AAV 的发病机制中起关键作用。作为Th17细胞分化的关键调节因子,TL1A在多种自身免疫性疾病,如类风湿关节炎、强直性脊柱炎、炎症性肠病、原发性胆汁性肝硬化和银屑病中均已被证实显著升高并与疾病活动相关[19],但其在AAV患者中如何变化,并不清楚。
在本研究中,血清TL1A水平在AAV患者中显著升高,与 BVAS-2003显著相关。此外,血清TL1A与Th17细胞及其相关效应细胞因子亦存在显著正相关性,提示其可能在AAV中扮演调控Th17细胞的角色。SUN等[20]发现在与骨关节炎患者和健康对照者相比,类风湿关节炎患者血清和关节液中TL1A水平显著升高,且血清水平与类风湿关节炎特异性自身抗体相关,包括类风湿因子和抗瓜氨酸蛋白抗体。且TL1A刺激后来自类风湿关节炎患者的外周血单核细胞所产生的抗体显著升高。但该研究并未发现血清TL1A 水平与类风湿关节炎疾病活动之间的相关性。值得注意的是,本研究中的ROC曲线结果显示血清TL1A水平预测AAV患者疾病活动度具备较好的性能,可能是评估 AAV 疾病活动的潜在生物标志物。血清TL1A水平与AAV 疾病活动之间的显著关联在理论上可能是因为TL1A可以由活化的T淋巴细胞和巨噬细胞分泌[21],而这些细胞在AAV的发病机制中起重要作用。T淋巴细胞活化标志物在AAV患者血清中升高。此外,ANCA的IgG亚型主要由IgG1和IgG4组成,提示需要T 细胞参与ANCA的同种型转换[22]。多项研究发现,持续T细胞浸润及活化与AAV相关,并最终导致终末期肾脏病,而巨噬细胞可能会在血管炎靶组织中积聚,并在急性炎症消退后的损伤反应阶段引起 AAV 中的器官损伤[23-24]。这些结果支持血清TL1A可能是评估AAV活性的生物标志物的证据。其次,由于血管损伤,内皮细胞可以分泌血清TL1A。有研究表明AAV中血管损伤和血管生成的循环分子水平显著增加[24]。因此,推测当发生广泛的血管损伤和血管生成时,血清TL1A水平会上调。或者,TL1A也可能通过增加趋化性、细胞黏附和血管内皮细胞迁移与AAV炎症直接相关,从而导致血管损伤增加。有研究表明,TL1A在同为广泛血管损伤的川崎病患者中显著上调[25],这也间接支持这一假说。
总之,本研究初步发现血清TL1A在AAV患者中异常上调,且与同样升高的Th17细胞密切相关。此外,与BVAS-2003的显著相关性及ROC曲线结果表明血清TL1A可能成为AAV患者疾病活动度评价的新的生物标志物。当然,这有必要在未来的研究中扩大样本量进一步验证,且需利用TL1A敲除的动物模型探究TL1A参与AAV发病过程的分子机制。

