橙皮苷对人舌癌Tca8113细胞增殖和凋亡的影响及机制研究
徐 昊,黄克强,黄 超
(1.锦州医科大学附属第二医院正畸科,辽宁 锦州 121001;2.锦州医科大学附属第一医院,辽宁 锦州 121001)
口腔癌是威胁全球公众健康的一个重要因素,其发生与经常饮酒、吸烟、不良修复体、常食烫热食物、口腔疾病史等因素密切相关,约占体内所有癌症的1%~2%[1-2]。舌鳞状细胞癌(Tongue squamous cell carcinoma,TSCC)在口腔癌中的发病率最高,尤其是TSCC晚期,肿瘤可向肺部等远处转移,极易发生淋巴结转移。化疗作为口腔癌重要治疗方法之一,其毒性大、易产生多要耐药性,面临的主要问题是癌细胞对化疗药物的敏感性下降。目前发现有许多中药单体都具有抑制肿瘤生长的作用[3-4]。同时,天然植物中的药物成分,因其单体成分的不良反应小、治疗范围广,可作为靶向治疗舌癌的辅助甚至替代手段[5-6]。因此,寻找高效的中药单体成分治疗舌癌已成为研究热点。橙皮苷(Hesperidin,HP)作为一种中药单体成分,是一种可以从柑橘果皮中提取出的生物类黄酮,还可能提取自芸香科、茜草科植物,具有降低毛细血管脆性和通透性、利尿、止痛及抑制多种肿瘤细胞的药理作用[7-8]。本研究探讨HP对人舌癌Tca8113细胞增殖和凋亡的影响及可能机制,现报告如下。
1 材料与方法
1.1 主要材料与仪器 人舌鳞癌Tca8113细胞系购自中国科学院上海细胞库;橙皮苷(批号:20170212)购自上海沃凯生物技术有限公司;胎牛血清、1640培养基、胰蛋白酶均购自美国Gibco公司;酶标仪购自美国Biotek公司;流式细胞仪购自美国BD Biosciences公司;垂直电泳仪购自美国Amersham Biosciences公司。
1.2 实验方法
1.2.1 细胞培养:人舌癌Tca8113细胞置于含10%胎牛血清、100 U/ml青霉素和100 U/ml链霉素的RPMI1640培养基中,于37 ℃、5% CO2的恒温箱内进行常规细胞培养,2~3 d换液,直至细胞融合至培养皿底的85%左右。先进行预实验获得半数抑制浓度,再进行传代并将其分成三组:对照组细胞常规培养;实验组细胞分别加入低剂量(30 μmol/L)和高剂量(60 μmol/L)HP处理24 h。后续实验均采用对数生长期细胞。
1.2.2 CCK-8实验检测细胞增殖活力:细胞培养、分组与处理同上。将人舌癌Tca8113细胞接种在96孔板内,约5×103个/孔,隔夜加入不同浓度含HP的完全培养液继续培养24 h,加入10 μl CCK-8溶液以后继续孵育2 h。然后将96孔板置于酶标仪上并检测450 nm处吸光度(OD)值。细胞相对活力(%)=OD值实验组/OD值对照组×100% 。
1.2.3 Hoechst33342染色观察细胞凋亡形态:细胞培养、分组与处理同上。将人舌癌Tca8113细胞接种在6孔板内,约1×105个/孔,隔天换液,直至细胞融合至50%左右,更换为含HP完全培养液,继续培养24 h。加入5 μg/ml Hoechst33342染色液(500∶1)继续孵育20 min,在荧光显微镜下拍照并记录。
1.2.4 流式细胞仪检测细胞凋亡率:细胞培养、分组与处理同上。将人舌癌Tca8113细胞接种在6孔板内,约3×105个/孔,隔天更换为含HP完全培养液,继续培养24 h。用1 ml不含EDTA胰蛋白酶消化,离心后加入流式缓冲液重悬细胞,向流式管中加5 μl Annexin V-FITC和10 μl PI,常温暗室处理10 min后立即用流式细胞仪检测。
1.2.5 Western blot检测细胞凋亡相关蛋白:细胞培养、分组与处理同上。将人舌癌Tca8113细胞接种在直径为10 cm培养皿中,2~3 d换液,直至细胞融合至培养皿底的80%左右时加入含HP完全培养液,继续培养24 h。用细胞刮刀刮下细胞并制备出磷酸化磷脂酰肌醇3-激酶(p-PI3K)、磷酸化蛋白激酶B(p-AKT)、B细胞淋巴瘤/白血病-2(Bcl-2)和Bcl-2相关X蛋白(Bax)蛋白样品。制备蛋白样品后先将样品进行电泳,再将蛋白电湿转至PVDF膜上,用2% BSA进行封闭后一抗4 ℃摇床16 h,二抗室温摇床2 h,最后ECL显影。

2 结 果
2.1 三组细胞增殖活力比较 见图1。将对照组细胞活力看作100%,经30、60 μmol/L HP处理24 h后,舌癌Tca8113细胞的增殖活力受到不同程度的抑制(均P<0.01)。IC50值为45.50 μmol/L。

图1 三组细胞增殖活力比较注:与对照组比较,*P<0.01
2.2 三组细胞Hoechst33342染色结果 见图2。对照组细胞形态规则,染色质均匀,胞核呈现出弱蓝色荧光。HP实验组细胞染色质浓缩,细胞核固缩,部分胞核碎裂呈现出亮蓝色荧光,凋亡数量明显增加。

图2 三组细胞Hoechst33342染色结果(×50)
2.3 三组细胞p-PI3K和p-AKT蛋白相对表达量比较 见图3。低剂量HP组和高剂量HP组细胞p-PI3K和p-AKT蛋白相对表达量明显低于对照组(均P<0.01)。

图3 三组细胞p-PI3K和p-AKT蛋白相对表达量比较注:左图为电泳图;右图中,与对照组比较,*P<0.01
2.4 三组细胞Bcl-2和Bax蛋白相对表达量比较 见图4。低剂量HP组和高剂量HP组细胞中Bcl-2蛋白相对表达量明显低于对照组,而Bax蛋白相对表达量显著高于对照组(均P<0.01)。

图4 三组细胞Bcl-2和Bax蛋白相对表达量比较注:左图为电泳图;右图中,与对照组比较,*P<0.01
2.5 三组细胞凋亡率比较 见图5。对照组细胞凋亡率为(7.23±0.90)%, 低剂量HP组和高剂量HP组细胞凋亡率分别为(16.46±1.47)%和(31.73±2.14)%,明显高于对照组(均P<0.01)。
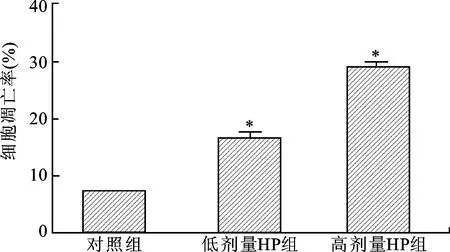
图5 三组细胞凋亡率比较注:与对照组比较,*P<0.01
3 讨 论
舌癌是威胁人类健康的常见恶性肿瘤之一,其发病呈上升趋势,临床治疗方法是以手术为主的综合序列治疗,并术后化学治疗为辅,其化疗药物自身的不良反应导致临床效果并不理想,严重影响患者术后的生活质量[9]。HP是存在于多种天然植物中的重要功效成分。作为一种抗肿瘤化合物,它既能抑制肝癌、乳腺癌、直肠癌和肺癌等多种肿瘤细胞增殖,又能诱导其凋亡,在治疗和预防肿瘤方面的作用已经引起科学家的关注[10-12]。
本研究采用CCK-8实验检测细胞增殖活力的结果显示,经30、60 μmol/L HP处理24 h后,Tca8113细胞的增殖活力明显低于对照组。再用Hoechst33342染色液染色后观察Tca8113细胞凋亡的形态学变化,结果发现对照组细胞胞核呈现暗蓝色荧光,细胞形态变化不明显,而HP实验组细胞核均呈现出亮蓝色颗粒状荧光,细胞形态发生了明显的变化,细胞变扁,形态不规则,染色质浓缩。我们进一步采用Annexin V-FITC/PI染色检测细胞凋亡率发现,经30、60 μmol/L HP处理24 h后,Tca8113细胞凋亡率与对照组相比显著增加,进而证明HP能抑制人舌癌Tca8113细胞生长。
研究[13]对舌癌组织和配对癌旁组织的转录组进行分析,发现上调基因1700个,下调基因2249个,京都基因与基因组百科全书分析表明这些差异表达基因主要富集在PI3K/AKT等通路中。PI3K/AKT信号通路可起到加快细胞新陈代谢、诱导血管生成以及促进肿瘤细胞生长等作用,PI3K、AKT是信号通路中的关键蛋白,PI3K是一种胞内磷脂酰肌醇激酶,而AKT是一种蛋白激酶,磷酸化的PI3K和AKT还能加快肿瘤的发生[14-15]。本研究收集对照组和经30、60 μmol/L HP处理24 h后的人舌癌Tca8113细胞制备成蛋白样品后采用Western blot蛋白印迹法检测关键蛋白p-PI3K、p-AKT的表达情况,结果发现与对照组相比HP能降低Tca8113细胞中p-PI3K和p-AKT蛋白的表达量,从而抑制Tca8113细胞生长,这与熊果酸抑制人乳腺癌MCF-7细胞生长的结果一致[16]。
细胞凋亡是一种由基因主导的细胞程序化死亡过程,包括多个基因的激活、表达以及调控等,其形态学主要表现为核碎裂、染色质浓缩、出现凋亡小体等[17-18]。Bax是一种中枢细胞死亡调节因子,是线粒体功能障碍不可或缺的门户,也是控制正常细胞和癌细胞凋亡的Bcl-2家族蛋白的主要促凋亡成员,Bcl-2和Bax可以通过形成同源或异源二聚体的形式来调节细胞凋亡,Bcl-2蛋白增加可以抑制细胞凋亡,而Bax蛋白增加可以促进细胞凋亡[19-20]。Bax可激活诱导线粒体膜通透性,引起凋亡因子细胞色素C的释放,从而导致癌细胞死亡。本研究采用Western blot检测Tca8113细胞中Bcl-2和Bax的表达情况,结果发现,与对照组相比HP能够促进Bax活化并增加其蛋白表达水平,抑制Bcl-2活化并减少其蛋白表达水平,进而通过线粒体途径快速诱导Tca8113细胞凋亡。
综上所述,HP可以有效抑制Tca8113细胞体外生长并促进细胞凋亡,其机制可能与调节PI3K/AKT信号通路中关键蛋白的表达有关,为临床治疗舌癌提供了新的实验依据。

