超氧化物歧化酶融合蛋白改善阿尔茨海默病小鼠大脑白质超微结构实验研究
程 艳,郭建伟,李 扬,薛荣亮
(1.陕西省人民医院麻醉科,陕西 西安 710068;2.西安国际医学中心医院麻醉与舒适化医疗中心,陕西 西安 710100)
体视学方法通过观察和测量二维切片信息而获得精确三维定量的显微结构信息。简单来讲,当三维空间内的立体结构表现在二维切面上时,三维空间体积特征即表现为二维切面上的面积特征,三维空间内表面积在二维切面上表现为边界线(轮廓),线性结构无论其在三维空间内怎样走行,在二维切面上仅仅表现为断面数(点)。体视学的三维定量研究被国际上公认为生物医学领域最准确、最精确的三维定量研究方法,许多领域如神经科学、影像学、病理学等广泛应用此种方法进行有关三维定量的相关研究[1]。然而对于神经纤维的形态学研究较少,尤其是基于方法学设计的体视学研究在神经领域应用较少。几个基于设计的体视学研究发现阿尔茨海默病(Alzheimer’s disease,AD)海马组织显示(不同于正常老化)大量神经元丢失在CA1区[2-5],这种选择性的神经元丧失是在临床前期,即AD患者出现斑块形成之前发生的,在此期间大脑中有大量淀粉样蛋白沉积,但没有认知能力下降的证据[5]。因此,体视学研究在AD中占据着重要位置,其可通过定量测量揭示AD病因或疾病发展过程,为AD治疗提供可能的机会。
有研究[6-8]表明,氧化应激产生的大量活性氧(Reactive oxygen species,ROS)及其氧化损伤在许多与神经变性相关疾病(如AD)的发病机制中发挥作用。线粒体也在神经元功能中起关键作用,并且这些功能的几乎所有方面都在AD中发生改变[9]。氧化应激被认为是包括AD在内的广泛神经系统疾病中神经元损伤的主要原因[10-11],超氧化物歧化酶(Superoxide dismutase,SOD)是针对ROS的主要抗氧化剂防御系统[12],分子量大且没有特异性受体,这使得它难以穿过血脑屏障及细胞膜进入脑内发挥作用。本课题组前期构建了pET16b-PTD4-Cu、Zn-SOD重组表达载体并进行优化,其表达蛋白(SOD融合蛋白)表现出特定的跨膜能力,可以进入体外培养的人星形胶质细胞[13-16]。因此,本研究拟通过现代体视学方法探究SOD融合蛋白对AD小鼠脑白质(White matter,WM)及其超微结构的影响,以为AD抗氧化治疗提供理论支持。
1 材料与方法
1.1 实验动物 选用32只健康清洁、体重30~35 g的昆明雄性小鼠(购自西安交通大学动物实验中心),饲养于恒定温度(23±1)℃、恒定湿度(60±10)%和12 h明暗周期的无病原体环境中,饮用水和食物不受限制。本实验根据《实验动物的护理和使用指南》进行动物饲养和处理,并通过西安交通大学动物实验伦理审查。
1.2 主要试剂 β-淀粉样蛋白(Aβ)1-42蛋白寡聚体(107761-42-2,上海吉尔生化有限公司);PBS干粉(PW013,西安赫特生物科技有限公司);多聚甲醛(PI014,西安赫特生物科技有限公司);琼脂粉(Q-0024796,法国Biowest生物有限公司);青霉素(西安交通大学第二附属医院药剂科);苦味酸(汕头西陇化工公司);10%水合氯醛、25%戊二醛水溶液及0.9%氯化钠溶液(实验室配制);75%乙醇消毒液及双蒸水(实验室提供)。
1.3 小鼠分组及实验流程 32只昆明雄性小鼠适应性饲养7 d后,根据随机数字表法分为假手术组(S组)、模型组(M组)、SOD干预模型组(SM组)和SOD融合蛋白干预模型组(PM组),每组8只。在实验第9~23天,通过小鼠连续腹腔内注射等量0.9%氯化钠溶液(S组和M组)、6 mg/(kg·d) SOD(SM组)或6 mg/(kg·d) SOD融合蛋白(PM组)进行预防干预。其中,在实验第16天,通过5 μl微量注射器将0.9%氯化钠溶液(S组,2 μl/只)及Aβ1-42寡聚体(M组、SM组及PM组,2 μl/只)注射于小鼠右侧脑室,以制备AD模型。在第32天,随机选取一侧大脑半球用ELISA法测定脑组织匀浆中的SOD活力和丙二醛(MDA)水平,另一侧大脑半球固定于2%甲醛+2.5%戊二醛溶液中,应用现代体视学方法定量分析小鼠脑白质及其超微结构变化。
1.3.1 立体定位脑室内Aβ1-42输注:4%水合氯醛(300~350 mg/kg)腹腔注射麻醉小鼠,将其背位固定于脑立体定位仪(SR-5,Narishige)上。参考George Paxinos等编著的《小鼠脑立体定位图谱》,选定并标记小鼠右侧脑室的进针点,即由前囟向后0.45 mm、矢状缝向右侧1.0 mm的位置,在标记的进针点处进行颅骨钻孔,将5 μl微量注射器自硬膜下垂直进针2.0 mm,缓慢注射2 μg Aβ1-42寡聚体于侧脑室中。注射完毕后,留针20 min后缓慢拔出微量注射器,缝合头顶皮肤。再次消毒手术区域后,每只小鼠肌注青霉素约2万单位,归笼,严密监测小鼠呼吸是否正常。
1.3.2 标本取材:仰卧位固定并麻醉小鼠,夹起胸部靠近剑突下的皮肤,剪开胸腔皮肤和肋骨,并剪开膈肌,充分暴露小鼠心脏与肝脏。夹起室间隔靠近右心室处,将输液器钢制针头插入小鼠左心室并用动脉夹妥善固定,然后剪开右心耳流出血液,打开输液器控制阀灌注0.9%氯化钠溶液,10 min左右血液完全排出后可观察到小鼠肝脏及四肢发白,此时即表示灌注良好。将小鼠头部皮肤剪开,露出颅骨,剥开头盖骨,轻柔剪开脑实质表面软脑膜,减掉周围的颅神经及结缔组织,进而剥离出整个脑。将剥离出的脑沿大脑纵裂切开,分成左、右半球,随机取一侧大脑半球迅速进行液氮冷冻保存,后储存在-80 ℃冰箱中,以进行后期的SOD活力和MDA水平检测,另一侧大脑半球置入之前配制好的混合固定液(2%多聚甲醛+2.5%戊二醛)中进行标本固定。
1.3.3 大脑组织匀浆SOD活力和MDA水平检测:将新鲜大脑半球组织以1∶10(m/V)加入RIPA裂解液,用机械研磨与超声破碎仪打碎组织,制备10%的组织匀浆,高速离心后取上清液,检测SOD活力和MDA水平。
1.3.4 大脑白质及其超微结构体视学研究
1.3.4.1 计算AD小鼠大脑半球白质总体积:随机选择沿冠状面的子代鼠脑切片数个,将等距点阵图与切片随机叠加,在解剖显微镜下计数所有与白质重叠的点∑PWM,计算白质总体积VWM。VWM=t×a(p)×∑PWM,其中t为连续切片厚度,a(p)为与每个网格点相关的面积。
1.3.4.2 获取电镜照片:从选定脑切片上获得包含脑白质的组织块,进行电镜包埋,使用透射电镜观察电镜切片,每张切片上系统抽取5个8000倍及10个15000倍的视野。
1.3.4.3 计算白质中有髓纤维的长度密度和总长度:将无偏计数框与8000倍电镜照片随机叠加,计算白质中有髓纤维的长度密度LV(mf/wm) 和总长度L(mf,wm)。LV(mf/wm)=2×∑Q(mf)/[a(frame)×∑frame],L(mf,wm)=LV(mf/wm)×VWM,其中∑Q(mf)是通过无偏计数框计数得出的电镜照片中有髓纤维的总个数,a(frame)为单个无偏计数框的面积,∑frame为计数框的总个数。
1.3.4.4 计算白质中有髓纤维及髓鞘的体积密度和总体积:将等距点阵图与8000倍电镜照片随机叠加,计数所有落在白质点数∑P(wm)、落在有髓纤维点数∑P(mf)及落在髓鞘点数∑P(ms),计算有髓纤维的体积密度VV(mf/wm)、髓鞘的体积密度VV(ms/wm)、有髓纤维的总体积V(mf,wm)及髓鞘的总体积V(ms,wm)。Vv(mf/wm)=∑P(mf)/∑P(wm),Vv(ms/wm)=∑P(ms)/∑P(wm),V(mf,wm)=Vv(mf/wm)×VWM,V(ms,wm)=Vv(ms/wm)×VWM。
1.3.4.5 计算有髓纤维内直径与外直径:将无偏计数框与15000倍电镜照片随机叠加,确定落在无偏计数框内的神经纤维断面。通过测量垂直于有髓纤维最长轴的最长轮廓直径来估算有髓纤维的外直径,通过测量垂直于轴突最长轴的最长轮廓直径来估算有髓纤维的内直径,测量内、外直径,计算内、外直径比值和差值。
1.3.4.6 计算有髓纤维内周长及外周长:将无偏计数框及等距平行线与15000倍电镜照片随机叠加,确定落在无偏计数框内的神经纤维断面,计算断面内有髓纤维的内周长或外周长b(ms)。b(ms)=π/2×d×∑I,其中d为等距平行线间的垂直距离,∑I为等距平行线与落在无偏计数框内的髓鞘内缘界线或外缘界线交叉的总点数,进而计算内、外周长比值和差值。

2 结 果
2.1 四组小鼠不同时间点体重比较 见表1。选取实验第8、24、31天小鼠体重进行统计学分析,结果显示四组小鼠体重比较差异无统计学意义(均P>0.05)。
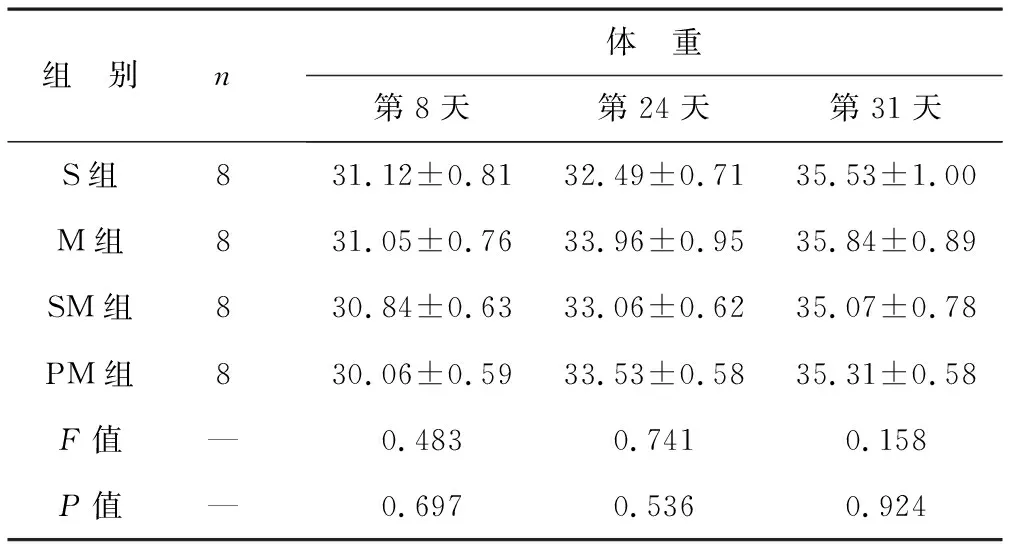
表1 四组小鼠不同时间点体重比较(g)
2.2 四组小鼠SOD活力与MDA水平比较 见表2。M组SOD活力低于S组,PM组SOD活力高于M组(均P<0.05)。M组MDA水平高于S组,PM组MDA水平低于M组(均P<0.05)。

表2 四组小鼠SOD活力与MDA水平比较
2.3 四组小鼠大脑白质总体积、有髓神经纤维总长度、有髓神经纤维总体积、髓鞘总体积比较 见图1。M组小鼠脑白质总体积、有髓神经纤维总长度、有髓神经纤维总体积、髓鞘总体积低于S组,PM组小鼠脑白质总体积、有髓神经纤维总长度、有髓神经纤维总体积、髓鞘总体积高于M组(均P<0.05)。
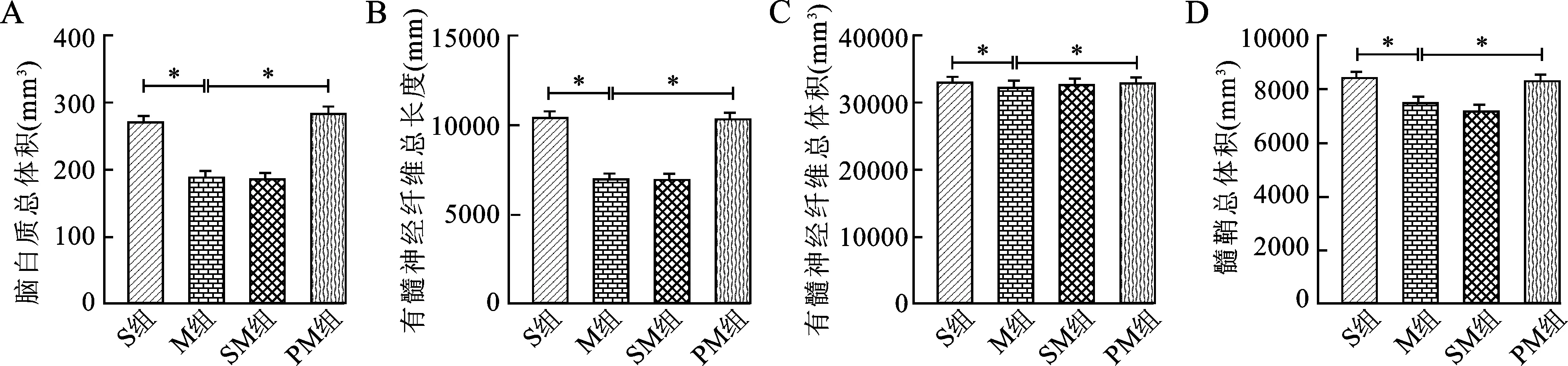
图1 四组小鼠脑白质总体积(A)、有髓神经纤维总长度(B)、有髓神经纤维总体积(C)、髓鞘总体积(D)比较注:与M组比较,*P<0.05
2.4 四组小鼠大脑半球白质内有髓神经纤维髓鞘体视学分析 见表3。M组小鼠髓鞘内直径及外直径低于S组,PM组小鼠髓鞘内直径及外直径高于M组(均P<0.05)。

表3 四组小鼠大脑半球白质内有髓神经纤维髓鞘体视学分析结果
2.5 脑白质总体积、有髓神经纤维总长度、有髓神经纤维总体积、髓鞘总体积与脑组织匀浆中SOD活力及MDA水平相关性分析 一侧脑白质总体积、有髓神经纤维总长度、有髓神经纤维总体积、髓鞘总体积与脑组织匀浆中SOD活力呈正相关,而与MDA水平呈负相关(r=0.522、0.522、0.501、0.466、-0.608、-0.613、-0.482、-0.661,均P<0.05)。
3 讨 论
WM占人类总脑容量约50%,对于跨越不同脑区的电信号传输至关重要,因此WM损伤可导致严重的神经行为和认知障碍[17]。Nasrabady等[18]使用磁共振成像研究表明,WM高信号可预测AD发病率及AD患者认知能力下降的速度,并与AD遗传危险因素相关。WM主要由成束的髓鞘或无髓鞘的轴突和产生髓磷脂的神经胶质细胞组成[19],WM中的髓鞘轴突是皮质和皮质下区域之间有效神经传递的结构基础[17],WM损伤在组织病理学上与髓磷脂苍白、髓磷脂丢失和髓鞘轴突丢失有关[20]。本研究发现AD模型小鼠脑白质总体积、有髓神经纤维和髓鞘的总体积以及有髓神经纤维总长度均显著减少,与既往研究[17]一致,说明白质及其超微结构损害可能是AD患者学习和记忆能力受损的病理基础。
在AD的背景下生物分子的氧化主要与神经元膜生物分子和膜完整性的破坏有关,涉及脂质(包括胆固醇)、蛋白质和核酸的氧化,以及由于其氧化导致的低密度脂蛋白受体相关蛋白(LRP)对β-淀粉样蛋白清除的损害[21]。脑WM的特征在于髓鞘的存在,而髓鞘由约70%脂质和约30%蛋白质组成[17]。传统模型表明,白质中固有的抗氧化性能可能相对较低[22-23],而富含脂质和蛋白质的髓鞘可以为过氧化反应提供丰富的底物而导致大量ROS的产生。本研究对髓鞘的分析发现,其内直径及外直径明显降低,其残存量与抗氧化能力呈正相关,而与过氧化水平呈负相关,因此推测AD小鼠中髓鞘脂质和蛋白质的过氧化会导致其结构或功能改变,影响WM在脑区信号传递中的作用,进而导致认知和行为障碍,而SOD融合蛋白可通过降低髓鞘脂质和蛋白质过氧化水平来保护WM功能免受损害,从而改善AD小鼠认知和记忆能力。有髓神经纤维髓鞘主要由少突胶质细胞构成,有研究[24-25]发现氧化应激诱导少突胶质细胞和少突胶质细胞前体细胞死亡,或抑制少突胶质细胞祖细胞的分化,即其破坏少突胶质细胞的成熟,因此氧化应激可能通过破坏髓鞘结构影响WM的传导功能,进而导致学习和记忆功能障碍。而SOD融合蛋白可通过减轻氧化应激维持少突胶质细胞功能,从而维持髓鞘完整,减少学习和记忆能力损伤。
研究[11]发现,AD等病理状态下产生的大量ROS可以快速活化小胶质细胞,而处于活化状态的小胶质细胞可以产生多种神经毒性因子参与与神经退行性变相关的炎症反应过程。产生的神经毒性因子包括促炎细胞因子和趋化因子等,它们通过激活RAGE信号转导促进 环氧化酶(COX)-2表达和血小板活化。COX-2可以通过形成不同类型的自由基来增强炎症反应,引起磷脂过氧化。血小板活化可通过增加谷氨酸盐的释放以及耦合突触后N-甲基-D-天冬氨酸(NMDA)受体活化,增加一氧化氮的产生和随后的线粒体去极化。这些事件共同促进了ROS的下游产生,导致WM损伤并进一步加重了认知功能障碍。另一方面,小胶质细胞参与神经发生,其炎性激活或产生神经毒性因子和细胞因子而破坏神经发生过程。活化小胶质细胞的毒性炎症潜能可能延伸至少突胶质细胞,从而导致WM微观结构改变,最终引起行为学改变。例如,肿瘤坏死因子(TNF)-α是一种主要的促炎细胞因子,通过少突胶质细胞祖细胞表达的TNF受体发挥作用,并能抑制少突胶质细胞祖细胞的存活和分化,而干扰素(IFN)-γ则通过促进少突胶质细胞的代谢紊乱甚至细胞死亡来对中枢神经系统髓磷脂产生有害作用,随后降低髓磷脂蛋白基因的表达,从而降低少突胶质细胞的髓鞘或髓鞘再生潜能。这些事件通过损伤少突胶质细胞而导致WM微观结构受损,并导致AD小鼠行为障碍。这与本研究中AD小鼠WM损伤的结果一致,而抗氧化剂SOD融合蛋白可以通过清除ROS逆转上述过程。
综上所述,SOD融合蛋白腹腔干预可以减轻Aβ1-42诱导的AD小鼠脑内氧化应激水平以及脑白质及其超微结构变化。AD小鼠脑内氧化应激可能是白质受损的病理基础。

