MALDI-TOF MS快速检测阳性血培养中肠杆菌目细菌碳青霉烯酶活性的评价
梁世周 许建平 蔡文品 孔万仲 奚经巧 金晓立 曾云祥
血流感染的治疗是全世界医疗卫生机构的临床重点,有报道其致死率为18.2%~21.4%[1]。有研究结果显示,对于脓毒性休克患者,如果每延迟1 h给予有效治疗,死亡风险增加35%[2]。因此,早期适当使用抗生素治疗对改善血流感染的预后至关重要[3]。目前,肠杆菌目菌株是引起血流感染的主要病原体,其分离率高达30%[4]。同时,近年来耐碳青霉烯肠杆菌目对全球公共卫生构成的威胁呈指数级增长,成为最常见的一个全球卫生问题[5]。中国细菌耐药监测网(CHINET)显示,2005—2019年36所三级医院肺炎克雷伯菌对亚胺培南的耐药率从3.0%上升至25.3%,且呈逐年递增趋势[6]。此外,耐碳青霉烯类药物的大肠埃希菌和肺炎克雷伯菌,已成为近年来死亡率上升最快的病原菌[7]。在肠杆菌目中,碳青霉烯类耐药性通常是由于诸如外排泵、孔蛋白损失和产生大量耐药酶等过程导致的,其中产碳青霉烯酶是最常见的耐药机制。因此,耐药酶的快速检测成为近年来的热点研究领域。
目前,基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption ionization time-of-flight mass spectrometry,MALDI-TOF MS)是碳青霉烯酶活性检测的最新进展,被成功地用于从革兰阴性菌落中直接检测碳青霉烯酶的活性[8-10]。笔者尝试利用MALDI-TOF MS直接从阳性血液培养瓶中对肠杆菌目细菌生产的碳青霉烯酶活性进行快速检测,并与耐药基因PCR分子检测结果比较,评估该方法的可靠性。
1 材料和方法
1.1 菌株来源 收集2012年1月至2018年12月温州市中医院各临床科室分离的肠杆菌目细菌46株,不含重复菌株。其中产碳青霉烯酶肠杆菌目细菌(carbapenemase-producing Enterobacteriaceae,CPE)25株,包括携带 blaKPC-27株,blaNDM(包括NDM-1、4、5型)8株,blaIMP-42株,同时携带blaKPC-2和blaCTX-M4株,同时携带blaKPC-2和blaNDM-42株,同时携带blaNDM-1和blaIMP-42株;非产碳青霉烯酶肠杆菌目细菌(non-carbapenemase-producing Enterobacteriaceae,NCPE)21株 ,其 中 携 带blaCTX-M5株,未检测到上述基因型且碳青霉烯类敏感的肠杆菌目细菌16株。筛查2022年3月至4月本院各病房送检已签发报告的阳性血培养标本,收集致病菌为耐碳青霉烯类肠杆菌目细菌(carbapenemase-resistant Enterobacteriaceae,CRE)9例,非耐碳青霉烯类肠杆菌目细菌(non-carbapenemase-resistant Enterobacteriaceae,NCRE)17例,对上述26例血培养样本打乱顺序,作为方法验证的临床样本。质控菌株选用大肠埃希菌ATCC®25922和肺炎克雷伯ATCC®BAA1706作为阴性对照,肺炎克雷伯ATCC®BAA1705作为阳性对照,均购自浙江省临床检验中心。
1.2 主要试剂和仪器 全自动快速生物质谱检测系统(Bruker autoflexTMMALDI-TOF MS)及相关配套试剂(德国布鲁克科技有限公司),血培养瓶、Vitek2 Compact细菌鉴定与药物敏感仪及相关配套试剂(法国梅里埃生物科技有限公司),血琼脂平板(郑州安图生物股份有限公司),1.5 ml EP管若干,亚胺培南标准品(湖北惠择普医药科技有限公司,CAS号:64221-86-9),十二烷基硫酸钠(天津北辰方正化工),真空采血管(美国BD公司),高速离心机(美国赛默飞世科技公司),万分之一天平(日本岛津公司)。
1.3 方法
1.3.1 细菌鉴定和药敏试验 采用Vitek2 Compact做细菌鉴定和药敏试验,结果解释参照CLSI M100 S31标准[12]。
1.3.2 耐药基因检测 采用煮沸法提取细菌DNA模板。PCR体系50 μl,2×PCR Master Mix 25 μl,上、下游引物 10 μmol/L 各 1 μl,模板 DNA 2 μl,灭菌水 21 μl。PCR反应条件:94 ℃ 5 min;94 ℃ 30 s,退火温度30 s,72℃45 s,30个循环;72℃延伸5 min。再取PCR扩增物进行琼脂糖凝胶电泳,观察并拍摄。详细步骤及引物设计参照文献[11]。
1.3.3 模拟阳性血培养 复融上述菌株于血平板中,过夜培养18 h。挑取少许菌落溶于无菌0.9%氯化钠溶液中,配制成0.5麦氏浓度菌悬液(相当于1.5×108CFU/ml),稀释至1×103CFU/ml。在输血科收集报废O型悬浮红细胞和O型血浆,混合制成红细胞压积(Hct)约为0.4的模拟人血液。取1 ml上述菌悬液混于9 ml人模拟血液,注入血培养瓶中,放置血培养仪等待报阳后取出备用。
1.4 血培养液前处理
1.4.1 制备菌悬液 用注射器抽取报阳后的血培养液5 ml,置于真空采血管内,1 170 r/min,离心5 min,将红细胞沉置分离胶下部,弃上清液。加入0.5%十二烷基硫酸钠(SDS)溶液1 ml洗涤,用旋涡振荡器混匀后,再次1 170 r/min,离心5 min。该洗涤步骤重复进行2次,弃上清液,加入0.9%氯化钠溶液1 ml复混,获得单一的菌悬液备用。
1.4.2 菌株鉴定 于EP管中分别加入150 μl上述菌悬液和450 μl无水乙醇,混匀后16 000 r/min,离心2 min,弃上清液后加入20 μl 70%甲酸溶液和20 μl乙腈,混匀,再次 16 000 r/min,离心 2 min。取上清液 1 μl,点靶;干燥后滴加1 μl基质液(α-HCCA),晾干后上机。
1.4.3 亚胺培南分解试验 利用万分之一天平称取10 mg亚胺培南和20 mg SDS溶于10 ml 0.9%氯化钠注射液中,配制成0.2%SDS、1.0 mg/ml亚胺培南混合液,备用。吸取30 μl上述混合液于EP管中,再加入30 μl菌悬液,混匀后放置37℃水浴箱2 h。随后,将EP管16 000 r/min,离心2 min,取上清液 1 μl,点靶;干燥后滴加1 μl基质液,晾干,上机。
1.5 MALDI-TOF MS分析及结果判定 质谱仪采用反射正离子模式,手动采集光谱,采集区间为100~600Da;参数设置:离子源1∶10.00 kV;离子源2∶9.08 kV;镜头:3.00 kV;脉冲离子提取时间:10 ns;激光频率:60.0 Hz。应用flexControl 3.3软件(Bruker Daltonics)分析所得光谱。
菌种鉴定收集2 000~20 000 Da的光谱,用BTS进行仪器校准,通过软件IVD MALDI Biotyper 3.1版识别菌名,并且以软件给出的Biotyper log值评价鉴定效果:分值≥2.0视为鉴定到种水平,1.70~1.99视为鉴定到属水平,分值<1.70视为不可信结果。
通过观察亚胺培南(Imipenem:C11H17N3O4S,相对分子质量:299.35 g/mol)产生的质谱峰[Imipenem+H+]:300 m/z、亚胺培南和基质液混合物[Imipenem+α-HCCA+H+]:489 m/z质谱峰,两处峰完全消失,判定为试验菌产生可以分解亚胺培南的碳青霉烯酶。
1.6 方法验证 对上述26株临床阳性血培养样本按照1.3~1.4步骤操作。
1.7 质量控制
1.7.1 质谱峰校准 利用基质液中α-氰基-4-羟基肉桂酸(α-HCCA:C10H7NO3,相对分子质量189.17 g/mol)电离产生的质谱峰对波峰采集区间0~600 Da进行校准,校准峰分别为 HCCA_[M+H+]:190.050 m/z、HCCA_[M+Na+]:212.032 m/z和 HCCA_[2M+H+]:379.092 m/z,3个校准峰值同时出现,并且每个峰的最大偏差(Err/ppm)都不超过±100 ppm,即视为校准通过[14]。同时,把α-HCCA的质谱峰作为空白实验对照。
1.7.2 药物对照 取0.5 g/ml亚胺培南混合0.1%SDS溶液1 μl点靶干燥后滴加基质液,上机后收集的质谱峰作为此次实验的药物对照。
1.7.3 阴阳性对照 以大肠埃希菌ATCC®25922和肺炎克雷伯菌ATCC®BAA1706作为不产碳青霉烯酶的阴性对照株,肺炎克雷伯菌ATCC®BAA1705作为产KPC的阳性对照株,按照上述实验流程检测。
1.8 统计学处理 采用SPSS 21.0统计软件。计量资料以表示;使用Kappa对质谱法结果和原先检出的基因检测结果进行一致性检验。P<0.05为差异有统计学意义。
2 结果
2.1 质谱峰校准分析 经校准,质谱仪内部校准通过,见图1a。图1b中300 Da处为亚胺培南分子电离产生的质谱峰,和约为489 Da处由亚胺培南与HCCA混合物形成的质谱峰,以及SDS(C12H25SO4Na,相对分子质量:288.38)分子_[SDS+Na+]:311 Da处的质谱峰。
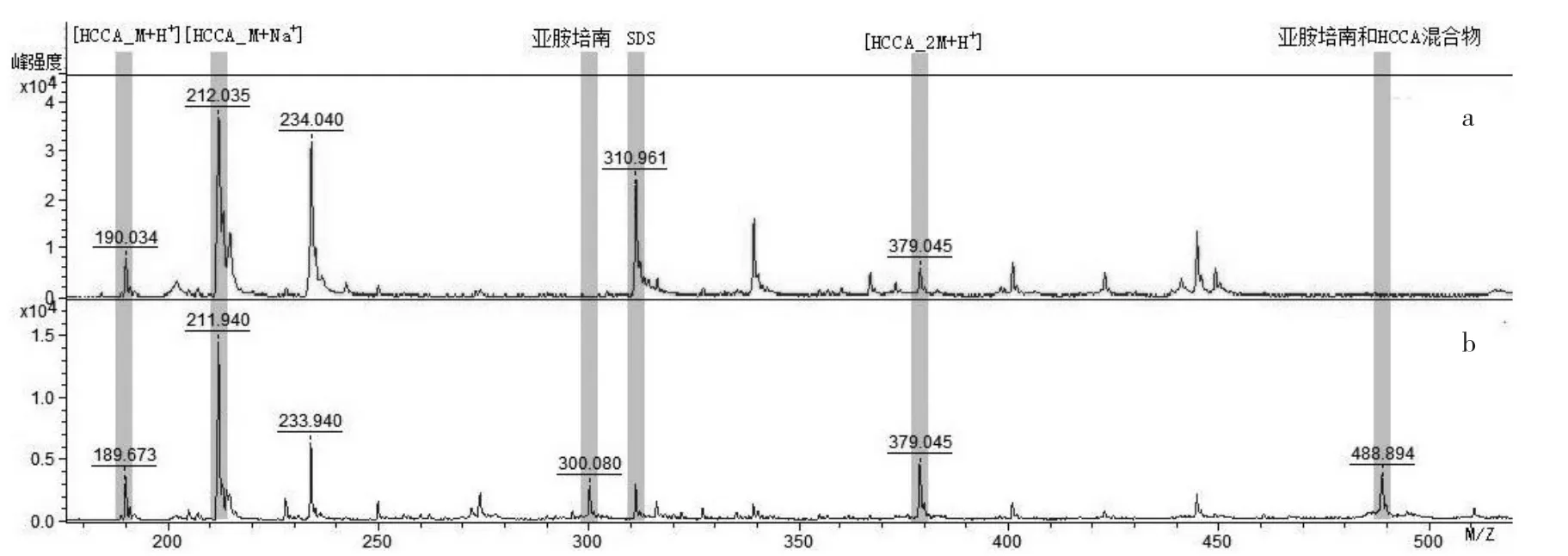
图1 质谱校准峰、亚胺培南和SDS质谱峰示意图
2.2 药敏及质谱结果 本实验共收集CPE 25株和NCPE 21株,包含5种肠杆菌目细菌,携带碳青霉烯酶基因blaKPC-2、blaIMP-4和blaNDM及β内酰胺酶blaCTX-M,见表1。药敏结果显示,25株CPE对亚胺培南和厄他培南的最小抑菌浓度(MIC)分别为4~≥16不等,另外21株NCPE的MIC为≤0.5~2。阳性血培养液提纯菌液的直接细菌鉴定结果同之前纯菌落鉴定结果完全一致,软件给出的Biotyper log值为2.188±0.102,种水平鉴定率为96.0%,属水平鉴定率为100.0%。在亚胺培南水解试验中,结果显示:25株CPE生成的质谱图均未出现300 m/z和489 m/z处的质谱峰,提示亚胺培南已被完全水解。而21株NCPE则全部检测到300 m/z和489 m/z的质谱峰,见图2。应用一致性检验结果Kappa=1,提示两种方法高度一致。
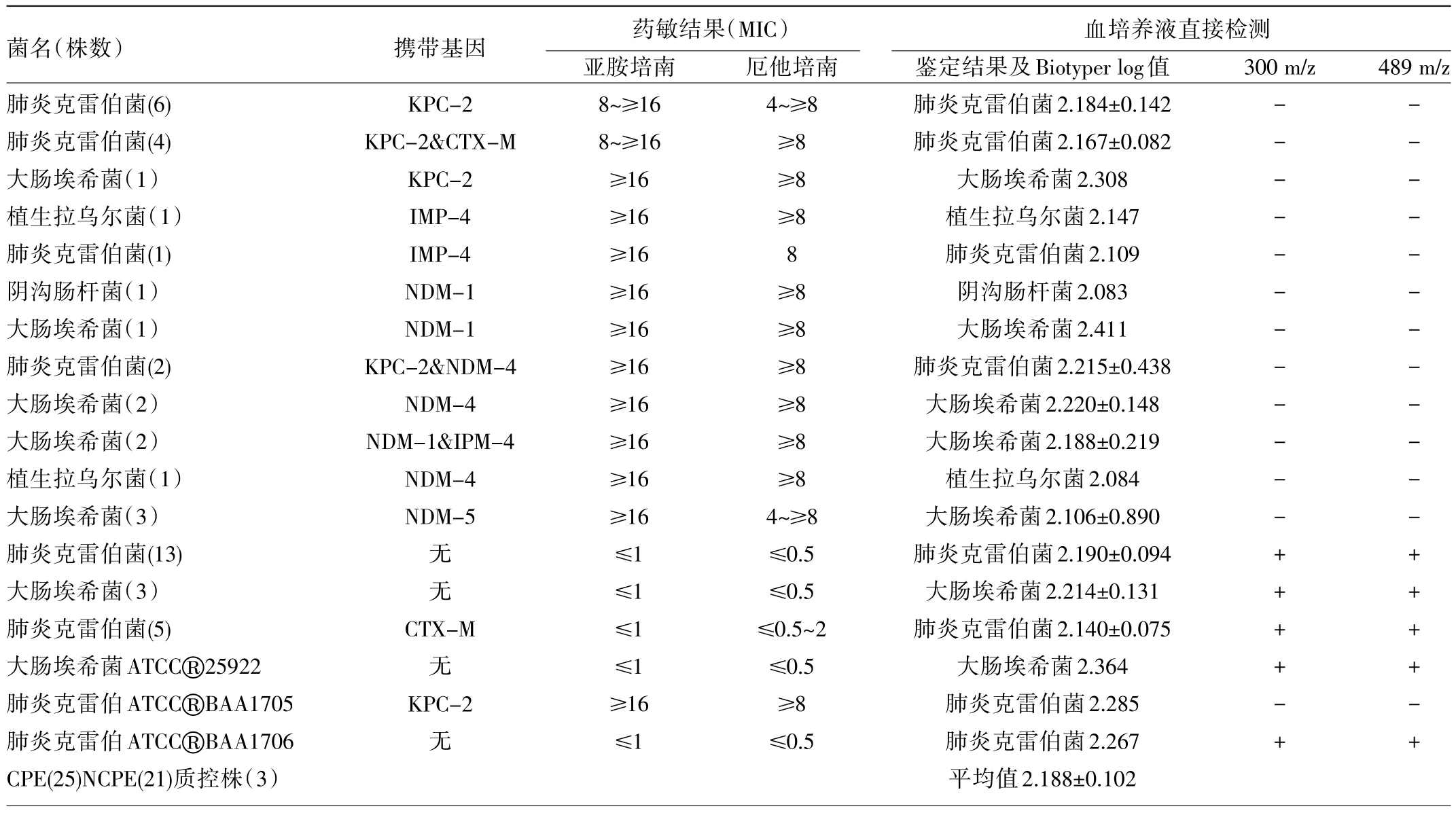
表1 49株肠杆菌目PCR、药敏及血培养液直接检测的质谱结果
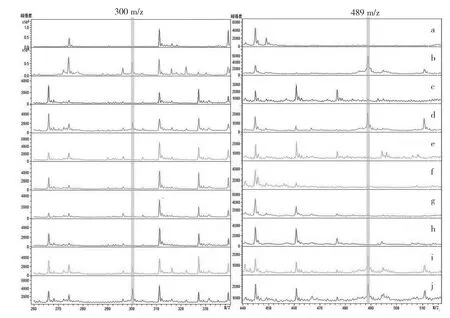
图2 10例300 m/z和489 m/z处的质谱峰消存情况(a:空白对照;b:药物对照;c:肺炎克雷伯菌ATCC®BAA1705;d:肺炎克雷伯菌ATCC®BAA1706;e:产KPC-2肺炎克雷伯菌;f:产IMP-4植生拉乌尔菌;g:产NDM-1阴沟肠杆菌;h:产KPC-2和NDM-4肺炎克雷伯菌;i:产CTX-M肺炎克雷伯菌;j:无携带耐药基因的大肠埃希菌)
2.3 质谱图结果 所有质谱图结果均表现为300 m/z和489 m/z同时存在或同时消失,未出现两处峰结果不一致的结果。同时311 m/z处由SDS生成的质谱峰均高于300 m/z处质谱峰,且十分稳定。
2.4 方法验证结果 验证结果显示,其中有17例出现300 m/z和489 m/z处质谱峰,且均对应17株碳青霉烯类药物敏感的菌株。剩下9例未出现这两处质谱峰,对应9株耐碳青霉烯类药物的肠杆菌目病原菌。统计结果显示其灵敏度和特异度均为1.00。
3 讨论
目前,根据CLSI和EUCAST指南,临床实验室应报告碳青霉烯类药物的敏感性,而在确认碳青霉烯酶的产生未做必要性要求。因此,自动化系统习惯性地忽视碳青霉烯酶的检测。近年来,针对CPE可以有效且快速分解亚胺培南的特性,通过飞行时间质谱技术捕捉亚胺培南所显示的特征谱峰,检测其水解情况,从而判断碳青霉烯酶活性的方法逐渐被开发。而本实验证实,该方法同样适用于在阳性血培养液中对CPE的检出。
本实验筛选46株经确定常见碳青霉烯酶基因型的细菌,模拟血培养报阳后,再经MALDI-TOF MS直接对血培养液做细菌鉴定和亚胺培南水解实验。结果显示,质谱检测21株CPE的结果均未检测到300 m/z和489 m/z处的质谱峰,而25株NCPE则均可检测到,对比基因表型高度一致。此外,对血培养液直接鉴定的细菌种水平鉴定率为96.0%。该数据与国外相关报道接近[13-14]。
在质谱图方面,本实验选择300 m/z和489 m/z两处质谱峰作为结果的判断,旨在避免因为细菌自身蛋白或其他杂质造成300 m/z或489 m/z任一处出现假性药物峰的错误判读[15]。因为一旦出现这两处峰的结果不一致,实验人员可以对结果质疑并重新评估。然而,本实验均未出现该情况。此外,311 m/z处由SDS产生的质谱峰极其稳定,且表现出相较其他谱峰更高的分辨率。SDS在实验中作为去污剂和表面活性剂,分别在血培养液的洗涤和上清液点靶后的快速干燥上起相应作用。通过涂片在显微镜下发现,未加入SDS洗涤的血培养液携带丰富的杂质,而这些杂质将会使下一步细菌鉴定的Biotyper log值下降0.5分以上(数据未显示)。并且,SDS的阴离子表面活性剂功能可以改变液体表面张力,从而克服上清液在靶板上干燥慢的缺陷。有研究表明,补充SDS在任何情况下都不会改变抗生素峰谱[15],本实验中也得以证实。
本研究选择亚胺培南作为水解底物,其相较于美罗培南和厄他培南,具备水解时间快[8],获得的质谱峰通常更清晰,使结果更易判读[16]等好处。但是,在本实验中未发现亚胺培南降解产物对应的峰,即使是重复的孵化和测量也没有获得更好可解释的结果。这一点与相关报道一致[13,16]。这可能与其水解产物的不稳定性有关[15],但目前尚未被证实。在本团队前期实验中发现,部分梅里埃生产的血培养瓶中含有碳粒成分,这对微生物蛋白的提取及纯化影响较大,不宜进行直接鉴定。然而,由于菌株收集有限,本研究只局限对肠杆菌目细菌的检测,未纳入非发酵菌,这点将在后续的研究中改进。
综上所述,MALDI-TOF MS可以直接从血培养液中鉴定病原菌及检测碳青霉烯酶活性,且表现出极好的灵敏度和特异度,这或将对临床及早调整抗菌药物治疗和实施感染控制措施提供值得期待的应用前景。

