基于CT影像特征构建鉴别肾上腺嗜铬细胞瘤和乏脂性腺瘤的预测模型
陈威 陶宇峰 王伟
肾上腺嗜铬细胞瘤(pheochromocytoma,PHEO)是一种起源于肾上腺髓质具有儿茶酚胺(包括肾上腺素、去甲肾上腺素、多巴胺或香草扁桃酸)分泌功能的神经内分泌肿瘤[1],约占肾上腺肿瘤的26%[2]。PHEO典型临床表现为高血压、头痛、心悸、多汗、代谢性综合征等,但实际工作中约10%~20%PHEO患者无临床表现或表现不典型[3],常误诊为肾上腺其他肿瘤。PHEO最有效治疗方法是手术切除[4],但术前不能明确诊断则会大大增加手术风险,有研究认为若术前诊断不明和未充分进行准备时,术中切除瘤体容易使患者血压飙升而导致高血压危象,此时病死率高达24%~50%[5]。因此,确保手术成功的关键是术前明确诊断和充分准备。肾上腺腺瘤(adrenal adenoma,AA)是一种起源于肾上腺皮质的最常见良性肿瘤[6],临床上分为无功能性和功能性腺瘤(分泌皮质醇、醛固酮和性激素),以无功能性腺瘤居多[7]。根据腺瘤脂肪含量的不同分为富脂性腺瘤(lipid-rich adenoma,Lr-AA)和乏脂性腺瘤(lipid-poor adenoma,Lp-AA),有报道认为CT检查平扫时平均CT值>10 Hu定义为Lp-AA[7]。PHEO与Lp-AA因CT检查表现有诸多相似之处而鉴别诊断困难,目前关于两者鉴别的相关研究大部分只对其影像学特征进行对比分析[8-9]。本研究拟建立基于双期增强CT影像特征预测两者的logistic回归模型,并探讨该模型的应用价值,以期提高PHEO的CT术前诊断准确率,为患者手术治疗的顺利开展提供参考。
1 对象和方法
1.1 对象 收集舟山医院2012年1月至2021年12月行CT增强检查和术后病理检查确诊的PHEO患者98例和Lp-AA患者234例。纳入标准:(1)所有肿瘤均经手术病理检查证实;(2)完整的平扫和双期增强CT影像、临床及实验室检查资料;(3)Lp-AA判定标准:平扫进行多层面最大面积CT值测量,感兴趣区(region of interest,ROI)CT值均>10 Hu。排除标准:(1)肿瘤直径<1 cm,肿瘤直径过小容易造成CT值测量误差;(2)肿瘤完全囊变/出血,无法测得实性部分CT值。平扫期肿瘤内CT值<20 Hu以及增强强化(动脉期和静脉期)幅度<10 Hu为囊变[10];平扫呈斑片状或结节状高密度影,CT值为55~90 Hu[11],增强后无强化为出血。最终入组PHEO 70例和Lp-AA 100例。PHEO组男36例,女34例,年龄21~82(49.3±14.0)岁。Lp-AA 组男 40例,女 60例,年龄 28~76(52.5±11.4)岁。手术病理检查证实良性PHEO患者64例,恶性PHEO患者6例。两组患者性别、年龄、有无临床症状、有无高血压和实验室检测指标比较差异均无统计学意义(均P>0.05),见表1。本研究经舟山医院医学伦理委员会批准,所有患者均知情同意。

表1 两组患者临床特征的比较
1.2 方法 采用日本东芝Aquilion64排和美国GE64排螺旋CT机。所有患者均在仰卧位屏气下行平扫及双期增强扫描。从上肘静脉以2.5~3.0 ml/s速度注射非离子型对比剂碘海醇,剂量为1.5~2.0 ml/kg,注射后分别于20~40 s、60~80 s获取动脉期、静脉期增强图像。扫描参数如下:管电压120 kV,管电流250~300 mA,层厚5 mm,重建图像层厚为1.5 mm,螺距1.0。
1.3 影像分析 所有患者CT图像由2位分别有15年和12年工作经验的放射诊断主治医师进行双盲分析,并当结果不一致时经讨论达成一致。肿瘤ROI CT值测量如下:于肿瘤最大截面层,取ROI面积超过测量层面面积的2/3,测量时避免囊变、钙化、出血区及周围组织(脂肪组织、血管和临近器官),2位医师均对病灶反复测量3次,取平均值。
影像学分析并记录以下内容:(1)大小:测量病灶最大截面的长径(the longest diameter,LD)和短径(the shortest diameter,SD),以及长短径的比值(LD/SD);(2)CT值:平扫CT值(CT attenuation values of unenhanced phase,CTu),动脉期CT值(CT attenuation values of arterial phase,CTa),静脉期CT值(CT attenuation values of venous phase,CTv);(3)增强幅度:动脉期增强幅度(the degree of enhancement in arterial phase,DEAP)=CTa-CTu,静脉期增强幅度(the degree of enhancement in venous phase,DEPP)=CTv-CTu,DEAP 和DEPP中最大者为DEpeak,增强强化峰值/平扫CT值[the ratio of peak enhanced(PE)/unenhanced CT attenuation values(U),PE/U]=DEpeak/CTu;(4)增强廓清率:绝对廓清率(absolute percentage washout,APW)=(CTa-CTv)×100/(CTa-CTu),相对廓清率(relative percentage washout,RPW)=(CTa-CTv)×100/CTa;(5)位置:左侧、右侧或双侧肾上腺;(6)形态:规则形(圆形和卵圆形)为LD/SD≤1.2,没有明显分叶;反之,为不规则形;(7)囊变/坏死:肿瘤密度不均匀,囊变定义同上述;(8)出血:出血定义同上述;(9)钙化:CTu>120 Hu定义为有,反之为无[12];(10)瘤内血管:增强动脉期/静脉期肿瘤内部可见血管影为有,反之为无;(11)渐进性强化:CTv>CTa时为有,CTv≤CTa时为无。
1.4 统计学处理 采用SPSS 25.0统计软件。正态分布的计量资料以表示,组间比较采用两独立样本t检验;非正态分布的计量资料以M(P25,P75)表示,组间比较采用Mann-WhitneyU检验;计数资料组间比较采用χ2检验。对差异有统计学意义的因素进行二元logistic回归分析,并建立回归模型。采用ROC曲线分析对肿瘤鉴别有意义的连续变量诊断效能,依据约登指数选择最佳截断值,以AUC评价该模型的诊断价值。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者双期增强CT影像特征的单因素分析两组患者肿瘤的大小(LD、SD)、三期CT测量值(CTu、CTa、CTv)、增强幅度(DEAP、PE/U)、增强廓清率(APW、RPW)、肿瘤的囊变及瘤内血管比较差异均有统计学意义(均P<0.05),而肿瘤位置、形态、出血、钙化、渐进性强化比较差异均无统计学意义(均P>0.05),见表2。ROC曲线分析结果见图1、2和表3。
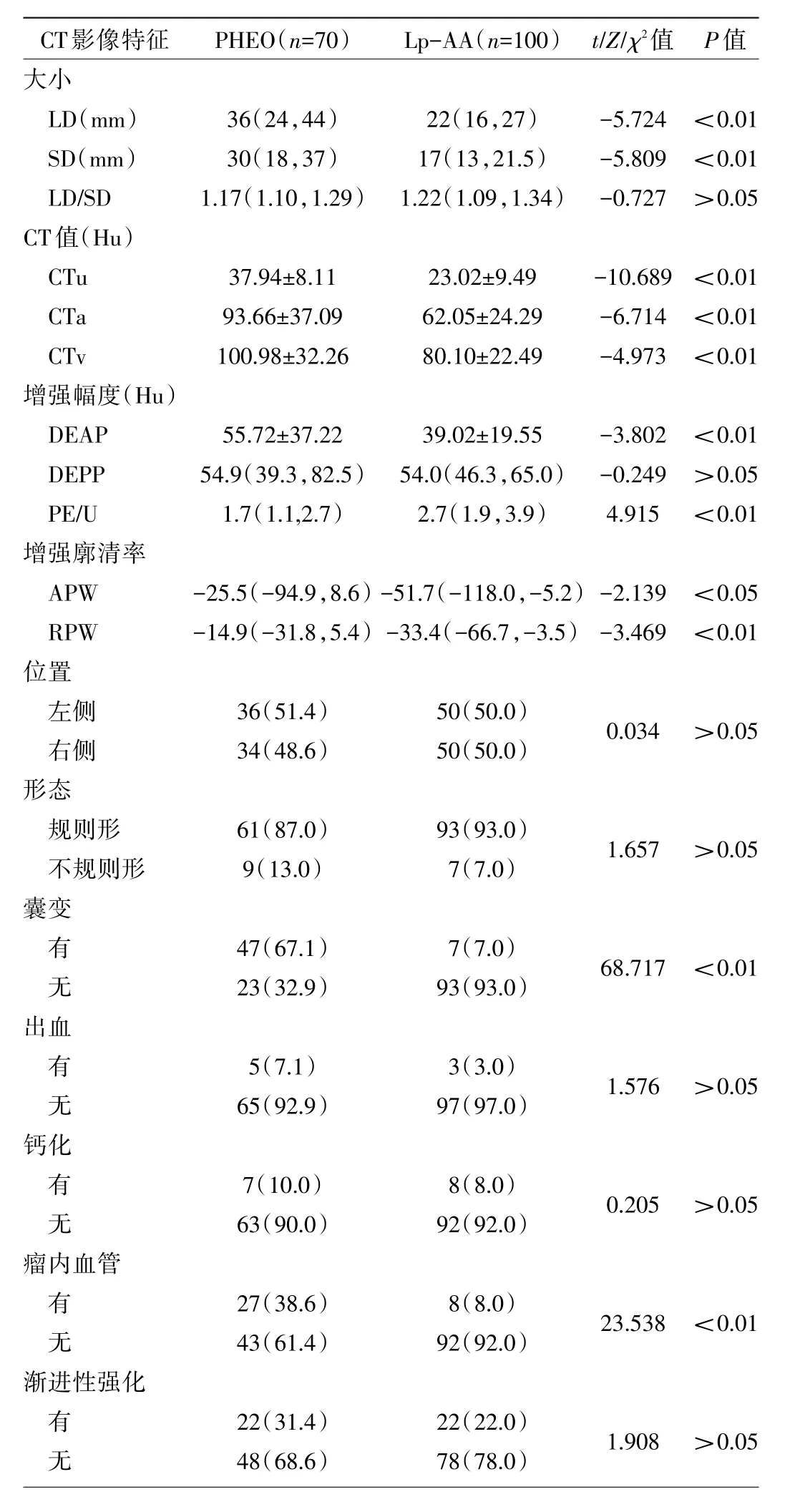
表2 两组患者CT检查结果的比较

图1 PE/U鉴别诊断PHEO和Lp-AA的ROC曲线

图2 CTu、CTa、CTv、SD、LD鉴别诊断PHEO和Lp-AA的ROC曲线
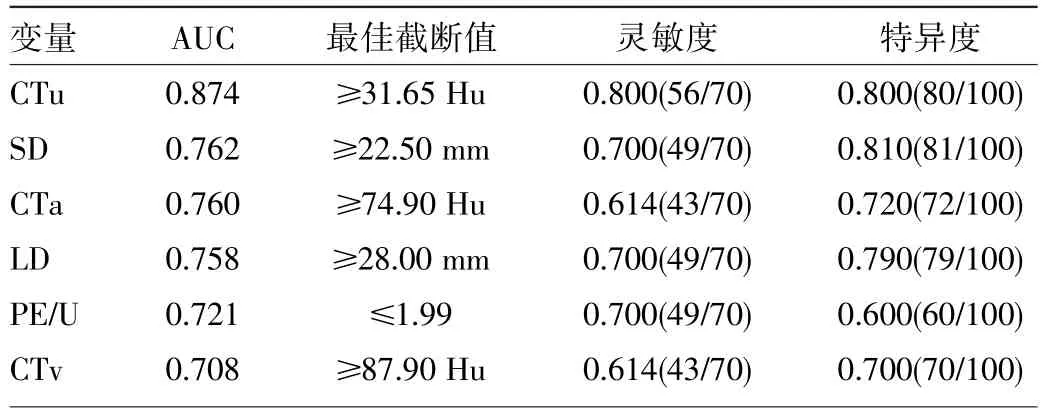
表3 PHEO和Lp-AA差异有统计学意义的连续变量ROC曲线分析结果(取AUC>0.700)
2.2 PHEO和Lp-AA双期增强CT影像特征的二元logistic回归分析 以两者作为因变量(PHEO:Y=1,Lp-AA:Y=0),将上述单因素统计分析10个差异有统计学意义的变量:肿瘤的三期CT测量值(CTu、CTa、CTv)、增强幅度(DEAP、PE/U)、增强廓清率(APW、RPW)、肿瘤大小(LD、SD)、肿瘤的囊变及瘤内血管,作为自变量(X)建立logistic回归模型,采用逐步法(Forward:LR法)筛选影响因素,结果显示:CTu(OR=1.217)、PE/U(OR=1.644)、囊变(OR=19.560)是独立影响因素,见表4,典型病例见图3、4。根据回归分析结果,构建logistic回归预测模型:Logit(P)=-8.609+0.196X1+0.497X2+2.973X3,并经似然比检验,模型差异有统计学意义(χ2=122.165,P>0.01)。
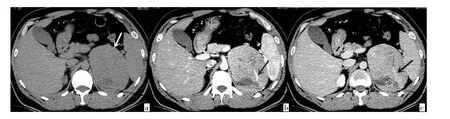
图3 65岁女性左肾上腺PHEO患者的CT图像[a:平扫示左侧肾上腺区见一卵圆形软组织肿块影(箭头所示),大小为112.8 mm×79.6 mm,密度欠均匀,CT值为48.6 Hu;b:动脉期示肿块明显不均匀强化,可见条状瘤内血管影(箭头所示),CT值为94.5 Hu;c:静脉期示肿块强化幅度有所下降,CT值为88.4 Hu,可见片状囊变无强化区(箭头所示)]

表4 logistic回归分析PHEO和Lp-AA的鉴别诊断结果
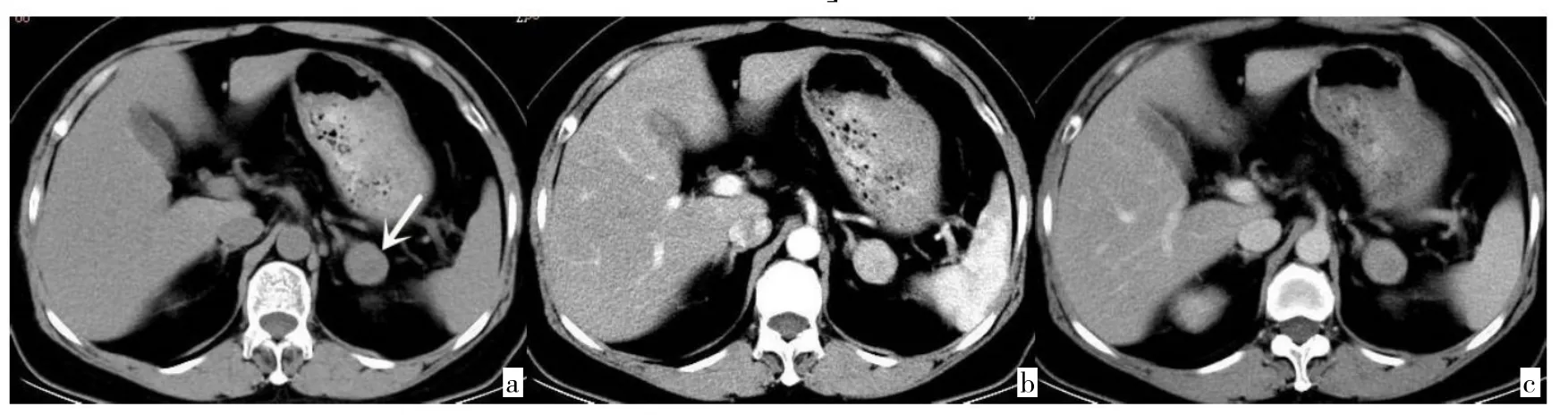
图4 47岁男性左肾上腺Lp-AA患者的CT图像[a:平扫示左侧肾上腺区见一圆形低密度肿块影(箭头所示),大小24.2 mm×20.5 mm,密度尚均匀,CT值42.8 Hu;b:动脉期示肿块明显均匀强化,CT值为93.1 Hu;c:静脉期示肿块强化幅度有所强化,CT值82.9 Hu,未见明显囊变区]
2.3 logistic回归预测模型对PHEO和Lp-AA诊断结果分析 以患者病理学检查结果作为“金标准”,利用logistic回归预测模型对该两组170例肾上腺肿瘤进行预测,如果回归值>0.5则判断为PHEO,回归值≤0.5则判断为Lp-AA,模型预测结果显示:预测准确度为0.847(144/170),灵敏度为 0.870(87/100),特异度为0.814(57/70),阳性预测值为0.870(87/100),阴性预测值为0.814(57/70)。以模型诊断PHEO的概率预测值绘制ROC曲线(图5),AUC为 0.931(95%CI:0.891~0.972,P<0.01),该预测模型对PHEO和Lp-AA鉴别诊断具有较好的预测效果。
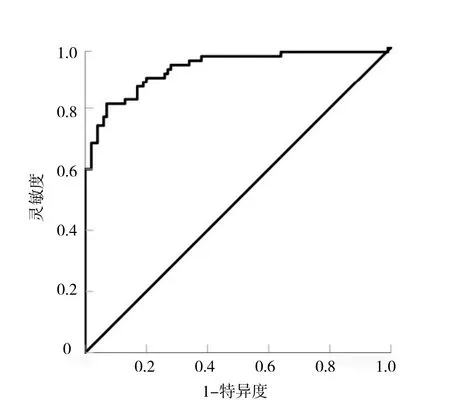
图5 logistic回归模型鉴别诊断PHEO的ROC曲线
3 讨论
本研究中,两组患者性别、年龄、临床症状、高血压和实验室指标比较差异均无统计学意义(均P>0.05),这说明仅仅依赖患者年龄、有无高血压及实验室指标是否阳性等不能很好地鉴别PHEO和Lp-AA。PHEO组和Lp-AA组高血压患者所占比例分别为54.3%和52.0%,原因考虑为两种肿瘤分别分泌的儿茶酚胺和醛固酮,均可引起高血压。本研究中,PHEO组实验室指标(血、尿儿茶酚胺)阳性的概率仅为41.4%,明显低于文献报道[13],考虑原因为由于PHEO波状分泌和释放儿茶酚胺,其数值在患者有无症状时波动明显,该结果亦表明仅依靠实验室检测诊断PHEO难度较大,必须同时借助影像学检查对其进行精准诊断。
本研究CT影像特征中,PHEO组和Lp-AA组的CT连续变量统计分析结果显示,PHEO组大小(LD、SD)、三期CT测量值(CTu、CTa、CTv)、增强幅度(DEAP)、增强廓清率(APW、RPW)均明显大于Lp-AA组,但增强幅度(PE/U)明显小于Lp-AA组。PHEO组CTu明显高于Lp-AA组CTu,该结论与Pate等[14]研究结果基本一致。PHEO组CTa与CTv均值明显高于Lp-AA组,这说明PHEO的血供明显优于Lp-AA。本研究结果中,PHEO组与Lp-AA组增强廓清率(APW、RPW)均为负值,且PHEO组APW、RPW绝对值明显小于Lp-AA组,这说明PHEO表现为快进快出的概率小于Lp-AA,与曹万里等[15]研究结果较为一致,有报道认为这与肿瘤实性区富含毛细血管网和大量血窦有关[3]。
PHEO组和Lp-AA组肿瘤大小比较差异有统计学意义,文献报道>5 cm的PHEO为恶性的可能性更大[16],本研究中6例恶性PHEO直径有6~9 cm,但由于本研究中的恶性PHEO例数较少,故未对良、恶性PHEO的大小作统计学比较。PHEO组和Lp-AA组CT检查的分类变量中,肿瘤的囊变与瘤内血管比较差异有统计学意义,PHEO更容易囊变和出现瘤内血管,这与以往的文献报道结果较为一致[3,17]。
本研究将logistic回归模型引入常规双期增强CT影像指标对PHEO和Lp-AA的鉴别诊断当中,对这两种肿瘤的大小(LD、SD)、CT值(CTu、CTa、CTv)、增强幅度(DEAP、DEPP、PE/U)、增强廓清率(APW、RPW)、位置、形态、有无囊变、有无出血、有无钙化、有无瘤内血管、有无渐进性强化等17个诊断中主要影像特征指标进行单因素及多因素logistic回归分析,结果显示囊变(OR=19.560)、PE/U(OR=1.644)、CTu(OR=1.217)这3项特征是独立影响因素,在日常的诊断工作中可以依据其OR值的大小着重观察这3个方面特征,并结合其他CT影像特征(SD、CTa、LD、CTv、瘤内血管)来鉴别诊断PHEO和Lp-AA将具有更高的准确性。本研究的预测模型能够很好地鉴别PHEO,其预测准确度达0.847,灵敏度为0.870,特异度为0.814,用于评价该模型拟合优度的AUC为0.931,明显优于以往文献中的鉴别效能[9],表明该曲线的预测效果非常理想,进一步验证了该回归预测模型对于PHEO和Lp-AA的鉴别诊断具有非常高的应用价值。
本研究存在一些局限性。首先,本研究为回顾性分析,收集的数据时间跨度较长,CT机器型号存在一定的差异,降低了图像对比的一致性;其次,研究中2位医师对病灶进行定量测量时存在一定的误差,但对病灶反复测量3次,且取其所测结果的平均值为最终结果,故在一定程度上能降低测量误差。
综上所述,基于CT影像特征构建PHEO和Lp-AA的logistic回归模型对两者的鉴别诊断具有较高的临床应用价值。

