超声引导下经皮射频消融联合125I放射性粒子植入术治疗肝癌的疗效分析
卢斌 董科 翁文超 张兆辉 王升晔
肝癌是临床上最常见的恶性肿瘤之一,其发病率及死亡风险较高,严重威胁患者的生命安全[1-3]。肝切除术是临床上治疗肝癌的主要手段,但部分患者确诊时已失去肝切除术治疗机会,需要采取其他治疗方法进行治疗。近年来,超声引导下经皮射频消融术(radiofrequency ablation,RFA)、125I放射性粒子植入术在肝癌治疗中得到广泛应用。笔者对单纯接受超声引导下RFA与接受超声引导下RFA联合125I放射性粒子植入术治疗的肝癌患者进行回顾性分析,探讨超声引导下RFA联合125I放射性粒子植入术治疗肝癌的疗效,现将结果报道如下。
1 对象和方法
1.1 对象 选取2015年7月至2018年6月浙江大学医学院附属金华医院接受超声引导下RFA治疗的40例肝癌患者(对照组)与接受超声引导下RFA联合125I放射性粒子植入术治疗的40例肝癌患者(观察组)。纳入标准:(1)经影像学检查、临床症状、手术病理检查确诊为肝癌,病灶数量≤3个,病灶直径<7 cm,无肝外转移;(2)具备RFA、125I放射性粒子植入术指征,接受超声引导下RFA、125I放射性粒子植入术,未接受其他治疗;(3)签署知情同意书;(4)临床资料保存完整。排除标准:(1)合并严重感染;(2)合并其他恶性肿瘤;(3)既往有肝脏手术史;(4)伴有精神障碍、意识障碍。观察组中男23例,女17例,年龄29~86(56.23±12.47)岁,临床分期为Ⅲ期27例、Ⅳ期13例,肿瘤直径3~6(4.55±1.12)cm;对照组中男24例,女16例,年龄30~85(56.67±13.24)岁,临床分期为Ⅲ期28例、Ⅳ期12例,肿瘤直径3~6(4.63±1.09)cm。两组患者性别、年龄、临床分期、肿瘤直径比较差异均无统计学意义(均P>0.05)。本研究经浙江大学医学院附属金华医院医学伦理委员会批准。
1.2 方法 对照组接受超声引导下RFA治疗。患者采取仰卧位,行局部浸润麻醉,采用日立HI VISION Preirus超声诊断仪进行扫描,在超声引导下对穿刺点进行标记,将消融针穿刺至肝脏肿瘤病灶区域,采用美国柯惠公司Covidien Cool-tipTM射频消融系统,初始功率设置为40 W,采用脉冲模式,最大功率控制在120 W,开启RFA治疗系统,将病灶及边缘至少0.5~1.0 cm范围内的组织消融。消融完成后对患者进行超声造影复查,评估消融效果,如存在消融残余病灶,需再次进行RFA处理。若患者存在复发未合并严重感染者(且病灶数量≤3个,病灶直径<7 cm),接受二次RFA治疗。观察组接受超声引导下RFA联合125I放射性粒子植入术治疗,超声引导下RFA步骤与对照组一致,消融完成后对患者进行超声造影复查,评估消融效果。采用放射治疗计划系统,根据对无法消融及消融残余病灶的大小勾画计划靶区,计算计划靶区内需植入的125I粒子数量,在超声引导下采用18 G粒子植入针于穿刺点进针,连接天津赛德放射性粒子(活度0.5~0.7 mCi)植入枪,边退出边将125I粒子植入。在125I粒子植入期间,医护人员需戴好铅眼镜、围裙、手套,并在术后对患者靶区侧方、正前方、靶区对侧的皮肤表面及口腔的辐射剂量进行监测,与患者接触时需注意保持100 cm,做好辐射防护。
1.3 观察指标
1.3.1 疾病控制率 随访术后3年,评价两组患者的疾病控制效果,具体评价标准为:(1)完全缓解(complete response,CR):肿瘤病灶完全消失,未出现新发病灶;(2)部分缓解(partial response,PR):肿瘤病灶缩小幅度达到50%;(3)疾病稳定(stable disease,SD):肿瘤病灶缩小幅度不足50%,或增大幅度不足25%;(4)病变进展(progression disease,PD):肿瘤病灶增大幅度达到25%,或出现新发病灶。疾病控制率=CR+PR+SD。
1.3.2 癌因性症状 记录治疗前(手术前1天)、治疗后(手术后1周)两组患者的癌因性疼痛、癌因性疲乏症状,疼痛症状采用视觉模拟评分量表(visual analogue scale,VAS)评估,疲乏症状采用简易疲乏量表评估,两种评分的分值范围均为0~10分,得分越高,疼痛、疲乏程度越严重。
1.3.3 存活率、肿瘤复发率 术后随访1、3年,分别至门诊行超声造影检查,评价两组患者的存活率、肿瘤复发率。
1.3.4 生存质量评分 术后随访1、3年,采用世界卫生组织生存质量测定简表(WHOQOL-BREF)评估存活患者的生存质量,量表分4个维度,即生理、心理、环境、社会关系,单个维度分值为0~100分,得分越高,生存质量水平越高[4]。
1.4 统计学处理 采用SPSS 22.0统计软件。计量资料以表示,组间比较采用两独立样本t检验;计数资料以百分率表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者疾病控制率比较 观察组患者疾病控制率为85.0%,高于对照组的65.0%,差异有统计学意义(P<0.05),见表1。

表1 两组患者疾病控制率比较[例(%)]
2.2 两组患者癌因性疼痛评分、癌因性疲乏评分的比较 两组患者治疗前癌因性疼痛评分、癌因性疲乏评分比较差异均无统计学意义(均P>0.05)。与治疗前比较,两组患者治疗后癌因性疼痛评分、癌因性疲乏评分均降低,差异均有统计学意义(均P<0.01);治疗后,观察组患者癌因性疼痛评分、癌因性疲乏评分均低于对照组,差异均有统计学意义(均P<0.01),见表2。
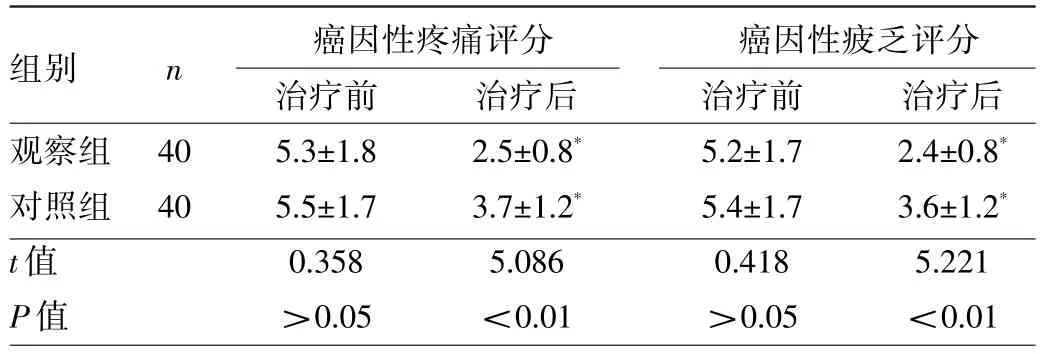
表2 两组患者癌因性疼痛评分、癌因性疲乏评分的比较(分)
2.3 两组患者随访1、3年存活率、肿瘤复发率的比较 观察组1、3年存活率均高于对照组(均P<0.05),观察组1、3年肿瘤复发率均低于对照组(均P<0.05),见表3。两组复发患者均接受二次RFA治疗。

表3 两组患者随访1、3年存活率、肿瘤复发率的比较[例(%)]
2.4 两组存活患者的生存质量评分比较 术后随访1、3年,观察组存活患者的生存质量评分均高于对照组(均P<0.01),见表4。

表4 两组存活患者的生存质量评分比较(分)
3 讨论
肝癌具有高发病率和高病死风险[5-6],因此,临床上需要及时治疗,遏制肿瘤的进展。但由于肝癌患者早期阶段缺乏特异性症状,部分患者在确诊时已经发展至局部晚期阶段,无法接受手术切除治疗[7-8]。介入技术在近年来用于治疗肝癌取得了良好的进展,如超声引导下RFA和125I放射性粒子植入术,与传统手术比较,这两种治疗方法具有创伤小、并发症少、恢复快等优点[9-11],已成为肝恶性肿瘤常用的治疗方式,但单独使用一种方法易造成肿瘤治疗不彻底。
超声引导下RFA主要是应用超声引导技术进行导航,在超声引导下穿刺进针,可对穿刺针的针尖位置和进针方向予以实时显示,确保穿刺安全性,使穿刺针准确抵达肝脏肿瘤病灶,确保射频电流能够精准作用于肿瘤组织,产生热效应,而肝肿瘤组织往往不耐热,当热度达到一定程度,会逐渐消融肿瘤组织,对癌细胞内的线粒体和溶酶体结构进行破坏,诱导细胞凋亡,发挥抗肿瘤作用[12-14]。因此,可先用超声引导下RFA最大限度损毁肿瘤组织。
放射治疗是肝癌局部晚期阶段的治疗方法,125I放射性粒子植入术是一种新型的放疗手段[15],主要是通过将125I放射性粒子直接置入至肿瘤病灶,确保125I放射性粒子在半衰期内可持续地作用于肿瘤细胞,诱导肿瘤细胞凋亡,而在超声引导下植入,可提高125I放射性粒子植入的精准度,确保放射性粒子植入到位,对肿瘤细胞发挥有效的杀伤作用[16-18]。
景元明等[19]运用RFA联合125I放射性粒子植入治疗17例胃癌肝转移患者,2个月后CR+PR有15例(88.2%),局部病灶均无进展,无严重并发症。王舒婷等[10]证实对于直径>5 cm的乏血供肝恶性肿瘤进行RFA联合125I放射性粒子植入术(联合治疗组),客观缓解率(87.2%)、疾病控制率(95.7%)、1年生存率(80.9%)均高于对照组(66.7%、81.8%、75.8%)(均P<0.05)。而本研究中选取病灶数量≤3个,病灶直径<7 cm的临床Ⅲ、Ⅳ期的患者,对照组实施超声引导下RFA治疗,观察组实施超声引导下RFA联合125I放射性粒子植入术。观察组在超声引导下RFA治疗后,采用超声造影复查肿瘤病灶的消融情况,对残留或无法消融的肿瘤病灶(靠近膈肌、胆管或门静脉等位置的肿瘤组织易残留)进行125I放射性粒子植入,达到灭活残余肿瘤的效果,弥补了单一运用其他技术的不足。本研究结果显示,观察组的疾病控制率(85.0%)高于对照组(65.0%),治疗后的癌因性疼痛评分、癌因性疲乏评分均低于对照组(均P<0.05),说明超声引导下RFA联合125I放射性粒子植入术可提高肝癌患者的近期疗效,延缓肿瘤进展,减轻症状;而且观察组1、3年存活率均高于对照组(均P<0.05),1、3年肿瘤复发率均低于对照组(均P<0.05),说明超声引导下RFA联合125I放射性粒子植入术可减少患者的近中期复发和死亡风险,改善预后;此外,在随访1、3年时,观察组存活患者的生存质量评分均高于对照组(均P<0.05),说明超声引导下RFA联合125I放射性粒子植入术可提升存活患者的生存质量,这主要是因为125I放射性粒子植入术增强了对肿瘤的控制效果。
综上所述,超声引导下RFA联合125I放射性粒子植入术可控制肝癌患者的肿瘤进展,减轻患者癌因性症状,从而提高患者的近中期存活率,减少局部复发,使存活患者的生存质量水平提升。但本研究为回顾性分析,且病例数较少,仍需大样本、多中心临床进一步研究探索。

