鼠李糖乳杆菌及姜黄素通过调节TLR4信号通路对代谢相关脂肪性肝病影响的研究
徐子媛 张九娜 孟灿灿 程燕 郭永泽 李校天
1河北工程大学临床医学院(河北邯郸 056000);2河北工程大学附属医院(河北邯郸 056000)
代谢相关脂肪性肝病(metabolic associated fatty liver disease,MAFLD)曾经被称为非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)[1],是全球各地肝病相关死亡的重要原因[2]。近年来随着生活方式和饮食习惯的改变,该病的发病率持续升高[3],全球患病率为25.54%[4],已经成为了全球普遍关注的医学和社会问题。从“一次打击”学说到“多次打击”学说,MAFLD 的发病机制尚未完全阐明,目前普遍接受的是“多次打击”学说[5],它的核心因素包括脂质代谢紊乱、胰岛素的抵抗和氧化应激反应[6]。随着研究的深入,先天免疫的活化在MAFLD 进展中的作用被证实,Toll 样受体途径是其中关键的一环[7],TLR4 信号通路可以诱导炎症、介导氧化应激,在MAFLD 的发病机制中起到了关键性作用。除干预饮食及生活方式外,目前临床尚无MAFLD 的国际批准治疗药。故本实验通过研究鼠李糖乳杆菌及姜黄素对MAFLD 模型形成过程中TLR4 信号通路的影响,探讨MAFLD形成的调节控制因素及其机制。
1 材料与方法
1.1 实验材料
1.1.1 实验动物SPF 级SD 雄性大鼠40 只,8~12 周龄,体重(160±20)g,由济南彭越实验动物繁育公司提供。分笼饲养于温度及湿度适宜的情况下,不限制饮食和水,动物处置过程严格遵守河北工程大学医学院生物医学伦理委员会的规定。
1.1.2 药品与试剂鼠李糖乳杆菌冻干粉购于郑州百益宝生物技术销售部,姜黄素羧甲基纤维素钠购于大连美伦生物技术有限公司。所有药物均置于4℃冰箱冷藏,每日灌胃前新鲜配制。脂多糖(LPS)、白细胞介素-6(IL-6)和肿瘤坏死因子-α(TNF-α)ELISA 试剂盒,均购于杭州联科生物技术有限公司。Toll 样受体4(TLR4)、核因子-κBp65(NF-κBp65)、MyD88 和β-Actin 内参抗体,均购于美国Santa 公司。
1.1.3 仪器全自动生化仪,美国贝克曼有限公司产品;酶标仪,赛伯乐仪器有限公司产品;蛋白电泳仪,美国伯乐公司产品;
1.2 实验方法
1.2.1 大鼠分组40 只SD 雄性大鼠适应性喂养一周后随机分为5 组:正常对照组(MCS)、模型对照组(MCD)、鼠李糖乳杆菌干预组(LGG)、姜黄素干预组(CUR)、鼠李糖乳杆菌联合姜黄素干预组(LGG+CUR),每组8 只。
1.2.2 大鼠MAFLD 模型建立及干预模型对照组大鼠饲以蛋氨酸胆碱缺乏(methionine-cholinedeficient diet,MCD)饲料,该模型主要用于NAFLD治疗药物的筛选[8],正常对照组大鼠饲以蛋氨酸胆碱充足(methionine-choline-suffficient diet,MCS)饲料。各干预组在MCD 饮食的基础上,LGG 组每日以鼠李糖乳杆菌2.0×1010CFU/100 g/d 剂量溶液灌胃一次,CUR 组每日以姜黄素200 mg/(kg·d)剂量溶液灌胃一次,LGG+CUR 组每日以鼠李糖乳杆菌2.0 × 1010CFU/100(g·d)剂量溶液联合姜黄素200 mg/(kg·d)剂量溶液灌胃一次。正常对照组和模型对照组每日同等量的蒸馏水灌胃。溶液为鼠李糖乳杆菌冻干粉、姜黄素和无菌蒸馏水现配现用。
1.2.3 标本收集、处理和肝指数计算连续喂养4 周,每日观察大鼠的进食、活动、生长、毛色等情况。造模结束后,次日清晨称重,用100 g/L(10%)水合氯醛溶液0.5 mL/100 g 腹腔注射麻醉后,门静脉取血,以4 000 r/min 离心5 min。血清分装于1.5 mL 的离心管中,置于超低温冰箱中保存备用;同时取出新鲜完整肝脏,去除肝脏包膜,迅速称肝湿重,计算肝指数。另切取肝左叶的肝组织数块,置于4%多聚甲醛液,做上标记,其余置于超低温冰箱中保存,用于RT-PCR、Western-blot 等检测。肝指数=肝湿重(g)/体重(g)×100%。
1.2.4 HE 染色法观察肝组织病理形态将切片放入二甲苯(Ⅰ、Ⅱ溶液,各20 min),再放入无水乙醇(Ⅰ、Ⅱ溶液,5 min),入75%酒精中5 min,自来水冲洗。随后入苏木素染液染5 min,自来水冲洗,分化液分化,自来水冲洗,返蓝,流动水洗。入85%、95%的酒精,各5 min。入伊红染液5 min。依次放入无水乙醇Ⅰ、Ⅱ、Ⅲ和二甲苯Ⅰ、Ⅱ中,各5 min,进行脱水透明。采用中性树胶封片后,光学显微镜观察,采集图像。
1.2.5 全自动生化分析仪测血清转氨酶及肝脏脂肪含量用全自动生化分析仪测大鼠血清丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)、肝甘油三酯(liver triglycerides,TG)、肝胆固醇(liver cholesterol,TC)水平。
1.2.6 酶联免疫吸附法测血清炎性因子用酶联免疫吸附法(ELISA)法测定血清中脂多糖(LPS)、白细胞介素-6(IL-6)和肿瘤坏死因子-α(TNF-α)的含量,按照试剂盒提供的说明书严格进行。
1.2.7 RT-PCR 法测TLR4、NF-κBp65 和MyD88基因的表达量取大鼠肝组织100 mg,Trizol 法提取组织RNA,具体步骤按照试剂盒说明书操作,NanoDrop®ND-2000 仪器检测提取RNA 的浓度及质量,利用Prime-Script®RT Enzyme Mix 试剂盒将RNA 逆转录成cDNA,加入扩增反应体系运用实时荧光定量PCR 法扩增,40 个循环反应结束后用2-ΔΔCt法进行相对定量分析,检测基因mRNA 相对表达水平。以为β-Actin为内参,引物序列见下表。
1.2.8 蛋白质印迹法测TLR4、NF-κBp65和MyD88蛋白的表达量取大鼠肝组织100 mg,提取细胞总蛋白,各取60 μg 进行凝胶电泳,半干转移法转膜、5%脱脂牛奶封闭、一抗封闭和二抗封闭后,用增强化学发光法曝光,显影、定影和冲洗晾干后,扫描仪扫描蛋白条带。以β-Actin 为内参,以所测蛋白的灰度值/β-actin 的灰度值的比值为所测蛋白的相对表达量。
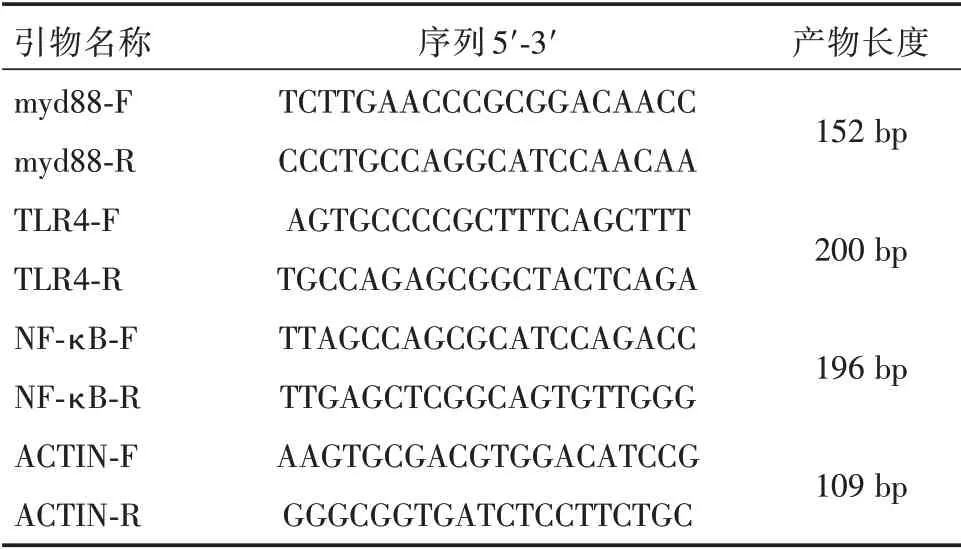
表1 引物序列表Tab.1 Primer sequence list
1.3 统计学处理采用统计学软件SPSS 26.0 进行数据分析与整理,测量数据以(±s)表示。5 组间比较采用单因素ANOVA 分析,5 组间两两比较时采用t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 一般情况所有大鼠实验过程中均没有死亡,MCS组大鼠饮食良好,灵敏好动,毛发光洁;MCD组大鼠饮食减退,体重下降,反应迟钝,毛发灰暗;LGG组、CUR组、LGG+CUR组大鼠一般情况较MCD组有所改善,LGG+CUR组一般情况接近MCS 组。
2.2 肝指数比较MCD 组大鼠较MCS 组肝指数明显升高,两组间比较差异有统计学意义(P<0.01);各干预组与MCD 组比较,肝指数均不同程度降低,联合组降低最显著,差异均有统计学意义(P<0.01),提示鼠李糖乳杆菌、姜黄素均可改善MAFLD 模型大鼠的肝指数,两者联合效果更佳。见表2。

表2 5 组大鼠肝指数的比较Tab.2 Comparison of the liver index in 5 groups of rats x±s
2.3 肝组织病理学变化比较正常对照组大鼠的肝小叶结构完整,细胞核分布均匀,且肝细胞大小一致;模型组大鼠出现明显的弥漫性的肝细胞脂肪变性,细胞核大小不一;各干预组与模型组比较,均有不同程度的脂肪细胞浸润,且脂肪变性程度和脂肪空泡数量均呈不同程度减少,见图1。

图1 显微镜下大鼠肝组织病理学变化比较(×200)Fig.1 Comparison of the pathological changes of liver tissue under microscope(×200)
2.4 血清转氨酶及肝脏脂肪水平比较与MCS组比较,MCD 组大鼠血清ALT、AST、肝组织TG、TC明显升高,差异均有统计学意义(P<0.01);各干预组与MCD 组比较,血清ALT、AST、肝组织TG、TC 均有不同程度的降低,其中以LGG+CUR组最为明显,差异均有统计学意义(P<0.01)。该研究结果提示鼠李糖乳杆菌及姜黄素均可显著改善MAFLD 模型大鼠肝功能、降低肝脏脂肪沉积,两者联合应用效果更佳。见表3。
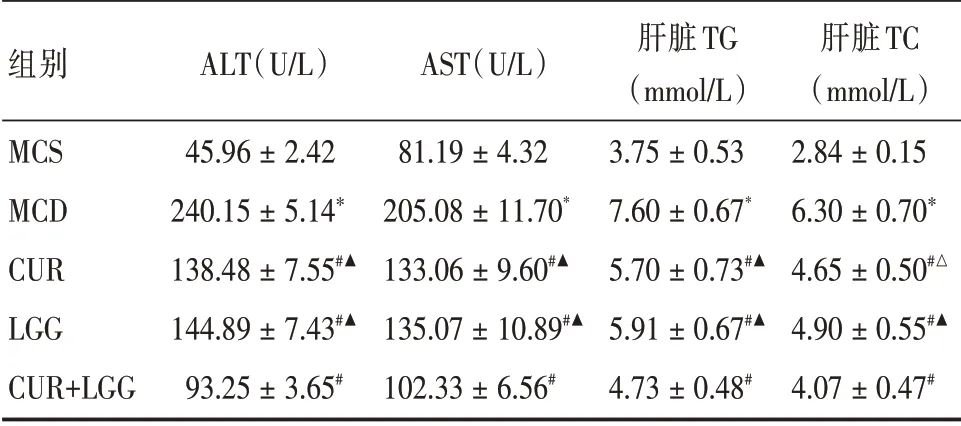
表3 大鼠ALT、AST 和肝脏RG、TC 水平Tab.3 Serum ALT,AST and liver TG levels in rats x±s
2.5 血清炎性因子水平比较模型组与对照组相比,LPS、IL-6 和TNF-α 均明显增加,差异均有统计学意义(P<0.01)。鼠李糖乳杆菌组、姜黄素组及鼠李糖乳杆菌联合姜黄素组与模型组相比,LPS、IL-6 和TNF-α 均不同程度降低,差异均有统计学意义(P<0.01)。提示鼠李糖乳杆菌、姜黄素均可降低MAFLD 大鼠炎性因子水平。见表4。

表4 大鼠LPS、IG-6 和TNF-α 水平Tab.4 Levels of the LPS,IL-6 and TNF-α in rat serue x±s
2.6 肝组织TLR4、NF-κB 和MyD88 基因的表达比较MCD 组大鼠与MCS 组相比,肝组织TLR4、NF-κB 和MyD88 基因的相对表达均明显增加,差异有统计学意义(P<0.01);各干预组与MCD 组相比,TLR4、NF-κB 和MyD88 基因的相对表达的表达均不同程度降低,联合组降低最明显,差异均有统计学意义(P<0.01);提示鼠李糖乳杆菌、姜黄素均可降低MAFLD 大鼠肝组织TLR4、NF-κB 和MyD88 基因表达水平,且两者联合应用效果更佳。见表5。
表5 大鼠肝组织MyD88、NF-κB 和TLR4 的相对表达量Tab.5 The relative expression of MyD88、NF-κB and TLR4 genes in rat liver tissue ±s

表5 大鼠肝组织MyD88、NF-κB 和TLR4 的相对表达量Tab.5 The relative expression of MyD88、NF-κB and TLR4 genes in rat liver tissue ±s
注:MCD 与MCS 组比较,*P<0.01;干预组与MCD 组比较,#P<0.01;与CUR+LGG 组比较,▲P<0.01
组别MCS MCD CUR LGG CUR+LGG MyD88 mRNA 0.92±0.12 3.41±0.23*2.38±0.12#▲2.38±0.13#▲1.57±0.14#NF-κB mRNA 1.05±0.07 3.17±0.10*2.19±0.09#▲2.20±0.09#▲1.81±0.06#TLR4 mRNA 1.06±0.09 3.38±0.16*2.37±0.15#▲2.40±0.15#▲1.79±0.10#
2.7 肝组织TLR4、NF-κB 和MyD88 蛋白的表达比较MCD 组大鼠与MCS 组相比,肝组织TLR4、NF-κB 和MyD88 蛋白的相对表达均明显增加,差异有统计学意义(P<0.01);各干预组与MCD 组相比,TLR4、NF-κB 和MyD88 蛋白的相对表达的表达均不同程度降低,联合组降低最明显,差异均有统计学意义(P<0.01);提示鼠李糖乳杆菌、姜黄素均可降低MAFLD 大鼠肝组织TLR4、NF-κB 和MyD88 蛋白表达水平,且两者联合应用效果更佳。见表6、图2。
表6 大鼠肝组织TLR4、NF-κB 和MyD88 的表达量Tab.6 The different expression of MyD88,NF-κB and TLR4 liver tissue ±s

表6 大鼠肝组织TLR4、NF-κB 和MyD88 的表达量Tab.6 The different expression of MyD88,NF-κB and TLR4 liver tissue ±s
注:MCD 组与MCS 组比较,*P<0.01;干预组与MCD 组比较,#P<0.01,与CUR+LGG 组比较,▲P<0.01
组别MCS MCD CUR LGG CUR+LGG MyD88 蛋白0.93±0.09 3.24±0.19*2.64±0.19#▲2.67±0.11#▲1.56±0.18#NF-κBp65 蛋白1.04±0.28 3.05±0.19*2.49±0.17#▲2.48±0.23#▲1.53±0.07#TLR4 蛋白0.82±0.05 2.66±0.09*2.06±0.04#▲1.96±0.09#▲1.37±0.10#
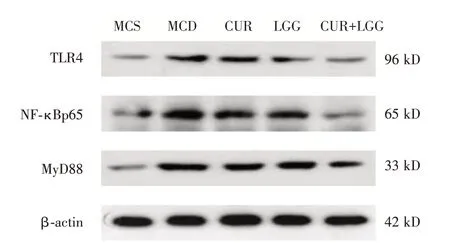
图2 大鼠肝组织TLR4、NF-κB 和MyD88 蛋白的表达Fig.2 The different expression of TLR4、NF-κB p65 and MyD88 in liver tissue
3 讨论
TLR 是免疫系统中发现最早的模式识别受体(PRR),在固有免疫应答中识别病原微生物的病原相关的分子模式(pathogen-associated molecular patterns,PAMP),激活先天性免疫应答,还引起细胞因子的释放[9]。TLR 广泛分布于肝细胞、库普弗细胞、肝星状细胞、肝窦内皮细胞和胆管内皮细胞,其表达与PAMP的刺激有关[10]。常见的与代谢相关性脂肪性肝病有关的TLR 包括TLR2、TLR4、TLR5、TLR9,它们的配体分别是肽聚糖、脂多糖、鞭毛蛋白和细菌DNA[11-13]。TLR 介导的信号主要通过两种途径转导,即“蛋白髓样分化因子(MyD88)依赖性途径”和“MyD88 非依赖性途径”[14]。脂多糖(LPS)是革兰氏阴性杆菌细胞壁外层的主要成分,也称内毒素,是肝损伤中的一个重要因子,它能激发机体引起强烈的炎症反应[15]。TLR4 是LPS的模式识别受体,表达于各种肝脏细胞中,通过MyD88 依赖途径与LPS 结合并激活核因子-κB(NF-κB)通路,它的激活导致许多促炎、抗病毒,抗菌因子的产生[7]。实验[16]发现,TLR4 基因缺陷和肝脏库普弗细胞失活都能够使高脂肪饮食诱导的NAFLD 模型小鼠肝脏功能障碍减轻,表明肝脏库普弗细胞上TLR4 的表达是NAFLD 疾病进程的重要因素。TLR 信号在健康肝脏中被抑制,但是当病原微生物和细菌来源的分子被输送到肝脏时被激活,产生抗菌和抗病毒细胞因子,如TNF-α、IL-β和干扰素[17],这些细胞因子持续升高会损伤肝细胞。研究[18]证明在有NASH 的小鼠中,LPS 血清水平与对照小鼠相比有所增加,并且与核因子激活相关,使用TLR4 抑制剂治疗导致患有NASH 的小鼠肝炎症降低。所以,通过对TLR4 转导途径的合理干预,能够对MAFLD产生改善作用。
益生菌可以调节肠道菌群,增加肠道有益细菌,减少有害细菌[19]。乳酸杆菌GG(LGG)是益生菌常用的菌株[20],因为这些细菌可以通过产生乳酸和其他抗菌物质来抑制革兰氏阴性致病菌的扩张[21]。LGG 已被证明可以激活转录因子NF-κB,它是先天免疫反应的中心激活剂之一[22]。补充益生菌有望逆转肠道微生物群的表型,从而改善健康状况[23]。姜黄素(Curcumin)是从姜黄(Curcuma longa)根茎中分离出来的一种天然多酚类化合物[24]。它有许多生物活性,包括抗氧化、抗病毒、抗炎和抗菌[25]。实验[26]证明,姜黄素通过各种细胞信号通路对氧化应激相关肝病表现出预防和治疗作用。
本实验采用蛋氨酸胆碱缺乏饮食建造MAFLD大鼠模型,以姜黄素及鼠李糖乳杆菌进行干预,通过观察姜黄素、鼠李糖乳杆菌及两者联合对MAFLD大鼠的治疗效果,检测大鼠血清LPS、TNF-α、IL-6 及肝组织TLR4、NF-κBp65、MyD88 表达量,来探讨潜在作用机制。蛋氨酸胆碱缺乏饮食促进MAFLD发生发展的主要机制为:一为极低密度脂蛋白(VLDL)合成减少和向外周分泌的减少,二为蛋氨酸与胆碱缺乏使抗氧化剂合成减少[14]。在本研究中,经姜黄素及鼠李糖乳杆菌干预后,大鼠肝细胞脂肪变均有减轻,各干预组肝细胞结构排列更加整齐,脂滴减少,肝指数下降,血清转氨酶及炎性因子水平降低,肝甘油三酯及肝组织TLR4、NFκBp65、MyD88 的表达下调。上述结果表明,鼠李糖乳杆菌及姜黄素可减轻MAFLD 大鼠肝损伤及脂质沉积,可能与调节TLR4 信号通路,降低TLR4通路下游的炎性因子的表达有关,有望为MAFLD临床治疗提供一种新的治疗选择。

