血必净注射液联合低分子肝素对老年急性呼吸窘迫综合征正五聚蛋白3、乙酰肝素酶水平的影响
梁文美 付豹 赵晓宇 苏德 代大华 宫敏敏 傅小云
遵义医科大学附属医院重症医学科(贵州遵义 563000)
急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)为多种致病因素导致的机体内炎症反应失控,在临床危重症中较为常见,且多发于老年患者,该病发病较为急骤,且发展迅速,发病死亡率高达68.5%[1]。临床研究显示[2-3],老年ARDS 的发病影响因素主要为肺炎、全身感染、中毒等。对于ARDS 的治疗主要采用呼吸支持与抗感染治疗,但由于该病发病较急,常规治疗效果不理想,故寻找有效的治疗方式对于该病的治疗较为重要。血必净注射液具有活血化瘀、消除内毒素、疏通脉络的作用,可保护患者内皮细胞、对患者凝血功能进行改善,临床治疗效果较好[4]。低分子肝素为临床常用抗凝、抗栓药物,可改善ARDS高凝状态及抑制炎症因子释放,使病死率降低[5]。基于此,在本文研究中,分析血必净注射液、低分子肝素联合使用对老年ARDS 患者PTX3、HPSE 的影响,可为临床上该病的治疗提供参考。
1 对象与方法
1.1 研究对象纳入标准:收集2019年1月至2021年12月在我院收治的100例老年ARDS患者进行前瞻性研究,纳入标准:患者符合《急性肺损伤/急性呼吸窘迫综合征诊断和治疗指南(2006)》[6]中诊断标准(ARDS 严重程度分级:轻度(200 mmHg<PaO2/FiO2≤300 mmHg),中度(100 mmHg<PaO2/FiO2≤200 mmHg),重度(PaO2/FiO2≤100 mmHg)),所有患者均为60岁以上老年群体,患者经X胸腺检查发现双肺处斑片状阴影,氧合指数≤200 mmHg。排除标准:患者心功能存在异常,基础免疫系统缺陷,存在肾上腺疾病,对本次研究所用药物过敏。随机将患者分为对照组50例,研究组患者50例,对照组男28 例,女22 例,年龄63~79 岁,平均(70.14 ±5.45)岁,研究组男25例,女25例,年龄64~79岁,平均(70.60 ± 3.99)岁,两组患者一般资料均衡可比(P>0.05),见表1,本研究患者及家属均知晓本研究并签署相关知情同意书,且经我院伦理委员会审核批准(伦理审查批件号:KLL-2021-001)。
1.2 治疗方法两组患者就诊后均采用常规综合治疗,对其进行抗感染、液体复苏、呼吸循环支持、肺通气保护等治疗。对照组患者低分子肝素(吉林华康药业股份有限公司,国药准字H20010233,0.5 mL:2 500 IU)结合治疗,将4 100 IU 低分子肝素对患者皮下注射,2 次/d。研究组患者采用低分子肝素、血必净注射液(天津红日药业股份有限公司,国药准字Z20040033,10 mL/支)结合治疗,将5 支血必净注射液加入100 mL 0.9%氯化钠注射液中,对其进行注射,2 次/d,两组患者均治疗7 d。
1.3 观察指标样本采集:收集两组患者治疗前、后清晨空腹静脉血4~8 mL,以离心半径15 cm,转速3 000 r/min 离心处理10 min,提取上层清液,-80 ℃保存待检。(1)血气指标检测:采用血气分析仪(雅培公司,美国)检测患者治疗前后PaO2、PCO2、PaO2/FiO2表达水平。(2)凝血指标检测:采用全自动凝血分析仪检测患者治疗前后PT、APTT、FBI、PLT表达水平。(3)炎症因子、PTX3、HPSE 水平检测:采用酶联免疫法检测TNF-α、IL-6、IL-10、PTX3、HPSE 表达水平。(4)临床指标检测:采用APACHEⅡ量表评价患者病情,其病情越严重评分越高,统计两组患者住院时间与机械通气时间,并对两组患者住院时间及机械通气时间进行对比。(5)疗效评价:对患者治疗效果进行评价,显效:患者症状评分恢复,体征正常。有效:症状评分改善,体征稳定。无效:临床体征难以维持,病情恶化其中APACHE Ⅱ评分共包含生理学指标、慢性健康状况及年龄3 个维度,总分为71 分,分值越高表示病情越严重,>20 就属于危重患者。
1.4 统计学方法采用SPSS 25.0分析。计量资料采用均数±标准差描述,组间比较采用独立样本t检验,组内比较采用配对t检验,计数资料采用例(%)表示,组间比较采用χ2检验,P<0.05为有统计学意义。
2 结果
2.1 两组患者治疗前后血气指标对比如表2所示,治疗前两组患者血气指标对比,差异无统计学意义(P>0.05),治疗后两组患者PaO2、PCO2、PaO2/FiO2水平升高,且研究组升高幅度较大,差异具有统计学意义(P<0.05)。
表2 两组患者治疗前后血气指标对比Tab.2 Comparison of blood gas indexes in the two groups before and after treatment ±s

表2 两组患者治疗前后血气指标对比Tab.2 Comparison of blood gas indexes in the two groups before and after treatment ±s
组别对照组研究组t 值P 值例数50 50 PaO2(mmHg)治疗前45.24±5.37 44.98±5.31 0.243 0.808治疗后112.64±25.45 135.96±28.93 4.280 0.001 t/P 值18.320/0.001 21.870/0.001 PCO2(mmHg)治疗前33.12±4.26 33.04±4.42 0.092 0.927治疗后42.58±5.42 59.66±6.38 12.144 0.001 t/P 值9.703/0.001 24.250/0.001 PaO2/FiO2(mmHg)治疗前113.58±26.64 112.74±25.85 0.160 0.873治疗后234.84±36.47 263.86±39.88 3.797 0.001 t/P 值18.990/0.001 22.480/0.001
2.2 两组患者治疗前后凝血指标对比如表3所示,治疗前两组患者凝血指标对比,差异无统计学意义(P>0.05),治疗后两组患者PT、APTT 水平降低,FBI、PLT 水平升高,且研究组变化幅度较大,差异具有统计学意义(P<0.05)。
表3 两组患者治疗前后凝血指标对比Tab.3 Comparison of blood coagulation indexes before and after treatment in the two groups ±s
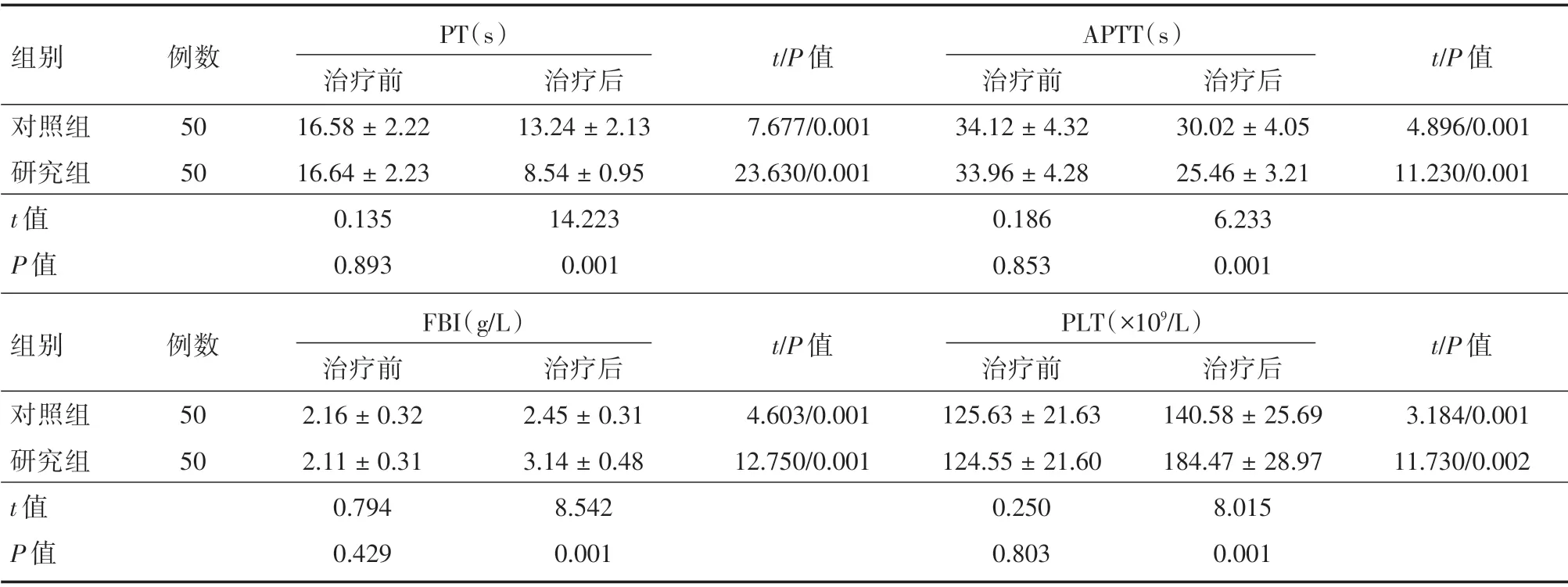
表3 两组患者治疗前后凝血指标对比Tab.3 Comparison of blood coagulation indexes before and after treatment in the two groups ±s
组别对照组研究组t 值P 值例数50 50 PT(s)治疗前16.58±2.22 16.64±2.23 0.135 0.893治疗后13.24±2.13 8.54±0.95 14.223 0.001 t/P 值7.677/0.001 23.630/0.001 APTT(s)治疗前34.12±4.32 33.96±4.28 0.186 0.853治疗后30.02±4.05 25.46±3.21 6.233 0.001 t/P 值4.896/0.001 11.230/0.001组别对照组研究组t 值P 值例数50 50 FBI(g/L)治疗前2.16±0.32 2.11±0.31 0.794 0.429治疗后2.45±0.31 3.14±0.48 8.542 0.001 t/P 值4.603/0.001 12.750/0.001 PLT(×109/L)治疗前125.63±21.63 124.55±21.60 0.250 0.803治疗后140.58±25.69 184.47±28.97 8.015 0.001 t/P 值3.184/0.001 11.730/0.002
2.3 两组患者治疗前后炎症因子水平对比如表4所示,治疗前两组患者炎症因子水平对比,差异无统计学意义(P>0.05),治疗后两组患者TNF-α、IL-6、IL-10水平降低,且研究组降低幅度较大,差异无统计学意义(P<0.05)。
表4 两组患者治疗前后炎症因子水平对比Tab.4 Comparison of inflammatory factor levels before and after treatment in the two groups of patients ±s
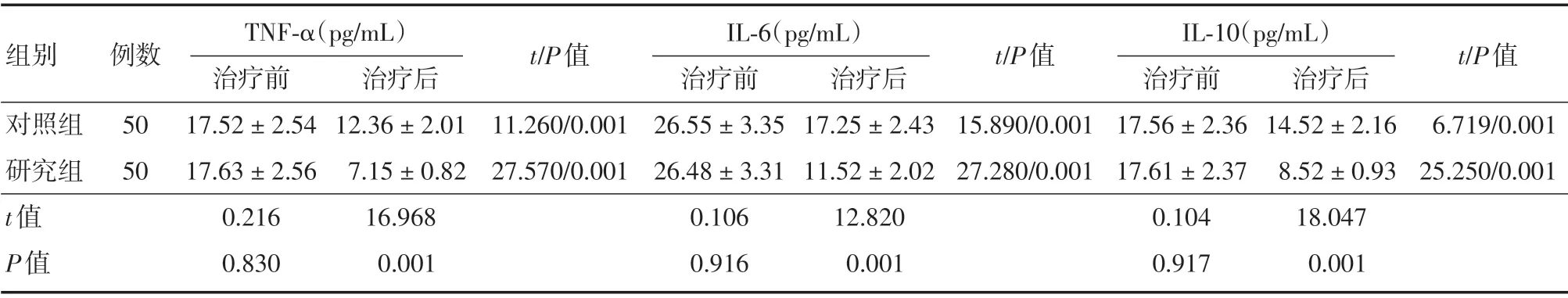
表4 两组患者治疗前后炎症因子水平对比Tab.4 Comparison of inflammatory factor levels before and after treatment in the two groups of patients ±s
组别对照组研究组t值P值例数50 50 TNF-α(pg/mL)治疗前17.52±2.54 17.63±2.56 0.216 0.830治疗后12.36±2.01 7.15±0.82 16.968 0.001 t/P值11.260/0.001 27.570/0.001 IL-6(pg/mL)治疗前26.55±3.35 26.48±3.31 0.106 0.916治疗后17.25±2.43 11.52±2.02 12.820 0.001 t/P值15.890/0.001 27.280/0.001 IL-10(pg/mL)治疗前17.56±2.36 17.61±2.37 0.104 0.917治疗后14.52±2.16 8.52±0.93 18.047 0.001 t/P值6.719/0.001 25.250/0.001
2.4 两组患者治疗前后PTX3、HPSE水平对比如表5所示,治疗前两组患者PTX3、HPSE 对比,差异无统计学意义(P>0.05),治疗后两组患者PTX3、HPSE 水平降低,且研究组降低幅度较大,差异具有统计学意义(P<0.05)。
表5 两组患者治疗前后PTX3、HPSE 水平对比Tab.5 Comparison of PTX3 and HPSE levels before and after treatment in the two groups of patients ±s

表5 两组患者治疗前后PTX3、HPSE 水平对比Tab.5 Comparison of PTX3 and HPSE levels before and after treatment in the two groups of patients ±s
组别对照组研究组t值P值例数50 50 PTX3(ng/mL)治疗前19.53±2.58 19.61±2.60 0.156 0.876治疗后13.56±2.55 9.02±0.92 11.843 0.001 t/P值11.640/0.001 27.150/0.001 HPSE(U/mL)治疗前135.92±14.29 134.54±14.18 0.485 0.629治疗后112.94±12.62 90.54±10.22 9.754 0.001 t/P值8.523/0.001 17.800/0.001
2.5 两组患者临床指标对比如表6所示,研究组患者APACHEⅡ评分、机械通气时间、ICU 住院时间低于对照组,差异具有统计学意义(P<0.05)。
表6 两组患者临床指标对比Tab.6 comparison of clinical indicators between the two groups of patients ±s
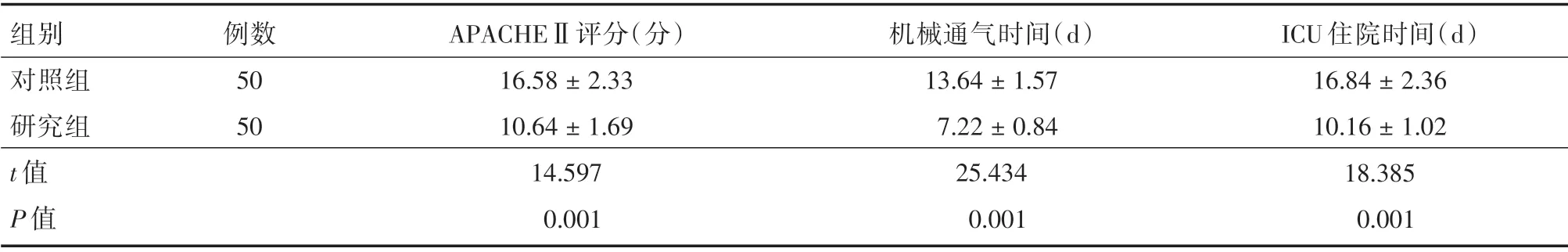
表6 两组患者临床指标对比Tab.6 comparison of clinical indicators between the two groups of patients ±s
组别对照组研究组t 值P 值例数50 50 APACHEⅡ评分(分)16.58±2.33 10.64±1.69 14.597 0.001机械通气时间(d)13.64±1.57 7.22±0.84 25.434 0.001 ICU 住院时间(d)16.84±2.36 10.16±1.02 18.385 0.001
2.6 两组患者临床疗效对比如表7所示,研究组治疗有效率高于对照组,差异具有统计学意义(P<0.05)。
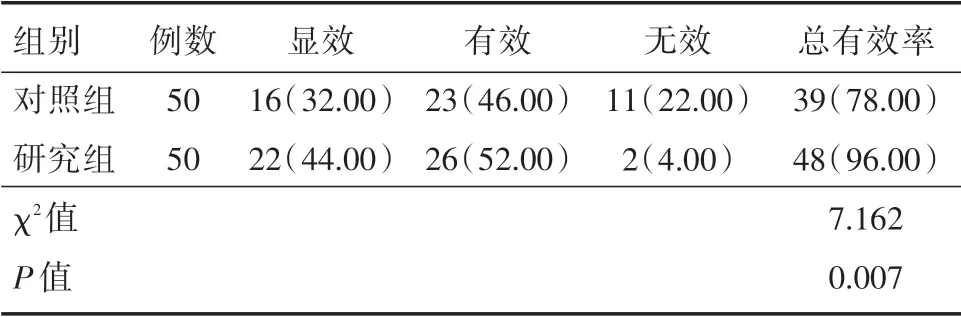
表7 两组患者临床疗效对比Tab.7 Comparison of clinical efficacy between the two groups of patients 例(%)
3 讨论
老年ARDS 临床发病时较为急促,患者发病时易出现心律失常、呼吸急促、胸闷、口唇指端发紫等症状,对患者神经功能与器官功能造成影响,具有较高的发病致死率[7]。研究显示[8-9],老年ARDS的发病因素主要为炎症反应,大量炎症介质的释放,使患者肺水肿加重,导致患者肺氧合功能出现障碍。
血必净注射液主要是由赤芍、川芎、当归、红花与丹参组成,赤芍、红花、丹参可对患者微循环状态进行改善,使患者体内血流量增加,并减少机体内炎症的渗出,降低肺挫伤对机体的损害[10-11]。川芎可对患者体内红细胞变性进行改善,抑制血栓素的合成与释放。低分子肝素为临床抗凝药物,具有较强的抗凝效果,且可使凝血酶与凝血活性因子Xa 的表达受到抑制,可使患者血栓症状得到改善[12]。研究表明[13-14],低分子肝素可抵抗炎症的发生,使机体内炎症因子水平降低,减轻炎症反应,对ARDS 患者临床症状进行改善。本研究显示,采用血必净注射液、低分子肝素治疗可使患者机械通气时间与ICU 住院时间缩短,促进患者的恢复,治疗效果较好。
研究表明[15-16],ARDS 的发生主要原因为患者体内炎性反应失控损伤其肺泡膜与肺毛细血管膜,使患者通气比例失调与肺泡上皮细胞水肿,出现弥散距离增大。本研究显示,采用血必净注射液、低分子肝素结合治疗可改善患者PaO2、PCO2、PaO2/FiO2表达水平,使老年ARDS 患者的呼吸功能得到改善,其原因可能为两者结合使用使患者炎症介质的释放受到抑制,促进了血气功能的改善,加快了患者的恢复。
PT、APTT、FBI、PLT 为机体内凝血功能指标,在老年ARDS 患者体内表达存在异常,表明PT、APTT、FBI、PLT 异常表达于患者体内可促进患者病情的发展[17]。研究显示[18],TNF-α 为ARDS 启动因子,可使白细胞在患者肺部聚集,损伤肺部毛细血管内皮细胞膜造成损伤,使机体内产生炎症介质,并使微血栓的形成加快,TNF-α 可使患者毛细血管通透性增加。TNF-α、IL-6、IL-10 与患者全身炎症反应密切相关,控制其炎症反应与细胞因子的产生可改善老年ARDS 患者临床症状[19]。本研究显示,采用血必净注射液、低分子肝素结合治疗可使患者凝血功能得到改善,并降低患者炎症反应,可用于老年ARDS 的治疗。
PTX3 为正五聚蛋白家族成员,可对疾病的进展进行负向调控,临床研究表明,PTX3 表达水平可对脓毒症患者病情严重程度进行评价,呈正相关的关系[20]。PTX3 可使肺炎球菌诱导的细胞因子表达升高,使患者炎症反应加重,且PTX3 表达升高可对患者IL-10 表达水平进行调节,使老年ARDS 的发展加快,并降低其生存率。HPSE 主要是由上皮细胞产生,可抑制免疫细胞的活化[21-22]。本研究显示,采用血必净注射液、低分子肝素结合治疗可降低患者PTX3、HPSE 表达水平,改善患者病情,促进患者恢复。
综上所述,经血必净注射液、低分子肝素结合治疗后,患者的血气指标与凝血功能得到改善,且两者联合使用使患者PTX3、HPSE 水平降低,促进患者恢复。但因本文纳入样本量较少,在数据统计时可能存在一定的偏移,存在一定的局限性,且未对其具体作用机制进行分析,因此还需后续进一步分析。

