肿瘤突变负荷水平在非小细胞肺癌患者术后接受铂类药物为基础辅助化疗的临床意义
李静 李宝重 郭现利 郭军梅
1解放军总医院第五医学中心肿瘤医学部(北京 100071);2北京世纪坛医院胸外科(北京 100038);3解放军总医院第八医学中心呼吸与危重症二区(北京 100091);4内蒙古医科大学附属人民医院放疗科(呼和浩特 010020)
肺癌是世界范围内最常见的恶性肿瘤。在我国,新发肺癌患者超过80 万[1]。非小细胞肺癌(NSCLC)大约占肺癌总数的85%左右[2]。铂类联合培美曲塞或多西他赛的辅助化疗方案被证实具有良好的安全性从而在辅助化疗中广泛应用[3]。尽管如此,该方案在Ⅱ~Ⅲa 期NSCLC 患者中的5年生存率在50%左右[4]。目前的研究进展提示肿瘤细胞的异质性会影响铂类为基础辅助化疗的预后[5]。
肿瘤突变负荷(TMB)是指蛋白编码区的非同义突变分布的密度,用蛋白编码区的非同义突变位点总数除以蛋白编码区的总长度,单位为突变数/mb[6]。TMB 可能和PD-1 抑制剂的疗效正相关[7]。然而,TMB 水平和接受传统化疗的预后尚不明确,既往国外的研究提示在接受手术切除治疗的NSCLC 患者中较高的TMB 与较好的预后相关[8]。然而,目前国内尚没有在接受手术切除的NSCLC 患者中探讨TMB 水平和接受常规辅助化疗的预后关联的探索研究。因此,有必要探讨TMB在术后接受铂类为基础辅助化疗的NSCLC 患者中的临床意义。
1 资料与方法
1.1 研究设计及入排标准研究从2011年1月到2021年10月在北京世纪坛医院胸外科连续性地纳入NSCLC 患者。纳入标准:(1)年龄>18 岁;(2)体质状况评分在0~2 分;(3)临床诊断为NSCLC 且接受了手术切除治疗;(4)具备接受辅助化疗的血液学基础(中性粒细胞计数≥1.5 × 109/L,血小板计数≥75 × 109/L);(5)患者术后接受了铂类药物为基础的辅助化疗。排除标准:(1)无合适的肿瘤组织标本进行TMB 检测的患者;(2)合并其他的恶性肿瘤或者威胁生命的严重疾病的患者;(3)未接受铂类药物为基础辅助化疗的患者。符合研究入排标准的为78 例NSCLC 患者。随访截止时间为2021年5月。
1.2 治疗方案第1 天顺铂75 mg/m2或者卡铂AUC5,联合培美曲塞500 mg/m2或多西他赛60~75 mg/m2或长春瑞滨25~30 mg/m2,每21 天为一个治疗周期,辅助化疗计划给予4 个周期。本研究得到医院伦理委员会的批准。每位入组研究的患者均签署知情同意书。
1.3 术后组织样本收集及TMB检测本研究中在NSCLC 患者接受手术切除治疗期间收集患者的术后癌组织标本,液氮中保存组织样本。DNA 提取,靶向基因测序分析均参考既往研究中的方法[9]。利用燃石公司的二代测序技术的基因测序平台,精选520 个与NSCLC 机理及靶向治疗密切相关的基因进行测序分析。TMB 的分析也是参考既往研究中的方法[9]。本研究中考虑到TMB 在NSCLC患者中相对较低,所以以中位TMB值将78例患者分为高TMB(TMB-H)和低TMB(TMB-L)组。
1.4 统计学方法本研究采用SPSS 25.0 进行统计分析。基线临床资料分析中,计数资料和TMB水平的关联分析采用卡方检验,当数据较少时用Fisher 精确检验。计量资料和TMB 水平的分析采用非参U检验。利用生存分析比较不同TMB 水平患者的DFS 和OS 的差异。无疾病生存期(DFS)和总生存期(OS)定义参考既往研究[5]。研究对OS构建Cox 多变量分析。P<0.05 为差异有统计学意义。
2 结果
2.1 临床资料及TMB 结果本回顾性研究纳入的78 例NSCLC 的患者均为临床常见的接受术后辅助化疗的NSCLC 患者。TMB 分析结果中的中位TMB为4.3/Mb(范围:1.5~45.2/Mb)。本研究以中位TMB 值为阈值将患者分为TMB-L 组(≤4.3/Mb)和TMB-H 组(>4.3/Mb),两组患者分别为40 例(51.3%)和38 例(48.7%)。在进行后续分析之前,本研究先分析了不同TMB 状态患者的基线临床资料,TMB-L 和TMB-H 患者在基线临床资料方面基本均衡,差异均无统计学意义(P>0.05)。
2.2 体细胞基因突变结果TMB分析在NGS测序平台上,选择520 个和癌症机理密切相关的基因。体细胞突变结果提示78 例非鳞NSCLC 患者中最常见的突变基因为TP53、EGFR、LRP1B、DNMT3A和FAT3,突变频率分别为56.4%、48.7%、37.2%、30.7%和25.6%。相对不常见的KRAS、SPTA1、KEAP1 和NF1 基因突变频率分别为24.4%、21.8%、16.7%和11.5%。此外,还有其他的基因比如RBM10和PIK3CA 基因,突变频率均低于10%。
2.3 TMB 水平的临床意义所有入组的患者从纳入研究到最后一次随访的中位随访时间为4.8年(随访范围:0.25~8年)。研究的78 例非鳞NSCLC 患者的预后结果见图1,纳入研究的78 例患者的中位DFS 为3.6年(95%CI:2.63~4.57),中位OS为5.3年(95%CI:4.37~6.23)。
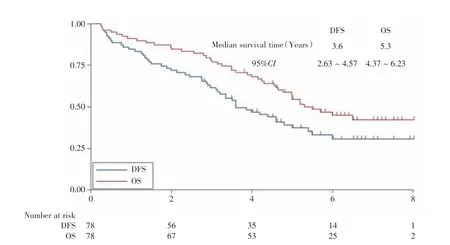
图1 78 例非鳞NSCLC 患者的无疾病生存期和总生存期的生存曲线Fig.1 DFS and OS of the 78 patients with non-squamous NSCLC
本研究中TMB-L 和TMB-H 的患者分别为40例和38 例。针对不同TMB 水平的患者进行了预后分析。TMB-L 和TMB-H 患者的中位DFS 分别为4.4 个月(95%CI:2.61~6.19)和3.1 个月(95%CI:2.24~3.98),差异无统计学意义(χ2=1.94,P=0.163)。见图2。
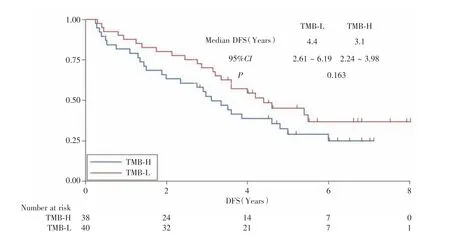
图2 78 例非鳞NSCLC 患者中根据TMB 水平的无疾病生存期对比Fig.2 DFS of the 78 patients with non-squamous NSCLC according to TMB status
此外,OS 分析结果如图3所示,TMB-L 和TMBH 患者的中位OS 分别为NR(未达到)(95%CI:NA)和4.6 个月(95%CI:3.44~5.66),差异有统计学意义(χ2=6.04,P=0.014)。为了进一步校正其他混杂因素的影响,构建Cox 多变量分析。年龄、ECOG 评分、病理学分期及TMB 状态对OS 具有显著的影响。因此,多因素分析中将这些因素纳入多变量Cox分析,经过多变量校正TMB状态对OS仍然具有独立的影响意义(HR=0.74,P=0.025)。此外,其他的对OS 具有独立影响意义的变量为年龄(HR=0.73,P=0.019)、ECOG 评分(HR=0.71,P=0.015)和病理学分期(HR=0.64,P=0.009)。见表1。

表1 78 例非鳞NSCLC 患者中针对OS 的单变量和多变量分析Tab.1 OS of the 78 patients with non-squamous NSCLC in univariate analysis and multivariate analysis
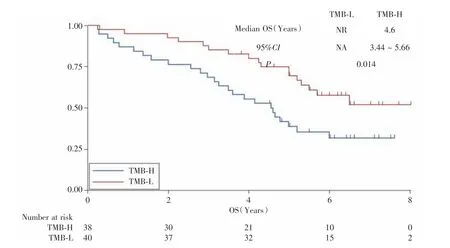
图3 78 例非鳞NSCLC 患者中根据TMB 水平的总生存期对比Fig.3 OS of the 78 patients with non-squamous NSCLC according to TMB status
3 讨论
本研究利用NGS 平台分析的TMB 水平和接受铂类药物为基础辅助化疗的NSCLC 患者的预后做关联分析,结果提示较高的TMB 水平对术后接受铂类药物为基础辅助化疗的非鳞NSCLC 患者的OS 具有较差的影响。研究结果对术后接受铂类药物辅助化疗的NSCLC 患者的预后评估具有指导意义。
本研究中的预后数据提示中位DFS 为3.6年,中位OS 为5.3年。本研究DFS 的结果低于国际肺癌辅助试验协作组开展的可切除NSCLC 患者接受顺铂为基础辅助化疗的Ⅲ期研究中的中位DFS(3.8年)[10]。可能的原因是两个研究的纳入患者人群有较大差异:Ⅲ期研究中还纳入了35%的Ⅰ期的患者,而且Ⅲ期未纳入ECOG 评分2 分的患者。然而,本研究的OS 结果略优于Ⅲ期研究的结果(中位OS:5.3年vs.4.3年)。可能是近年来有较多的免疫药物靶向药物陆续获批,复发的患者在后续治疗中还可以接受这些显著延长患者生存期的治疗方案[11]。另一方面,本研究中的年龄,ECOG 评分,病理分期对OS 的影响具有统计学差异和既往的研究结果基本一致[12-13]。
本研究中的TMB 状态分析是基于目前应用广泛的NGS 技术。众所周知,NSCLC 的异质性较强,NGS 技术可以较为精确地检测出导致NSCLC 发生发展的突变基因[14]。本研究中TP53 基因的突变频率达到56.4%,这和既往GS团队开展的在NSCLC患者中分析TMB 情况基本一致[15]。GS 团队的研究中突变频率最高的也是TP53 基因,频率达到53%。TP53基因在体内发挥调节DNA修复,细胞周期和细胞凋亡的作用[16]。此外,研究中的EGFR,LRP1B,DNMT3A,FAT3,KRAS 和SPTA1,突变频率分别为48.7%,37.2%,30.7%,25.6%,24.4%和21.8%。这和先前GS团队的研究结果基本一致[16]。另外,本研究也发现KEAP1 和NF1 基因在NSCLC患者中有16.7%和11.5%的突变频率,这也提示部分罕见的基因突变同样也会导致NSCLC 的发生[17]。
TMB 结果提示78 例患者的总体体细胞突变负荷相对较低,中位突变为4.3/Mb(范围:1.5~45.2/Mb),低于既往SD 团队的结果(中位TMB 为5.7/Mb)[8]。可能是因为本研究只是检测了520 个和癌症发生发展相关的基因,而SD 的研究检测了1 538 个基因,这在一定程度上会造成TMB 检测结果的差异。既往的探索性研究分析了多种肿瘤中的TMB 情况,结果提示黑色素瘤和肺癌患者中的中位TMB(10/Mb 左右),而非鳞NSCLC 中的中位TMB 在7/Mb 左右,这和本研究中TMB 的结果基本一致[18],另一方面,对于TMB-H 和TMB-L 的划分目前尚没有统一标准。预后分析结果提示TMB-H 的患者OS 相对较差,研究结果和既往学者的分析基本一致。他们的研究纳入了425 例接受多西他赛单药治疗的晚期NSCLC 患者,用NGS 测序的方法分析了血液样本中的TMB 水平和患者预后的关联。结果表明血液样本中较低的TMB 水平和患者较好的预后显著相关[19]。此外,最近LBX 团队在软组织肉瘤研究中的结果也表明了TMB 较低的STS 患者伴随了较好的预后,该结论和本研究结果基本一致[20]。在早期和晚期的NSCLC 患者中,也有一部分研究的结果表明TMB 较高的患者在接受传统化疗时具有相对较好的预后[8,15,21]。总之,本研究结果初步表明TMB 较高的NSCLC 患者伴随了较差的预后。未来在接受辅助化疗的NSCLC 患者中尚需要开展大样本前瞻性研究进一步探讨高TMB 的患者能否从铂类为基础辅助化疗中获益。
本研究尚存在一定的不足,一方面是研究样本量有限,研究结论尚需要大样本研究进一步验证。另一方面,本研究的TMB 突变只是局限在和肿瘤发生发展相关的520 个基因进行的初步分析,未来尚需要在更多的基因中进行更加全面的评估。本研究相对充分地评估了TMB 的临床意义,对术后接受铂类药物为基础辅助化疗的非鳞NSCLC 患者的预后评估具有一定的临床指导意义。

