术前老年营养预后指数对肺癌根治术后生存的预测价值研究
雷娇洁,史金凤,朱以芳,刘悦,梁骁
1.空军军医大学第二附属医院胸腔外科,陕西西安 710038;2.空军军医大学第二附属医院肿瘤科。陕西西安 710038
流行病学调查显示,肺癌已成为我国成年人群极为常见的呼吸道恶性肿瘤。外科手术治疗是肺癌的一线治疗手段,不仅有助于改善患者的临床症状,而且已被证实可以延长患者的总生存期[1]。患者年龄、肿瘤的TNM 分期以及患者的体能状态等因素被证实对肺癌患者生存期具有预测能力[2]。近年来的研究表明,患者的营养状态对患者的总生存期亦有显著影响[3]。一包含12 项研究的荟萃分析结果表明,营养不良的肺癌患者总生存期缩短、无进展生存期短且生活质量下降[4]。故而,患者的营养状态测定可能有助于肺癌患者总生存期的评估。老年营养预后指数(Geri⁃atric nutritional risk index,GNRI)是用来评估外科患者术前的营养状况、手术风险以及术后并发症的指标。近年来研究表明,GNRI 可作为评估食管癌、结直肠癌等恶性肿瘤预后的新指标[5]。本研究拟明确术前GNRI 在肺癌根治术患者预后评估中的意义,为其潜在临床转化和应用提供理论基础。
1 资料与方法
1.1 一般资料
回顾性纳入2015年1月—2016年12月在空军军医大学第二附属医院就诊并行手术治疗的153 例老年肺癌患者为研究对象。153 例患者年龄60 ~86 岁,平均(70.8±5.6)岁,其中男性99 例,女性54 例。GNRI >98 组共99 例,年龄60 ~86 岁,平均(70.2 ±5.7)岁,其中男性62 例,女性37 例。GNRI≤98 组共54 例,年龄60~84 岁,平均(72.1 ±5.1)岁,其中男性37 例,女性17 例。纳入标准: (1)患者年龄≥60 岁; (2)肺癌诊断经病理学证实; (3)肺癌为非小细胞肺癌,且行胸腔镜下或开放式肺癌根治术。排除标准: (1)非小细胞肺癌,未行手术治疗; (2)术前行辅助性化疗或放疗;(3)合并严重的肝肾功能不全或其他恶性肿瘤; (4)临床、实验室或随访数据缺失,无法分析者。
1.2 研究方法
纳入的所有患者均由同组医师行肺癌根治术。通过电子病历系统收集患者的临床、实验室和影像学检查资料,包括年龄、性别、体质量指数(BMI)、吸烟史(Brinkman指数)、饮酒史、合并症(高血压、糖尿病、脑梗死、冠心病)、第一秒用力呼气容积/用力肺活量(FEV1/FVC)、血清癌胚抗原(CEA)、白蛋白、 TNM 分期、病理类型(腺癌vs非腺癌)、分化程度(高分化vs中低分化)、手术方式、术中资料(手术时间、有无输血、术中出血量)、术后并发症以及术后是否进行辅助治疗(包括化疗、放疗、靶向治疗和免疫治疗)。术后并发症的严重程度使用Clavien⁃Dindo 外科手术并发症分级系统进行评估[6]。
对所有患者进行随访,随访终点为全因死亡(all⁃cause mortality),总生存期即为肺癌确诊至全因死亡的日期。若患者失访或至随访截止日期(2022年1月)仍未出现终点,则以末次随访时间记为删失数据。
GNRI 通过下列公式进行计算GNRI =1.489 ×白蛋白(g/L)+41.7 ×(目前体重/理想体重)。男性理想体重=身高(cm)-100 -[(身高(cm)-150)/4];女性理想体重=身高(cm)-100 - [(身高(cm)-150)/2.5]。若目前体重>理想体重,则目前体重/理想体重取1;若目前体重<理想体重则按照实际比值进行计算。一般认为GNRI >98 表明患者营养状态良好,而GNRI <98 反应营养状态不良[7]。
1.3 统计学分析
使用SPSS 25.0 中文版软件进行数据统计和分析。符合正态分布的连续变量以均数± 标准差(±s)表示,组间以独立样本t检验进行比较。计数资料以例和百分率表示,组间以卡方(χ2)检验进行比较。使用Kaplan⁃Meier 曲线明确患者累计生存率与随访时间之间的关系,2 组间采用log⁃rank 检验进行比较。采用单因素和多因素Cox 比例风险回归模型明确影响患者总生存期的危险因素。
2 结果
2.1 不同GNRI 组患者临床、实验室和病理特征比较
所纳入的153 例患者中有54 例(35.29%)GNRI≤98。同GNRI >98 组患者相比,GNRI≤98 组年龄更大、肿瘤TNM 分期Ⅱ期和Ⅲ期比例更高、术后并发症>Ⅱ级比例更高,而体重指数和中位随访时间更短(均P<0.05)。见表1。
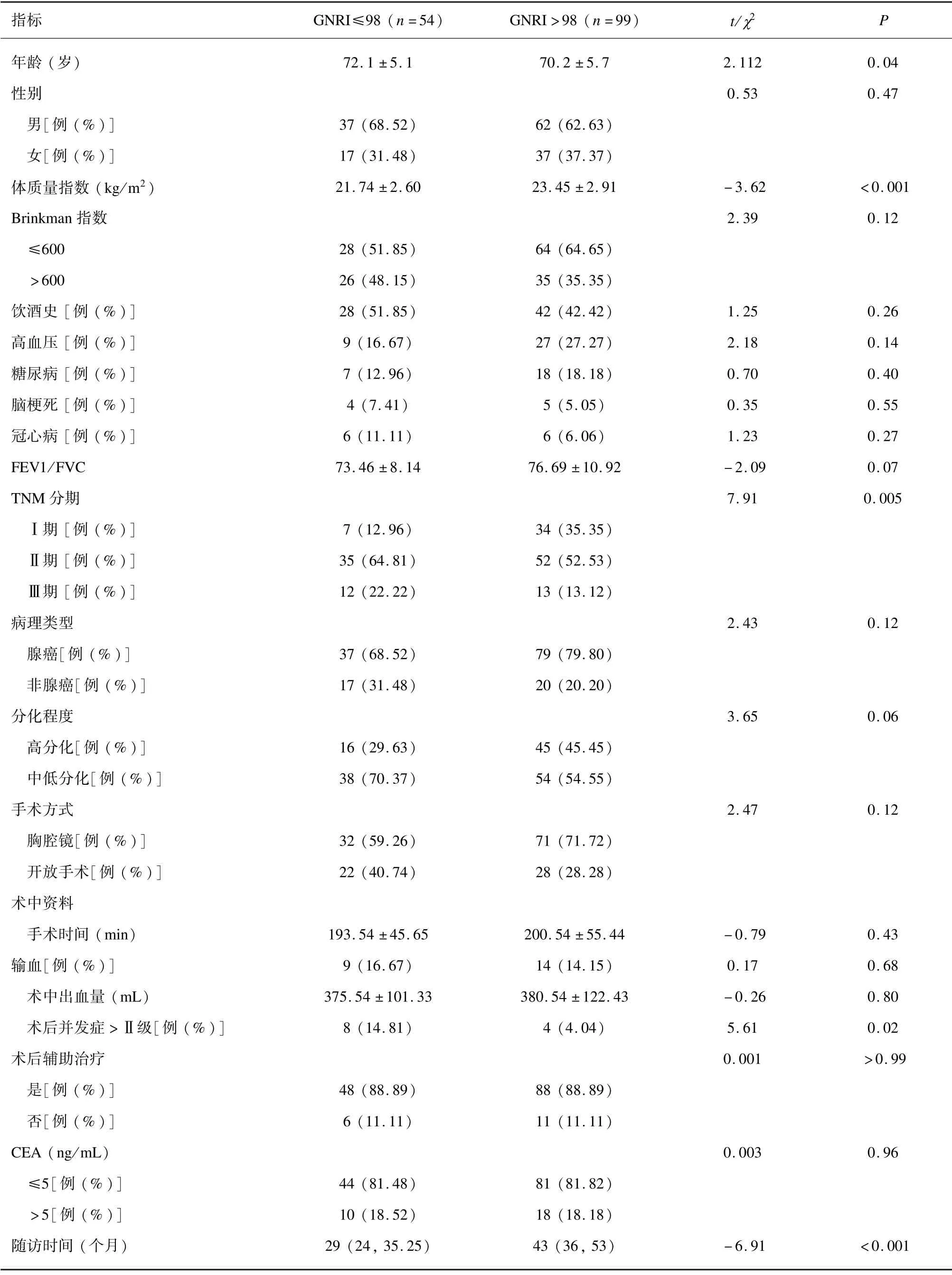
表1 不同老年预后营养指数(GNRI)患者临床、实验室和病理特征比较
2.2 不同GNRI 组患者生存率比较
GNRI≤98 组和GNRI >98 组分别有41 例(75.93%)和80 例(80.81%)患者达到随访终点。Kaplan⁃Meier曲线(图1)显示,GNRI≤98 组患者的中位生存期低于GNRI >98 组(32 个月vs47 个月,P<0.001)。
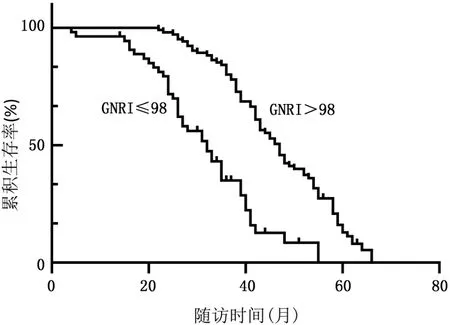
图1 不同GNRI 水平患者的Kaplan⁃Meier 生存曲线
2.3 影响患者总生存期的单因素分析
单因素分析表明,GNRI≤98、年龄>70 岁、 TNM分期高、分化程度为中低分化以及术后并发症>Ⅱ级是影响患者总生存期的危险因素。见表2。
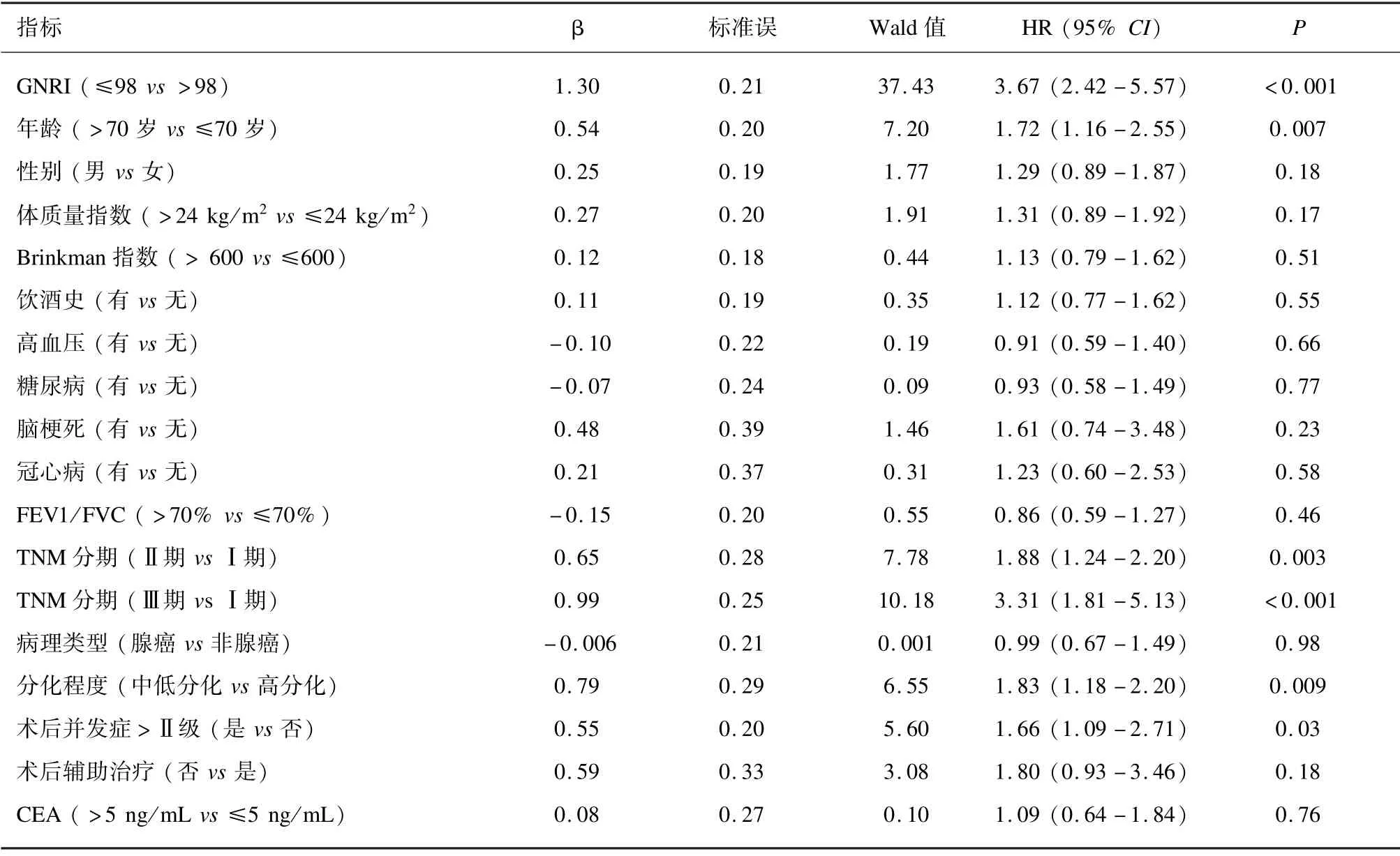
表2 影响老年肺癌根治术患者总生存期的单因素分析结果
2.4 影响患者总生存期的多因素分析
多因素Cox 回归分析结果提示,GNRI ≤98(HR =3.79)、年龄>70 岁(HR =2.05)、 TNM 分期高、分化程度为中低分化(HR =1.70)是影响患者总生存期的独立危险因素。见表3。
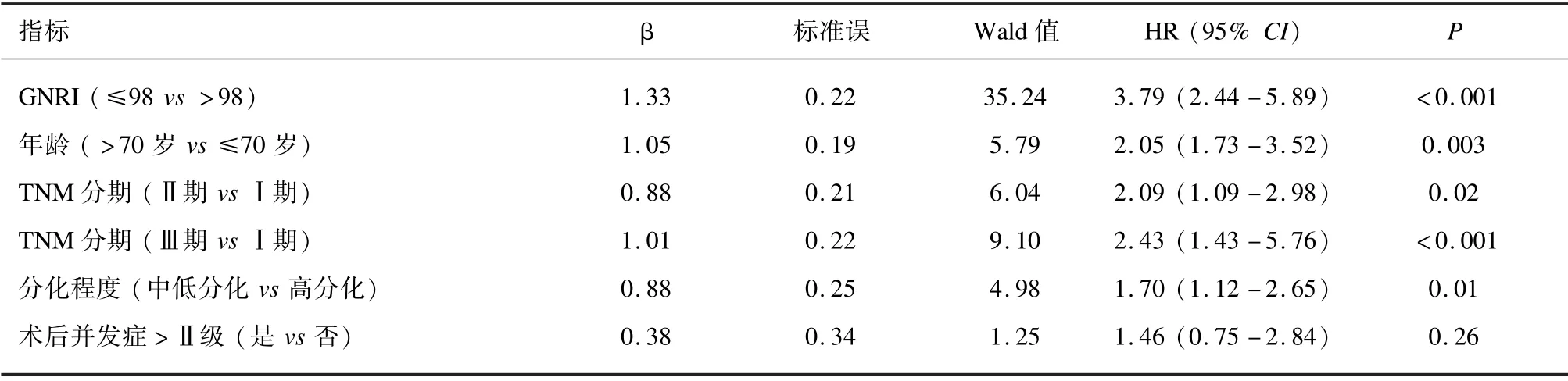
表3 影响患者总生存期的多因素Cox 回归分析结果
3 讨论
GNRI 由法国学者Bouillanne 等于2005年首次提出,用于预测老年内科住院患者并发症发生率和死亡率[7]。随后研究表明,GNRI 对多种恶性肿瘤、终末期肾病[8]以及冠状动脉粥样硬化性心脏病[9]患者的短期和长期预后均有一定的预测价值。本研究结果表明,术前营养状态较差的患者其总生存期缩短,提示术前进行营养干预可能对提高此类患者的预后具有一定的帮助。
营养状态是受多种因素影响的、机体摄入、吸收和利用营养物质的动态平衡过程。肿瘤患者常处于高分解代谢状态,普遍存在营养不良的状态。越来越多的研究发现,营养状态不良能够增加患者的术后病发率、延长住院周期、缩短总生存期以及降低生活质量等[10]。尽管这其中的机制较为复杂,部分尚未完全明了,但近些年的研究说明营养不良可能通过影响患者的免疫细胞功能及状态继而招致一系列不良后果[11]。
在本研究中,GNRI≤98 组患者年龄更大,肿瘤分期更高,反应出随着年龄的增加和肿瘤的进展,患者的营养状态可能逐步恶化,可能与患者进食量减少、肿瘤消耗以及全身恶液质有关。Hayama 团队[12]发现行结直肠癌根治术患者年龄和TNM 分期越高,其GNRI 越低,与本研究结果一致。此外,营养状态较差的患者其发生术后严重并发症的风险亦升高,这可能与营养状态不良的患者组织粘连和水肿明显,术中操作难度大等因素有关。与本研究结果类似,国内外的研究均表明GNRI 对肝癌、胰头癌等恶性肿瘤术后并发症均具有一定的预测作用[13⁃14]。
GNRI 主要指标包括血清白蛋白以及体重变化情况,因而GNRI 的变化主要受这两个因素的影响。目前已有大量的研究表明,血清白蛋白水平可作为肺癌患者内科治疗或外科手术后预后的独立危险因素[15]。在肺癌领域,Karayama 团队证实GNRI 与纳武利尤单抗治疗的非小细胞肺癌患者的总生存期和无进展生存期有关[16]; Sonehara 等[17]研究表明,GNRI≥89.5 的免疫治疗肺癌患者无进展生存期和总生存期要长于GNRI <89.5 的患者。Hinno 等[18]对739 例大样本肺癌根治术患者的研究也发现以GNRI =98 为切割值的2 组患者其总生存期存在显著差异,尤其是在老年人群。
综上所述,本研究表明GNRI≤98 组患者的中位生存期短于GNRI >98 组。GNRI 简便易行,是评估老年肺癌根治术患者总生存期的指标,具有潜在的临床应用价值。鉴于本研究为单中心、回顾性分析,未来尚需开展前瞻性、多中心研究对所得结论加以外部验证和推广。

