灯盏花素通过Nrf2/HO⁃1抑制缺血性脑卒中脑内氧化损伤的作用研究
唐钧,曹红梅,余婷婷,李秀菊
1.上海市金山区亭林医院检验科,上海 201505;2.上海市金山区亭林医院体检中心,上海 201505;3.复旦大学附属金山医院职业病科,上海 201508
随着人口老龄化,脑卒中成为仅次于心脏病的第2致死原因[1],其中老年脑卒中发病率为70%~80%。而缺血性脑卒中又占老年脑卒中的70%,并具有高发病率、高复发率、高致残率和高死亡率的特点,不仅严重影响患者的生活质量,而且给家庭和社会带来沉重的经济负担[2]。临床分析发现,老年脑卒中患者常存在高血压和糖尿病等多种基础疾病,而且老年脑卒中患者免疫力降低,易出现感染、褥疮、肺栓塞和消化道出血等并发症[3],在治疗上更为棘手,临床用药也需要考虑基础疾病和药物不良反应而受到多方面限制。中药在改善脑卒中后的神经损伤方面具有相对安全有效和不良反应小等优势,因此《中西医结合脑卒中循证实践指南(2019)》[4]指出,在缺血性脑卒中治疗中,可参考使用丹参类、三七类及灯盏细辛注射液等的中药注射剂。但目前这些中药注射剂尚需要进一步开展高质量的临床试验以完善循证医学证据[5]。由于灯盏花素(Breviscap⁃ine,Bre)是灯盏细辛的中药提取制剂,是比较单一的有效成分,具有活血化瘀和疏通瘀滞之气血等功效[6],因此探讨灯盏花素在缺血性脑卒中的神经保护作用机制,旨在为灯盏花素的临床应用提供更充分的实验依据。
1 材料与方法
1.1 实验动物及分组
10 周龄健康雄性SD 大鼠72 只,SPF 级(购自上海吉辉实验动物饲养有限公司),所有大鼠饲养于恒温(25 ℃)环境,自由饮水,12 h 昼夜,实验开始前适应性饲养1 周。动物实验获得上海市公共卫生临床中心的动物伦理委员会审批,并在实验过程中严格遵守实验动物福利和伦理要求。
研究分为2 个部分:第1 部分在缺血性脑卒中大鼠上探索灯盏花素的有效给药剂量,分为模型组、溶剂对照组、 Bre 低剂量组(5 mg/kg)、中剂量组(10 mg/kg)和高剂量组(20 mg/kg),每组8 只大鼠,每组大鼠于造模后第5 天进行神经功能缺损评分和脑组织TTC 染色并计算梗死灶体积。第2 部分探讨灯盏花素改善缺血性脑卒中损伤的分子机制,分为假手术组、模型组、溶剂对照组和Bre 组(10 mg/kg),每组8 只大鼠,每组大鼠于造模后第5 天取材,分别检测损伤侧皮层中MDA 和SOD 水平和Nrf2 和HO⁃1 的蛋白表达水平。
1.2 主要设备及试剂
分光光度计(美国Thermo 公司,型号NanoDro⁃P2000),低温超速离心机(美国Beckman 公司,型号Allegra X⁃22R),化学发光成像系统(上海天能公司,型号Tanon4500),电泳仪及电转移装置(美国Bio⁃Rad公司,型号Basic 系列),酶标仪(美国BioTek 公司,型号Epoch)。注射用灯盏花素(湖南恒生制药股份有限公司10 mg/瓶),2,3,5⁃三苯基氯化四氮唑(2,3,5⁃triPhenyl⁃2H⁃tetrazolium chloride,TTC,国药集团化学试剂有限公司),MDA 测定试剂盒(南京建成生物科技有限公司,A003⁃1),SOD 测定试剂盒(南京建成生物科技有限公司,A001⁃3),Nrf2 抗体(美国Abcam 公司,ab331163),HO⁃1 抗体(美国Abcam 公司,ab13248),HRP 羊抗兔IgG(美国Invitrogen 公司,G21234),HRP 羊抗鼠IgG(美国CST 公司,7076S)。
1.3 MCAO 动物模型的建立及灯盏花素给药
根据Zea Longa 的方法[7]制备大脑中动脉缺血再灌注模型,术前12 h 禁食,4 h 禁水,通过麻醉机给予异氟烷麻醉,暴露颈总动脉以及颈内和颈外动脉,将直径为0.28 mm 的线栓从颈外动脉沿颈内动脉插入大脑中动脉分支处,缺血2 h 后抽出线栓约8 mm 并缝合切口。假手术组仅分离血管不插入线栓。
通过尾静脉注射给药,Bre 低、中、高剂量组分别给予Bre 5、10、20 mg/kg 的剂量,给药组大鼠在造模后立即给药,每天给药1 次,共给药5 次。溶剂对照组给予同体积的生理盐水。
1.4 大鼠神经功能缺损评分
根据既往的方法在大鼠缺血再灌注损伤后的第5天进行神经功能缺损程度评分[8]:大鼠无任何不对称活动为0 分;提起尾巴时左前爪不能完全伸展为1 分;在1分的基础上左前肢活动障碍为2 分;左前肢紧贴胸壁为3 分;大鼠自由活动时向左侧转弯为4 分;伴有明显的左前爪后推动作为5 分;只能围绕原点旋转为6 分;左侧肢体完全不能支撑身体,只能躺向左侧为7 分。
1.5 大鼠脑组织TTC 染色和梗死体积计算
完成神经功能缺损评分后,大鼠进行安乐死并迅速取脑,将大脑等分切成2 mm 厚的脑片,浸入2%的TTC 生理盐水中30 min,而后移入4%的多聚甲醛溶液固定。脑片经拍照、扫描后由Ulead Photo ExPress 2.0图像分析软件进行脑梗死轮廓勾画和梗死面积的测量再乘以脑片的厚度算出每侧大脑梗死组织的体积,再除以同侧脑总体积得到梗死体积的百分比。
1.6 大鼠脑内MDA 和SOD 水平测定
损伤侧大脑皮层组织称定质量后进行匀浆,提取上清,然后按照说明书中的方法进行检测,同时检测上清中的总蛋白含量。
1.7 脑内Nrf2 和HO⁃1 的蛋白表达水平检测
采用SDS⁃聚丙烯酰胺凝胶电泳,然后进行转膜再经相应的一抗(Nrf2 和HO⁃1 均为1∶1 000)孵育,二抗孵育及ECL 发光,最后在凝胶成像系统观察拍摄,并使用Image J 软件行条带灰度分析。
1.8 统计学分析
使用SPSS 25.0 软件进行数据分析。所有数据以均数±标准差(±s)表示,多组间比较采用单因素方差分析,同时应用Tukey 法进行2 组之间的两两比较。P<0.05 为差异有统计学意义。
2 结果
2.1 灯盏花素对缺血性脑卒中大鼠脑损伤的影响
首先观察不同剂量的灯盏花素对于缺血性脑卒中大鼠神经功能缺损评分的影响(见图1B)。结果显示只有Bre 中剂量组大鼠的神经功能缺损评分显著低于模型组(P<0.001),而溶剂对照组、 Bre 低剂量组和高剂量组大鼠的神经功能缺损评分与模型组相比无明显差异(P>0.05)。
其次,通过脑切片的TTC 染色可以观察到正常脑组织染色呈现红色,而梗死脑组织呈现苍白色,Bre 中剂量组大鼠的梗死脑区面积较其他组小(见图1A)。通过扫描脑片并计算梗死体积后可进行组间比较,结果显示Bre 中剂量组大鼠的梗死体积显著小于模型组(P<0.001),而其他各组大鼠的脑梗死体积与模型组相比无明显差异(P>0.05)。见图1C。
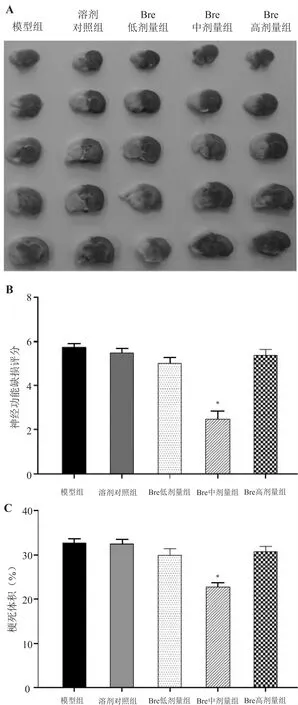
图1 灯盏花素对缺血性脑卒中大鼠神经功能缺损评分和脑梗死体积的影响
2.2 灯盏花素对缺血性脑卒中大鼠损伤测皮层中MDA 和SOD 的影响
为了明确灯盏花素对缺血性脑卒中大鼠损伤测皮层中氧化损伤的抑制作用,分别检测了损伤测皮层组织中的MDA 和SOD 水平。结果显示(见表1),与假手术组相比,模型组、溶剂对照组和Bre 组(10 mg/kg)的损伤测皮层中MDA 水平均显著升高(P<0.001),但Bre 组的MDA 水平却显著低于模型组和溶剂对照组(P<0.05)。相反的,与假手术组相比,模型组、溶剂对照组和Bre 组(10 mg/kg)的损伤测皮层中SOD水平均显著降低(P<0.05),但Bre 组的SOD 水平却显著高于模型组和溶剂对照组(P<0.001)。
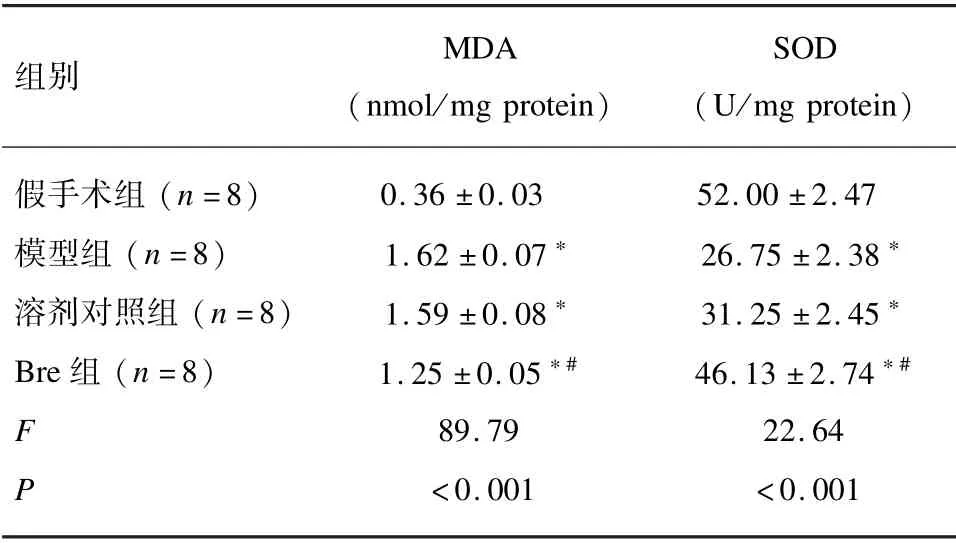
表1 灯盏花素对各组大鼠损伤测皮层中MDA 和SOD 的影响
2.3 灯盏花素对缺血性脑卒中大鼠损伤测皮层中Nrf2 和HO⁃1 的影响
由于Nrf2/HO⁃1 通路可以引发细胞内的抗氧化效应,因而检测给予灯盏花素后,对缺血性脑卒中大鼠损伤侧皮层中Nrf2 和HO⁃1 表达的影响。与假手术组相比,模型组和溶剂对照组损伤侧皮层中Nrf2 的表达均显著下降(P<0.001),但Bre 组Nrf2 的表达显著高于模型组和溶剂对照组(P<0.05)。此外,模型组、溶剂对照组和Bre 组(10 mg/kg)的损伤侧皮层中HO⁃1 表达均显著高于假手术组(P<0.05),而且Bre 组的HO⁃1 表达还显著高于模型组和溶剂对照组(P<0.001)。见图2。
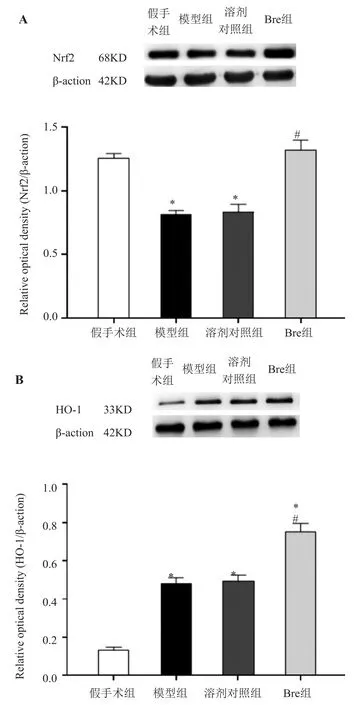
图2 灯盏花素对血性脑卒中大鼠损伤测皮层中Nrf2 和HO⁃1 表达的影响
3 讨论
缺血性脑卒中是指脑血循环障碍病因导致脑血管堵塞或严重狭窄,使脑血流灌注下降,进而缺血、缺氧导致脑血管供血区脑组织死亡[9]。随着我国人口老龄化趋势的不断加速,缺血性脑卒中的发病率呈现增高的趋势。因此寻找安全有效的药物改善缺血性脑卒中的脑损伤成为医学界关注的热点。中医把脑卒中归于“中风”和“偏枯”的范畴,并认为“瘀血”是缺血性脑卒中发病的重要原因。朱丹溪提出“内风多由淤血致”,明清时期的《医学纲目》认为“脉道不利,气血闭塞也”是中风的主要原因。因而活血化瘀是治疗缺血性脑卒中的主要方法,灯盏花素正具有活血化瘀、疏通脉络的功效。
本研究观察到中剂量的灯盏花素可以显著降低缺血性脑卒中大鼠的神经功能缺损评分并明显减少脑梗死灶的体积,这些结果显示灯盏花素可以减轻缺血性脑卒中后的脑损伤。这与灯盏花素在临床脑卒中治疗方面的疗效相一致[10],也与既往的动物研究结果相吻合[11⁃12]。但是灯盏花素改善缺血性脑卒中后的脑损伤的分子机制还有待于深入研究。
脑血流的急剧降低是缺血性脑卒中发生的始动因素,继而的缺血和缺氧严重影响脑组织细胞的能量代谢,导致缺血区域pH 值降低和线粒体电子传递障碍,使得ATP 的生成进一步减少而自由基生成增多,促发神经细胞的过度去极化和兴奋性神经递质释放,最终导致神经细胞的死亡[12⁃13]。在缺血性脑卒中的病理发生过程中,细胞的氧化应激水平升高是一个关键环节。大量的研究证实当脑缺血后过度的氧化应激反应可造成神经元和胶质细胞的损伤以及血脑屏障的破坏[13]。为了减轻氧化应激带来的损伤,细胞内还存在一个保守且复杂的抗氧化防御系统,细胞核因子E2 相关因子2(Nu⁃clear factor erythroid 2 Related Factor 2,Nrf2)是该系统中1 个重要的转录因子,它可以通过与抗氧化应答元件(ARE)结合,调节多种抗氧化酶的表达[14]。而血红素加氧酶1(HO⁃1)作为1 种重要的抗氧化酶,其表达就受到Nrf2 的调控,HO⁃1 是Nrf2 通路下游最主要的指标,所以本文从最主要的指标展开研究。HO⁃1可以催化血红素氧化分解产生等物质的量的亚铁、CO 和胆绿素,胆绿素再转化为胆红素,进而帮助细胞抵抗活性氧产生的氧化应激损伤。因此普遍认为Nrf2/HO⁃1 是细胞抗氧化防御系统的1 个重要通路,可以作为脑缺血损伤治疗的药物靶点[15⁃16]。本研究发现,给予中剂量的灯盏花素可以降低损伤侧皮层中氧自由基代谢产物MDA 水平,同时可以升高抗自由基的超氧歧化酶(SOD)水平,从而改善缺血性脑卒中的损伤侧皮层中的氧化应激水平。此外,给予中剂量的灯盏花素可以引起损伤侧皮层中Nrf2 和HO⁃1 表达水平升高,激活损伤侧皮层内的细胞抗氧化防御系统,产生相应的脑保护作用。然而,灯盏花素如何促使Nrf2 的表达上调,以及灯盏花素通过Nrf2 对细胞内其他抗氧化酶的调控作用还需要进一步研究,进而为灯盏花素在缺血性脑卒中的临床应用提供更充分的实验依据。

