50型硬脂酸功能性相关指标的考察
谢莹莹,刘雁鸣,郑金凤,张悦,蒋贇,赵勇,周颖,刘杨,石蓉,李颖,粟贵(湖南省药品检验检测研究院,国家药品监督管理局药用辅料工程技术研究重点实验室,长沙 410001)
一致性评价的成功与否很大程度上取决于制剂中药用辅料是否与参比制剂一致,目前《中国药典》2020年版四部药用辅料品种项正文已逐步向国外药典靠拢,或严于国外药典,然而制剂的质量、体内外性质、临床疗效仍然存在差别,较大原因与药用辅料的功能性指标有关[1-3]。
硬脂酸作为药用辅料,常用作润滑剂和软膏基质[4],在《中国药典》2020年版四部(ChP 2020)[5]、美国药典2021版(USP2021)、欧洲药典10.0版(EP10.0)、日本药局方17版(JP17)和印度药典2010年版(IP2010)均有收载[6-9],各国药典均对功能性指标中的酸值、碘值、凝点、纯度(含量测定)等项目有控制,EP10.0中硬脂酸作为固体制剂的润滑剂使用时,对粒度分布和比表面积等功能性参数进行了非强制规定。目前市场上硬脂酸可分为50、70、95型,需求大多为50型,根据本品的类别以及各国药典对其功能性相关指标的控制情况,本文以50型硬脂酸为例,结合统计学对该品种的硬脂酸与棕榈酸的比率、凝点、酸值、碘值、粒度、比表面积等6个重要的功能性指标进行分析,为提高完善质量标准和提升制剂质量平行稳定提供参考。
1 材料
气相色谱仪(GC-2010plus,日本岛津);激光粒度分布仪(Mastersizer 3000,马尔文);静氮吸附仪(JW-BK400,北京精微高博科学技术有限公司);分析天平(MS 205DU,Mettler Toledo);气相色谱柱Agillent DB-Wax(30 m×320 mm,0.50 μm)。
硬脂酸[7家生产企业(A~G),共39批次,药用辅料级别样品共30批,化工原料级别样品共9批,其中A~D企业为药用辅料级,E~G企业为化工原料级;A、D企业为工艺3,B、C企业为工艺2,E、F、G企业为工艺1];本次经电话沟通及现场调研共收集到了7家生产企业的工艺简图,包含3种工艺,化工原料级别硬脂酸采用合成工艺(在硬化油中加入分解剂,然后水解得粗脂肪酸,再经水洗、蒸馏、脱色即得成品,同时副产甘油;简称工艺1);药用辅料级别硬脂酸分别采用精制工艺1(以化工原料级硬脂酸为原料,不加乙醇重结晶;简称工艺2)和精制工艺2(以化工原料级硬脂酸为原料,加乙醇重结晶工艺;简称工艺3);水为超纯水。
2 方法
2.1 凝点
凝点系指由液体凝结为固体时,在短时间内停留不变的最高温度,可以区别或检查原辅料的纯杂程度[5,10];参考ChP2020四部通则0613凝点测定法[5]进行硬脂酸凝点的测定。
2.2 碘值
碘值系指供试品充分卤化时所需的碘量,是评价油脂不饱和程度的重要参数,可决定药物的溶解性或分散程度[5,11];参考ChP2020四部通则0713脂肪与脂肪油测定法[5]进行硬脂酸碘值的测定。
2.3 酸值
酸值系指供试品含有的游离脂肪酸的量,可根据酸值的变化有效地判断储存条件的合理性[12];参考ChP2020四部通则0713脂肪与脂肪油测定法[5]进行硬脂酸酸值的测定。
2.4 硬脂酸与棕榈酸的比率
生产硬脂酸的原料,主要为棕榈油经过分提的固体成分水解后得到硬脂酸与棕榈酸,因此硬脂酸与棕榈酸的比率可表征硬脂酸的纯度,比率越大,说明硬脂酸中的硬脂酸含量越高[13]。参考ChP2020四部硬脂酸各论[5]下的含量测定项进行硬脂酸与棕榈酸的比率的测定,色谱条件:起始温度为170℃,维持2 min,以10℃·min-1的速率升温至240℃,维持数分钟;进样口温度为250℃;检测器温度为260℃;按面积归一法计算硬脂酸中硬脂酸与棕榈酸的含量,再计算两者的比值。
2.5 粒度和粒径分布
粒度和粒径分布可表征粉体的基本特征,分散粒径的大小对于药物疗效的正常发挥有重要的影响[5,14]。参照ChP2020 “通则0982 粒度和粒度分布测定法”第一法和第三法[5],采用肉眼、显微镜及干法激光粒度仪进行粒度形态及粒径分布的表征。干法激光粒度仪测定参数为折射率:1.43;吸收率:0.01;遮光度:0.5%~6%;样品盘类型:通用样品盘(带漏斗);料斗间隙:2 mm;气压:2 bar;进样速度:35%;以累积粒度百分数达50%时所对应的粒径(D50)作为评价指标。
2.6 比表面积
比表面积是评价粉末活性、吸附等性能的一项重要参数,药品的有效期、溶解速率与药效依赖于原辅料的比表面积[15-16]。参照ChP2020 “通则0991 比表面积测定法”第二法容量法对“比表面积”进行测定[5]:在一定P/P0值0.05~0.30的范围内,测定硬脂酸中的吸附质吸附量,按BET方程作图并计算(多点方式)得到硬脂酸的比表面积。
2.7 数据分析
对所有指标数据按不同企业、不同级别、不同生产工艺分类,采用 SPSS 18.0 软件进行统计分析。
3 结果
3.1 凝点
所有样品凝点结果均符合ChP2020的限度(53~59℃)要求[5],结果见表1~3及图1A。不同级别、不同生产工艺间的凝点均无统计学差异(P>0.05),箱式图显示,工艺2较工艺1、3离散程度大,药用辅料级较化工原料级离散程度大,A、B、C企业产品较其他生产企业离散程度大。
3.2 碘值
所有样品碘值结果均符合ChP2020的限度(≤4.0)要求[5],结果见表1~3及图1B。不同级别间的碘值无统计学差异(P>0.05),箱式图显示,工艺1、3较工艺2离散程度大,药用辅料级较化工原料级离散程度大,A、D、G企业产品较其他生产企业离散程度大。
3.3 酸值
所有样品酸值结果均符合ChP2020的限度(194~212)要求[5],结果见表1~3及图1C。不同级别间的酸值均无统计学差异(P>0.05),箱式图显示,A、B、G企业产品较其他生产企业离散程度大。
3.4 硬脂酸与棕榈酸的比率
所有样品硬脂酸的量与硬脂酸和棕榈酸总含量均符合ChP2020的限度[硬脂酸的量:40.0%~60.0%(不包括60.0%);硬脂酸和棕榈酸总含量:不低于90.0%]要求[5],结果见表1~3及图1D。箱式图显示,药用辅料级较化工原料级离散程度大,G企业产品较其他生产企业离散程度大。
3.5 比表面积
不同级别、不同工艺间的比表面积均无统计学差异(P>0.05),箱式图显示,化工原料级较药用辅料级离散程度大,A企业产品较其他生产企业离散程度大。结果见表1~3及图1E。
3.6 粒径及粒径分布
典型样品照片与显微形貌图见图2,从典型样品照片与显微形貌图可知,不同企业间的样品形貌具有显著差异,既有粉末又有颗粒,对粒径缺乏统一范围控制,与粒径测定结果大体吻合;不同级别间的D50,结果见表1~3,图1F均无统计学差异(P>0.05),箱式图显示,B、C企业产品较其他生产企业离散程度大。

图2 典型硬脂酸样品照片与显微形貌图Fig 2 Photos and micromorphology of typical stearic acid
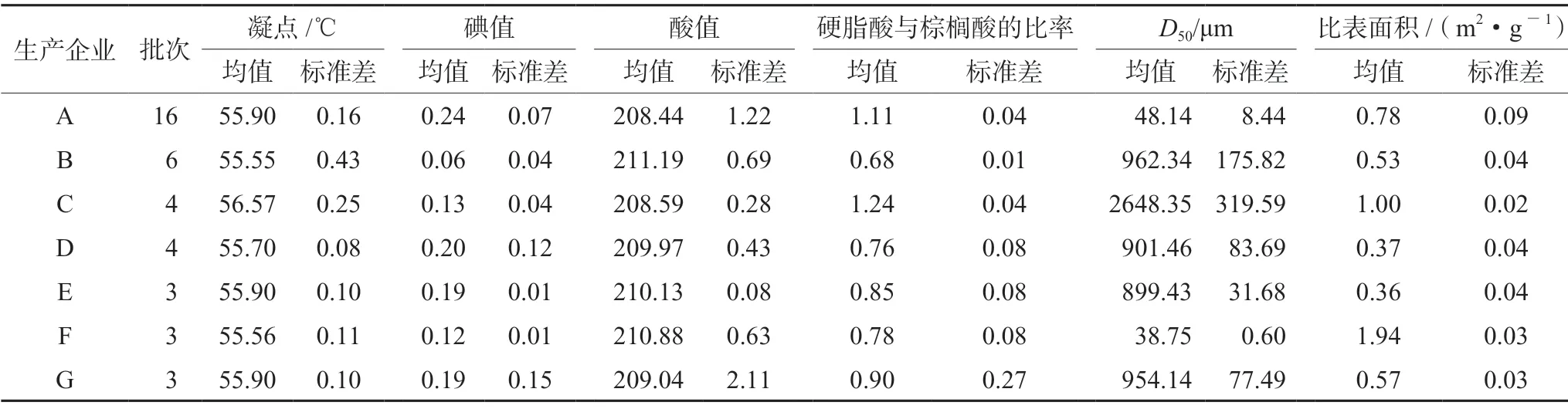
表1 不同企业功能性指标结果统计表Tab 1 Functionality related characteristics by different enterprises
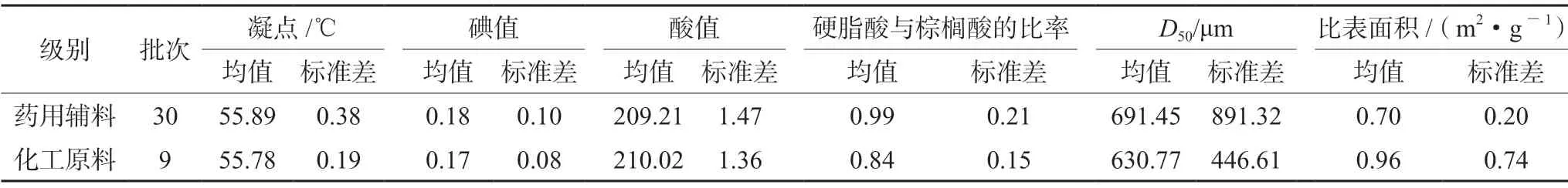
表2 不同级别功能性指标结果Tab 2 Functionality related characteristics at different levels
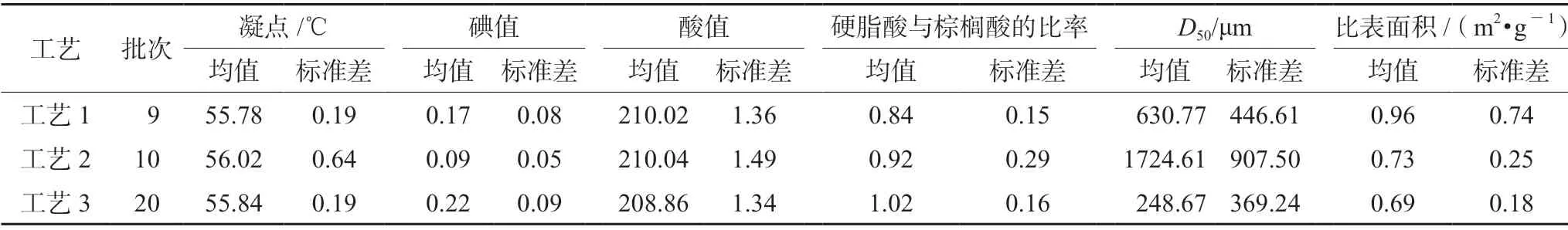
表3 不同生产工艺功能性指标结果Tab 3 Functionality related characteristics from different production processes
4 讨论
39批次50型硬脂酸的结果显示:① 不同级别、不同工艺产品的凝点、比表面积等功能性指标结果差异均无统计学意义,但不同生产企业间存在不同程度的差异,如比表面积,7家生产企业中有≥5家两两比较差异存在统计学意义;②由箱式图可知,凝点、碘值、硬脂酸与棕榈酸的比率等功能性指标药用辅料级比化工原料级离散程度大;同一企业的部分功能性指标与其他企业相比离散程度较大,如A企业,凝点、碘值、酸值、比表面积等4个功能性指标离散程度大。
作为药用辅料级硬脂酸采用的均为精制工艺(工艺2和工艺3),起始原料的质量及成型工艺中干燥、粉碎、过筛的参数是决定成品硬脂酸功能性指标的重要因素[16];其中起始原料的质量会直接决定功能性指标中的酸值、碘值、凝点以及硬脂酸与棕榈酸的比率等;部分生产企业可能起始原料质量、工艺路线均相同,但因成型工艺中粉碎、过筛的参数的不同,会导致成品中粒度及比表面积的结果有显著差别。作为化工原料级硬脂酸采用的均为合成工艺(工艺1),由分馏法水解制得,水解纯化工艺是影响工业级硬脂酸质量的关键技术因素[17-19];其中硬化油的质量、分解剂加入量、水洗次数及蒸馏参数等均可能会影响成品的功能性相关指标。
功能性指标的考察并不仅仅是保证其本身的质量,同时,保证其在制剂中发挥赋形作用的一致性更为重要;因此,为保证制剂工艺的一致性和质量有效性,建议制剂企业重点关注制剂所需辅料的关键功能性指标。ChP2020四部硬脂酸各论项下暂未规定粒度分布、比表面积,为了使用企业制剂的质量均一性,建议药用辅料生产企业将粒度分布、比表面积测定结果列入标示项,以便制剂企业使用。
本研究方法与结果对制剂处方中辅料拟定、选择以及一致性评价中与辅料相关的问题剖析均有一定的参考价值。

