安罗替尼联合PP方案二线治疗EGFR突变T790M阴性晚期非小细胞肺腺癌的疗效及安全性评价
王国红,解 华
(宣城市人民医院 肿瘤科,安徽 宣城 242000)
最新的人类癌症死亡数据估计每年有220万新发肺癌病例,160万人死于肺癌[1]。其中,非小细胞肺腺癌(non-small cell lung cancer,NSCLC)患者占所有肺癌患者总数的80%以上,并且有50%的患者就诊时就已经是晚期(ⅢB或Ⅳ期)[2]。
在NSCLC患者中,表皮生长因子受体(epidemic growth factor receptor,EGFR)突变是最重要的分子生物学标志物之一,其突变与患者对EGFR酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)的疗效和敏感性有明显关联。因此,EGFR-TKI通常被用作晚期EGFR突变患者的标准一线治疗[3]。
尽管一线EGFR-TKI的肿瘤响应率很高,但是绝大多数患者在治疗9~13个月后仍出现疾病进展,这可能与晚期肺癌产生抗药性有关[4-6]。发生EGFR-TKI治疗无效后并且再次活检T790M为阴性时,含铂双药的化疗方案(顺铂/培美曲塞,PP)成为了该类NSCLC患者的标准治疗方案之一[7]。一项随机Ⅲ期研究表明,与顺铂/吉西他滨相比,PP能显著改善晚期肺腺癌患者的总生存期(overall survival,OS)[8]。最近的研究提供进一步方案:与单用PP相比,PP后培美曲塞维持治疗可提供更高的无进展生存期(progression free survival,PFS)和OS益处[9]。这些发现使PP化疗方案成为晚期NSCLC首选。另外,安罗替尼(AL3818)作为一种新型多靶点TKI,主要通过抑制肿瘤血管生成和增殖信号传导[10]。并且ALTER 0303临床研究表明经过一代和二代靶向治疗出现进展的肺癌患者在接受规范安罗替尼治疗后,可以延长患者的PFS和OS,并且毒副反应可耐受[11]。
目前,尚未有相关报道评估安罗替尼与PP化疗方案联合治疗策略用于治疗一线治疗失败后的晚期NSCLC患者。因此,我们开展了联合方案与PP方案的临床研究,以评估联合方案的治疗效果和安全性。
1 资料方法
1.1 病例资料 选取宣城市人民医院2019年1月~2020年10月48例晚期NSCLC癌患者为研究对象。安罗替尼联合治疗组24例,男5例,女19例,平均年龄(62.45±8.97)岁;单独化疗组24例,男4例,女20例,平均年龄(63.73±9.15)岁。所有患者均为EGFR突变,并已接受一线TKI治疗。所有患者在入组前均已签署知情同意书。两组患者年龄、性别差异均无统计学意义(P>0.05)。
入选标准:①经病理学确诊的NSCLC;②血常规、肝肾功能和心电图基本正常;③Karnofsky功能状态(Karnofsky performance status,KPS)评分>70分(评分范围:0~100);④影像学检查临床分期为ⅢB期或者Ⅳ期;⑤预期生存期达3个月或以上;⑥均有EGFR突变;⑦一线TKI治疗后出现疾病进展,且经过再次活检T790M为阴性;⑧至少一个可测量病灶,年龄>18周岁。
1.2 方法 联合治疗组的患者接受口服安罗替尼12 mg/(次·天),连续服用14 d,休息7 d,同时静脉注射培美曲塞(500 mg/m2)加顺铂(75 mg/m2),每3周1次,最多6个周期。在4个周期的顺铂治疗加培美曲塞后没有疾病进展的患者可以继续维持培美曲塞。单独化疗组的患者除了不服用安罗替尼,化疗方案与联合治疗组相同。治疗一直持续到疾病进展、出现不可接受的副作用或患者要求停止治疗。
1.3 评价标准 疗效评价标准参考RECIST 1.1标准评价肿瘤的治疗效果,分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)以及疾病进展(PD)。其中,客观缓解率(ORR)表示CR和PR的患者在所有可评价疗效患者中所占的百分比;疾病控制率(DCR)表示CR、PR和SD的患者在所有可评价疗效患者中的百分比。PFS表示从本次治疗到肿瘤出现继发进展的时间。OS表示从患者确认患有疾病开始至因任何原因引起死亡的时间。药物的不良反应根据NCI-CTC 4.2标准进行评价。
1.4 随访 采用门诊复查以及电话方式对患者进行随访,随访内容包括血常规、肝肾功能、肿瘤标志物以及相关的影像学检查等。随访日期截止到2021年10月1日。
2 结果
2.1 两组患者治疗效果比较 联合治疗组ORR(66.7%)、DCR(87.5%)高于单独化疗组(37.5%、54.2%),差异有统计学意义(P<0.05),见表1。
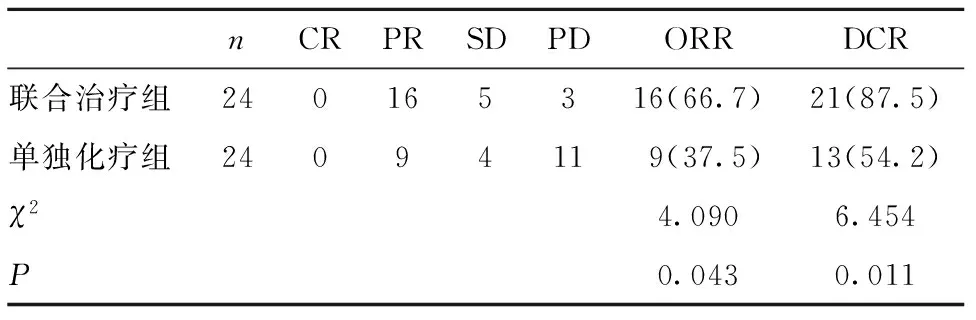
表1 两组患者治疗效果比较[n(%)]
2.2 两组患者随访结果比较 两组患者均按要求完成随访。联合治疗组中位PFS(7.7个月)、中位OS(13.1个月)分别长于单独化疗组(4.5个月、9.7个月),差异有统计学意义(P<0.001),见图1。

图1 联合治疗组与单纯化疗组的PFS、OS比较
2.3 两组患者不良反应发生情况 通过联合治疗组和单独化疗组的对比,可以观察到安罗替尼的不良反应主要包括高血压、蛋白尿、疲劳等。在治疗期间,有2名患者(8.3%)剂量调整到10 mg/d,减少剂量的原因主要为高血压。两组的胃肠道反应和血液系统反应比例均较高,但大部分均可耐受(1~2级),见表2。

表2 两组患者不良反应比较
2.4 两组患者生活质量评分比较 联合治疗组治疗后KPS评分(76.43±6.19)与单纯化疗组(77.41±5.21)差异无统计学意义(t=0.594,P=0.556)。
3 讨论
临床试验表明,作为肺癌靶向药物之一的凡德他尼尽管能够针对成纤维细胞生长因子受体,但是并不能在肺癌患者中展现出很好的疗效[12]。作为新兴的多靶点TKI,安罗替尼的靶分子包括血管内皮生长因子受体1~3、FGFR、血小板衍生生长因子受体α和β、成纤维细胞生长因子受体1~3以及干细胞因子受体。安罗替尼对上述靶点的阻断效果有利于抑制肿瘤血管生成和部分肿瘤细胞的生长功能。先前的临床研究表明:安罗替尼作为三线治疗方案的耐受性良好,并且能够显著改善PFS和OS,是治疗晚期NSCLC患者的潜在治疗选择[13]。
本研究结果表明:接受一线EGFR-TKI治疗后出现进展的T790M阴性晚期NSCLC患者中,接受安罗替尼联合PP方案治疗的患者比只接受单独化疗的患者获得更好的ORR和PFS。在接受联合治疗的患者中,ORR为66.7%,中位PFS为7.7个月;单独PP化疗方案的客观缓解率仅36.1%,中位PFS仅为4.7个月,该结果与AURA3和IMPRESS的临床研究治疗结果基本一致[14]。
使用其他EGFR-TKI(如吉非替尼和阿法替尼等)用于EGFR突变的晚期NSCLC的一线治疗,最常见的不良事件是胃肠道反应和皮肤问题。另外,抗血管生成治疗的主要副作用之一就是出血,比如贝伐珠单抗是一种针对血管内皮生长因子受体的抗体,可引起高血压、蛋白尿、出血和血栓形成等不良反应;这些都是使用安罗替尼可能会引发的不良反应。在本研究中也观察到类似的不良事件,不良反应大多数都可以耐受,并且出血事件发生率较低。且经过治疗后,两组间患者生活质量评分差异无统计学意义,说明安罗替尼在联合治疗中的安全性和可靠性,即不影响患者的KPS评分。
随着免疫治疗改善晚期肺癌患者预后的相关证据越来越多,临床前期研究也表明免疫检查点抑制剂联合抗血管生成药物具备协同增效机制。一方面是因为抑制血管内皮生长因子可使肿瘤血管系统正常化,促进表达γ-干扰素(IFN-γ)的CD8+细胞毒性T淋巴细胞激活,并抑制效应T细胞耗竭等[15]。另一方面,免疫检查点抑制剂可以激活效应T细胞、上调IFN-γ的分泌,使肿瘤血管系统正常化,增加效应T细胞的浸润及杀伤功能,改善肿瘤微环境[13]。我们未来的临床研究将进一步开展关于安罗替尼联合免疫治疗的策略在晚期NSCLC的延期,以期患者能够获得更好的预后和生活质量。

