冬凌草甲素通过G2/M期阻滞和诱导细胞凋亡增强人胃癌细胞放疗敏感性
高灵犀,张 妍,汪 文,张 腾
(皖南医学院第一附属医院 弋矶山医院 消化内科,安徽 芜湖 241001)
胃癌是世界上第五大最常见的癌症[1]。75%以上的新诊断患者处于晚期,约有50%的晚期胃癌患者失去了手术机会[2]。放疗在胃癌治疗中具有重要作用,主要运用于术前新辅助化疗及术后辅助化疗[3-4]。然而胃癌的放疗抵抗性及电离辐射的非特异性毒性限制了放疗的应用[5]。因此,研究有效、低毒的放疗增敏剂十分迫切。植物化学物质的低毒性和良好的抗癌作用使其成为研究放疗增敏的新方向[6]。冬凌草甲素是一种天然的抗肿瘤二萜类化合物,可抑制癌细胞增殖,调节细胞周期、凋亡、侵袭、迁移等[7-8],且能增强非小细胞肺癌放疗敏感性[9],但其作为胃癌放疗增敏剂及其机制研究尚不充分。本研究通过冬凌草甲素联合放疗处理SGC7901细胞,检测其对细胞增殖、周期、凋亡的影响,探究其增强人胃癌放疗敏感性的机制。
1 材料和方法
1.1 材料 SGC7901人胃癌细胞(上海澳音生物),冬凌草甲素(美国MedChemExpress),RPMI-1640培养基(美国Gibco),胎牛血清(FBS,上海双洳生物),CCK-8检测试剂盒(麦客生物),Annexin V-FITC/PI双染细胞凋亡试剂盒(上海贝博生物),EdU细胞增殖试剂盒、细胞周期试剂盒(上海碧云天生物),兔源Bcl-2抗体、兔源Apaf-1抗体、兔源Cytochrome C抗体(武汉ABclonal)、兔源Bax抗体、兔源Cleaved-caspase3抗体、鼠源β-actin抗体(美国Cell Signaling Technology)。逆转录试剂盒、qPCR试剂(上海翊圣生物)。
1.2 细胞培养 SGC7901细胞采用含10%血清的RPMI-1640培养基,置于37℃、5%CO2的细胞培养箱。
1.3 冬凌草甲素溶液的制备 冬凌草甲素粉末用二甲基亚砜(DMSO)稀释制成浓度为10 mmol/L的储存液,分装并保存于-80℃冰箱。
1.4 CCK-8实验 取对数生长期的细胞接种于96孔板,细胞贴壁后,用不同冬凌草甲素浓度(0、2、4、8、16 μmol/L)或不同放疗剂量(0、2、4、6 Gy)处理,72 h后用CCK-8试剂检测细胞活力。CCK-8试剂加入2 h后用酶标仪(Bio Tek Epoch2)在450 nm处测定各组的吸光度(OD),将各组孔OD值减去空白孔OD值,各重复孔OD值取平均数。细胞存活率=(加药细胞OD-空白OD)/(对照细胞OD-空白OD)×100%;抑制率=(对照细胞OD-加药细胞OD)/(对照细胞OD-空白OD)×100%。
1.5 EdU细胞增殖实验 取对数生长期的细胞接种于96孔板,设置空白对照组、冬凌草甲素组(6 μmol/L)、放疗组(4 Gy)、联合组。联合组的细胞在放疗前先用冬凌草甲素预处理1 h。48 h后将2×EdU工作液等比例加入孔板的培养基中,继续孵育2 h,去除培养液,室温固定、通透,每孔加入50 μL Click反应液,室温避光孵育30 min,然后染核,用荧光倒置显微镜(Nikon Ti-U)观察并拍摄图像,Image J 1.51K软件计数,计算细胞增殖率。
1.6 平板克隆形成实验 取对数生长期的细胞,分组如“1.5”。联合组的细胞在放疗前先用冬凌草甲素预处理1 h。细胞以800个/孔的密度接种于6孔板,孵育10~12 d。固定、染色、漂洗后自然晾干并拍摄图像,Image J 1.51K软件计数克隆团,计算实验组与对照组的比值。
1.7 细胞周期实验 取对数生长期的细胞,分组如“1.5”。联合组的细胞在放疗前先用冬凌草甲素预处理1 h。48 h后收集细胞,预冷PBS重悬并离心。用预冷70%乙醇吹打混匀,4℃固定30 min后离心,预冷PBS重悬并离心。每组加入0.5 mL碘化丙啶染色液重悬,37℃避光温浴30 min,流式细胞仪(Beckman CytoFLEX)检测细胞周期。
1.8 细胞凋亡实验 取对数生长期的细胞,分组如“1.5”。联合组的细胞在放疗前先用冬凌草甲素预处理1 h。72 h后收集细胞,预冷PBS洗涤2次。用400 μL 1×Annexin V结合液重悬,加入5 μL Annexin V-FITC染色液并混匀,4℃避光孵育15 min,加入5 μL碘化丙啶染色液于4℃避光孵育5 min,用流式细胞仪检测细胞凋亡率。
1.9 qPCR 取对数生长期的细胞,分组如前。联合组的细胞在放疗前先用冬凌草甲素预处理1 h。48 h后用Trizol试剂提取总RNA,合成cDNA,最后用qPCR仪(ABI QuantStudio 3)分析基因表达情况。所有数据归一化到GAPDH表达。使用计算公式2-ΔΔCt计算相对基因表达水平。相关引物序列如表1所示。

表1 qPCR所用引物序列
1.10 Western blot实验 取对数生长期的细胞,分组如前。联合组的细胞在放疗前先用冬凌草甲素预处理1 h。48 h后提取细胞总蛋白并用Bicinchoninic acid(BCA)法检测浓度。蛋白(30 μg)在SDS-聚丙烯酰胺凝胶上电泳,转移到聚偏二氟乙烯(PVDF)膜。5%牛血清白蛋白溶液室温封闭2 h,一抗在水平摇床上4℃孵育过夜。次日与二抗室温孵育2 h。最后用ECL化学发光试剂和化学发光成像系统(Tanon 5500)检测蛋白表达量,Image J 1.51K软件分析灰度值,计算目的蛋白与内参β-actin的灰度比值。
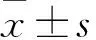
2 结果
2.1 冬凌草甲素抑制人胃癌细胞增殖 不同放疗剂量处理SGC-7901人胃癌细胞72 h,与空白对照组相比,放疗组细胞活力均下降,并随放疗剂量升高而下降(P<0.05)。见图1A。放疗组的SGC-7901人胃癌细胞半数抑制剂量为4.70 Gy。不同浓度冬凌草甲素处理SGC-7901人胃癌细胞72 h后,与空白对照组相比,冬凌草甲素组细胞活力均下降,并随药物浓度升高而下降(P<0.01)。见图1B。冬凌草甲素组的SGC-7901人胃癌细胞半数抑制浓度为8.67 μmol/L。

A.不同放疗剂量对SGC-7901人胃癌细胞活力的影响。F=84.361,P<0.001;B.不同冬凌草甲素浓度对SGC-7901人胃癌细胞活力的影响。F=242.964,P<0.001。*P<0.05,**P<0.01 vs. NC。
2.2 冬凌草甲素增强人胃癌细胞的放疗敏感性 SGC-7901人胃癌细胞经冬凌草甲素(6 μmol/L)和(或)放疗(4 Gy)处理后,平板克隆形成实验结果显示:冬凌草甲素组和放疗组的细胞克隆形成能力较空白对照组下降(P<0.05);而联合组的细胞克隆形成能力较放疗组降低更显著(P<0.05)。见图2A。EdU细胞增殖实验结果显示:与空白对照组[(54.20±1.20)%]相比,冬凌草甲素组[(41.10±1.10)%]和放疗组[(26.40±1.40)%]的细胞增殖率下降(P<0.05),而联合组的细胞增殖率[(18.65±1.35)%]低于放疗组(P<0.05)。见图2B。

A.平板克隆实验检测冬凌草甲素和(或)放疗对细胞克隆形成能力的影响,F=123.975,P<0.001;B.EdU细胞增殖实验荧光图像及统计结果,F=154.860,P<0.001。NC为空白对照组;Ori为冬凌草甲素组;IR为放疗组;IR+Ori为联合组;*P<0.05 vs. NC;#P<0.05 vs. IR。
2.3 冬凌草甲素诱导SGC-7901人胃癌细胞的G2/M期阻滞 SGC-7901人胃癌细胞用冬凌草甲素(6 μmol/L)和(或)放疗(4 Gy)处理,48 h后检测细胞周期。结果显示:与空白对照组[(5.75±0.03)%]相比,冬凌草甲素组[(10.83±0.59)%]和放疗组[(13.25±0.49)%]G2/M期细胞比例升高(P<0.05);而联合组G2/M期细胞比例[(21.61±0.21)%]高于放疗组(P<0.05)。见图3。

流式细胞术检测冬凌草甲素和(或)放疗对人胃癌细胞周期的影响,F1=291.035,F2=22.553,F3=408.532,均P<0.01。*P<0.05 vs. NC;#P<0.05 vs. IR。NC为空白对照组;Ori为冬凌草甲素组;IR为放疗组;IR+Ori为联合组。
2.4 冬凌草甲素增强SGC-7901人胃癌细胞凋亡 SGC-7901人胃癌细胞用冬凌草甲素(6 μmol/L)和/或放疗(4 Gy)处理,72 h后检测细胞凋亡。结果显示:与空白对照组[(5.60±0.31)%]相比,冬凌草甲素组[(17.89±1.35)%]和放疗组[(30.01±1.51)%]的细胞凋亡率升高(P<0.05);而联合组的细胞凋亡率[(50.73±2.69)%]高于放疗组(P<0.05)。见图4A。qPCR和Western blot结果显示:与空白对照组相比,冬凌草甲素组和放疗组的凋亡相关蛋白Apaf-1、Bax、Cytochrome C、Cleaved-caspase3表达升高(P<0.05);抗凋亡蛋白Bcl-2表达下降(P<0.05)。联合组的Apaf-1、Bax、Cytochrome C、Cleaved-caspase3表达升高较放疗组更明显(P<0.05);Bcl-2表达下降较放疗组更显著(P<0.05)。见图4B、C。

A.流式细胞仪检测人胃癌细胞凋亡图像,F=258.505,P<0.001;B.qPCR检测凋亡相关基因mRNA表达,F1=123.943,F2=40.731,F3=314.877,F4=82.319,F5=151.778,P<0.001;C.Western blot检测凋亡相关蛋白表达,F1=109.544,F2=31.830,F3=247.234,F4=61.209,F5=117.249,P<0.001。*P<0.05 vs. NC;#P<0.05vs. IR。NC为空白对照组;Ori为冬凌草甲素组;IR为放疗组;IR+Ori为联合组。
3 讨论
胃癌一直是一个严重的公共卫生问题,患者5年生存率低于30%[10]。除了手术治疗以外,放疗是胃癌的主要治疗方法之一,特别是中晚期胃癌[11]。临床上常用放疗与顺铂、紫杉醇等常规化疗相结合来增加癌细胞死亡,但对提升放疗敏感性收效微弱,且增加了对正常组织的毒性[12]。因此,研究新型放疗增敏剂是十分必要的。研究发现冬凌草甲素在肺癌、胃癌、卵巢癌等多种癌症中均可发挥显著抗癌作用[13-15],冬凌草甲素在非小细胞肺癌中可通过增强DNA损伤达到放疗增敏的效果[9]。然而,有关冬凌草甲素作为胃癌放疗增敏剂的研究仍不充分,其潜在机制尚不清楚。本研究以人胃癌细胞SGC7901作为研究对象,探讨了冬凌草甲素作为胃癌放疗增敏剂的可能性及其潜在机制。
在本研究中,我们首先验证了冬凌草甲素抑制SGC7901细胞增殖,且呈剂量依赖性。随后我们进行了细胞平板克隆形成实验和EdU细胞增殖实验。结果显示联合组的细胞增殖抑制作用高于放疗组,提示冬凌草甲素预处理可以提高SGC7901细胞对放疗的敏感性。影响放疗敏感性的主要因素有细胞凋亡、周期分布、缺氧、DNA损伤修复和信号通路的调节[12]。G2/M期是细胞周期中辐射最敏感的阶段,因此可以诱导G2/M期阻滞的药物是潜在的放疗增敏剂。在本研究中,单独使用冬凌草甲素处理使细胞周期阻滞在G2/M期,与以往报道相符合[16-17]。值得注意的是,联合组的G2/M期较放疗组增加,S期和G1期均略微减少。G2/M期的细胞对放疗更为敏感,而G1、S期的细胞对放疗相对耐受,因此冬凌草甲素对SGC7901细胞的放疗增敏作用可能部分是由于细胞周期的G2/M期阻滞所致。
细胞凋亡是放疗介导癌细胞死亡的主要形式之一[18]。放疗增敏剂可通过诱导细胞凋亡来提高放疗的疗效[19]。在本研究中,细胞凋亡实验结果显示联合组的细胞凋亡率明显高于放疗组。研究表明,冬凌草甲素可通过多种信号通路诱导癌细胞凋亡[20-21]。在细胞凋亡线粒体途径中,Cytochrome C的释放或抑制取决于Bcl-2和Bax之间的平衡。当凋亡刺激产生,线粒体外膜渗透性增加,Cytochrome C释放至胞质,与Apaf-1相结合并激活Caspase级联反应,最终导致细胞凋亡[22]。在本研究中,与放疗组相比,联合组的凋亡相关蛋白Apaf-1、Cytochrome C、Bax、Cleaved-caspase3表达上调,抗凋亡蛋白Bcl-2表达下调。以上结果提示冬凌草甲素增强了放疗诱导的细胞凋亡,线粒体凋亡途径关键分子Cytochrome C在联合组明显升高,提示存在线粒体损伤。
综上所述,冬凌草甲素可增强SGC7901人胃癌细胞的放疗敏感性,其机制可能与诱导G2/M期阻滞,增强放疗诱导的细胞凋亡有关,这为冬凌草甲素在放疗增敏中的应用提供了广阔的前景。未来仍需要更多的分子机制研究及动物实验来进一步证实冬凌草甲素的放疗增敏作用。

