超声造影在移植肾功能延迟恢复中的应用
冯梓燕,梁思宇,韩伟,李若兰,蔡名金,严宝妹,邹慧敏,刘韬*
(1.广州医科大学 附属第三医院 超声医学科,广东 广州 510150;2.广州医科大学 附属第三医院 放射科,广东 广州 510150;3.广东省产科重大疾病重点实验室,广东 广州 510150)
近年来,终末期肾脏病(end stage renal diseases,ESRD)的发病率逐渐增高,肾脏移植是ESRD的首选治疗方法[1]。移植肾术后并发症的发生是影响肾移植发展的重要问题。移植肾功能延迟恢复(delayed graft function,DGF)是肾移植术后的一种常见并发症,泛指肾移植后1周内需要行血液透析治疗[2-3],有学者认为结合肾功能的指标评价更为客观[4]。DGF的发生会使临床诊疗更加复杂化,严重影响患者的预后,早期发现DGF并及时采取措施有利于促进移植肾功能的恢复。移植肾活检是鉴别DGF病因的金标准,但其属于有创检查。多普勒超声是肾移植术后常用的检查方法,可发现肾脏的结构与血流动力学改变,DGF的发生与移植肾微循环灌注受损有关,超声造影(contrast-enhanced ultrasound,CEUS)对评价器官的微循环血流灌注情况具有明显优势。然而,目前CEUS在移植肾DGF的应用研究较少,且不同研究对CEUS诊断移植肾DGF的结果不一致[5-6],因此,本研究旨在深入探讨CEUS早期评估移植肾功能的临床意义。
1 资料与方法
1.1 研究对象
回顾性分析2018年11月至2021年10月在我院行同种异体肾移植患者86例,已排除对造影剂过敏、严重心肺功能不全或合并全身性疾病的患者。根据受者术后移植肾功能恢复情况将肾移植受者分为DGF组(n=40)及移植肾功能正常恢复(normal graft function,NGF)组(n=46),所有患者均已签署知情同意书,并获得广州医科大学附属第三医院伦理委员会批准,审批号医伦会审[2022]第068号。在移植术后3~5 d进行超声及CEUS检查。
DGF的诊断标准[2,4]:(1)肾移植术后第1周需要透析治疗;(2)术后早期尿量<1 200 mL/d;(3)术后前3 d每日血清肌酐(Scr)浓度下降少于前1 d的10%或术后1周Scr未下降至400μmol/L。
NGF的诊断标准:(1)肾移植术后1周内尿量逐渐恢复正常,即1 500~2 000 mL/d;(2)无体温升高、血压升高、移植肾肿大及移植肾区压痛等体征。
1.2 仪器与方法
超声检查采用Siemens Acuson S2000彩色多普勒超声诊断仪,选用宽频凸阵4C探头,使用声诺维(SonoVue,Bracco公司)造影剂,常规超声测量移植肾大小、各级动脉血流的收缩期峰值流速(peak systolic velocity,PSV)、阻力指数(resistive index,RI)。CEUS检查时选择声束朝向肾门、且能显示移植肾最大纵轴切面作为观察面,观察移植肾造影过程,选取移植肾中段成像稳定的皮质和髓质内大小约10 mm×10 mm的两个感兴趣区(region of interest,ROI),运用机器自带软件生成时间-强度曲线(time-intensity curve,TIC),获取以下参数:到达时间(arrival time,AT)、达峰时间(time to peak,TTP)、绝对达峰时间(absolutely time to peak,ATTP)、峰值强度(peak intensity,PI)、曲线下面积(area under the curve,AUC)、平均通过时间(mean transit time,MTT),计算两个感兴趣区参数的差值(d),包 括ATd、TTPd、ATTPd、PId、AUCd、MTTd。所采集的数值均为标准切面进行3次测量后取平均值,由两位经验丰富的医师进行图像分析,取两位医师所得的平均值做定量分析,当两者差异大于5%时,请第3位医生再次分析,取3者平均值作为最终结果,若两者对增强模式的判定不一致则请第3位医师共同判定。
1.3 统计学方法
运用SPSS 25.0统计软件进行数据处理分析,计量资料表达为均数±标准差,计数资料用例数和百分比(%)表示;符合正态分布的计量资料间的比较采用t检验、非正态分布间的比较则采用非参数检验;计数资料间比较通过卡方检验或Fisher精确检验,P<0.05为差异有统计学意义。
2 结果
2.1 一般资料比较
共纳入86例患者,其中男66名,女20名,年龄25~62岁,平均(42.8±10.9)岁。两组患者在年龄与性别构成上差异无明显统计学意义(P>0.05);DGF组术后1 d血清肌酐(Scr)、超声检查当天及术后1周Scr均明显高于NGF组(P<0.05),详见表1。

表1 两组患者临床资料比较Table 1 The comparison of clinical data between the two groups
2.2 多普勒超声检查结果比较
DGF组主肾动脉、段动脉及叶间动脉RI均高于NGF组,叶间动脉PSV低于NGF组,两组间差异均有统计学意义(P<0.05);DGF组与NGF组移植肾的体积、主肾动脉及段动脉PSV差异无统计学意义(P>0.05),详见表2。

表2 两组患者多普勒超声指标比较Table 2 The comparison of sonographic features between the two groups
2.3 CEUS检查结果
2.3.1 移植肾CEUS增强模式的比较
NGF组91.3%(42/46)的患者CEUS表现为造影剂由肾动脉、段动脉、叶间动脉、弓形动脉依次增强,随后肾皮质、肾髓质开始分别增强,皮质内造影剂由内向外快速增强,髓质内造影剂自锥体周边向中央呈聚拢式填充,髓质的增强速度较皮质慢,髓质充盈饱满时皮质已渐渐消退。整个造影过程快速连续,移植肾实质增强均匀,形如“火球”状(图1);DGF组移植肾内造影剂增强顺序与NGF组相同,但DGF组造影剂增强速度较慢,且47.5%(19/40)的病例出现与NGF组连续快速增强不一样的增强模式,肾动脉、段动脉、叶间动脉、弓形动脉和皮质区域造影剂呈非连续、“脉冲式”灌注(图2),即造影剂呈现与心脏搏动一致的搏动性灌注,每一次流入之间存在一段无造影剂进入的时间间隔,“脉冲式”增强模式在DGF组出现的概率较NGF组大,差异有统计学意义(P<0.001),详见表3。

表3 两组患者的CEUS增强模式的比较Table 3 The comparison of enhancement patterns with CEUSbetween the two groups n(%)

图1 移植肾功能正常患者CEUS表现Figure 1 The performance of CEUSin NGF
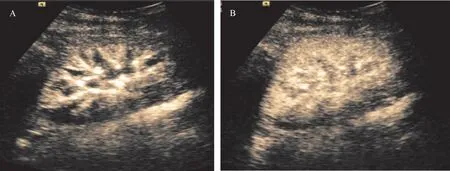
图2 移植肾功能延迟恢复患者CEUS表现Figure 2 The performance of CEUSin DGF
两组患者中,CEUS出现“脉冲式”增强患者的Scr、RI值均高于连续性增强患者,差异有统计学意义(P<0.05),详见表4。

表4 两组患者的CEUS不同增强模式的Scr、RI比较Table 4 The comparison of Scr,RI of different enhancement patterns between the two groups
2.3.2 两组CEUS检查的TIC参数比较
CEUS检查的TIC定量分析显示DGF组皮质、髓质ATTP大于NGF组、AUC小于NGF组,DGF组皮质PI较NGF组减小(P<0.05);两组间AT、TP、MTT及髓质PI差异均无统计学意义(P>0.05),详见表5。

表5 两组患者CEUS检查的TIC参数比较Table 5 The comparison of TIC parameters between the two groups
两组皮、髓质TIC参数差值比较,DGF组ATTPd大于NGF组、AUCd小于NGF组(P<0.05),而两组间的ATd、TPd、PId、MTTd差异无统计学意义(P>0.05),详见表6。

表6 两组患者移植肾皮质与髓质TIC参数差值比较Table 6 The comparison of difference of TIC parameters in cortex and medulla between the two groups
3 讨论
肾移植术后DGF的发生给患者的身心健康以及医师的诊疗决策等方面带来了巨大的考验[7-8],严重影响移植肾以及受者的存活效果。发生移植肾术后DGF的患者若能得到及时诊治,可在一定时间内恢复移植肾功能,因此对移植肾DGF的早期诊断及尽早地临床干预是保护移植肾功能的重要方法。移植肾活检是鉴别DGF病因的金标准,但其作为一项有创操作,存在发生血肿、动静脉瘘以及感染等风险,严重者可造成移植肾功能丧失。超声检查具有无创、便捷、可反复检查等优势,是监测移植肾术后并发症发生的最常用影像学手段。多个研究发现RI对移植肾功能有预测作用[9-10],本研究中也发现与NGF组相比,DGF组移植肾各级动脉RI均增高,提示肾内各级血管的阻力增加。然而,以RI值升高诊断移植肾DGF的灵敏度和特异度仅为47.2%、69.3%[10],同时,RI的检测测值容易受声束与血流方向所成角度的影响,因此,RI值升高用以诊断DGF存在一定局限性。
CEUS检查利用微泡造影剂的背向散射原理结合超声非线性成像技术,极大地提高了超声显像的分辨力、增加诊断的敏感性和特异性,在显示移植肾微循环灌注方面具有明显优势,对移植肾功能的监测以及术后各种并发症的诊断具有重要作用[11-14]。此外,CEUS使用的造影剂经呼吸运动排出体外,对移植肾功能无损伤,不同机构对CEUS检查的大量实验与临床研究也证明CEUS检查的安全性高[15],因此,可以多次检查评估移植肾功能。研究发现,移植肾发生DGF与缺血再灌注损伤有关,受损组织释放的炎症因子和氧化应激产物引起血管的损伤、缺氧、有功能肾单位的减少等改变,导致移植肾的血流灌注受损[16]。
本研究发现两组患者造影增强模式存在差异,DGF组中部分呈“脉冲式”增强,且出现“脉冲式”增强患者的Scr、RI值明显高于连续性增强患者。分析DGF发生的病理机制,出现“脉冲式”增强的原因可能为移植肾出现间质水肿、肾小管损伤、血管内皮细胞肿胀和脱落、管壁纤维素样坏死等改变,造成微动脉血流灌注阻力增加[17],从而导致造影剂灌注受阻及移植肾滤过功能受损。本研究通过对部分DGF患者进行连续CEUS监测,发现随着移植肾功能的好转,“脉冲式”增强的表现逐渐减弱,即造影剂“脉冲式”增强的时间间隔逐渐缩短,灌注速度逐渐加快。因此,“脉冲式”增强可能为DGF早期的特征性表现,造影剂“脉冲式”增强时间间隔逐渐缩短或许可用于评估DGF的临床疗效。
CEUS不仅能动态观察移植肾内造影剂的增强模式,还可以运用TIC对移植肾的微循环灌注进行定量分析[18-19];本研究发现DGF组实质AUC、皮质PI均低于NGF组,提示发生DGF时,移植肾的血流灌注量减少,与蔡款等[6]研究结果不同,可能与两者的样本量存在差异有关。本研究中,DGF组皮、髓质ATTP较NGF组明显延长,移植肾造影剂增强速度减慢,这可能与DGF的各种病理改变导致移植肾的血流灌注阻力明显增加、造影剂进入速度减慢有关,与Grzelak等[20]研究结果一致。DGF组ATTPd大于NGF组、AUCd小于NGF组,这意味着CEUS检查时DGF组移植肾造影剂由皮质进入髓质的阻力增大,与其病理改变相符。此外,本研究通过对比两组移植肾皮质与髓质ROI的TIC参数,发现DGF组AUCd小于NGF组,这可能与肾脏皮质与髓质的解剖结构及生理功能不同有关,肾脏不同部位的血流量存在明显差异,其中皮质血流约占94%,在移植肾发生DGF时血流灌注减少,血流分布较丰富的肾皮质所受影响更大,而肾髓质血流灌注变化较小[21],因此反应移植肾整体灌注的皮质与髓质的AUC差值变化减小。本研究在移植肾皮质和髓质分别选取ROI进行研究,并将两者的TIC参数进行比较,充分考虑到移植肾皮质和髓质的血流动力学差异,与选取整个实质区为ROI相比,可以更精细地分析实质不同部位的灌注情况。
CEUS可以实时动态观察移植肾的增强模式,“脉冲式”增强可能为DGF早期的特征性表现,移植肾增强模式的改变或许能预测肾功能的变化。TIC定量分析技术能够客观评价移植肾实质的血流微循环灌注,为移植肾术后的功能状态提供客观的评价依据。然而,动态观察移植肾增强模式具有一定主观性,且本研究病例数有限,对移植肾CEUS定量分析的结果还需要更大样本量的研究进一步证明。
综上所述,CEUS为临床检测移植肾术后DGF的发生及诊疗效果提供了一种直观的无创检查方法,可弥补多普勒超声检查的不足,具有较好的临床应用价值。
作者贡献声明
冯梓燕:提出研究思路和框架,查阅文献,撰写并修改论文;邹慧敏:查阅文献,撰写并修改论文;蔡名金:参与论文写作思路的修改;严宝妹:查阅文献,撰写并修改论文;梁思宇:查阅文献,收集资料;韩伟:收集资料;李若兰:收集资料;刘韬:参与、指导论文的撰写和修改。
利益冲突声明
本研究未受到企业、公司等第三方资助,各作者之间不存在潜在利益冲突。

