真实世界中帕博利珠单抗治疗晚期非小细胞肺癌的有效性与安全性Meta分析
何梓健,万宁,梁蔚婷,杨蓓蓓,张建萍,季波
(1.暨南大学 药学院,广东 广州 510632;2.中国人民解放军南部战区总医院 临床药学科,广东 广州 510010;3.国家老年疾病临床医学研究中心(解放军总医院)广东分中心,广东 广州 510010;4.中山大学肿瘤防治中心 药学部∥华南肿瘤学国家重点实验室∥肿瘤医学协同创新中心,广东广州 510060;5.宝鸡市中心医院 临床药学科,陕西 宝鸡 721008)
肺癌是全球发病率和致死率都较高的恶性肿瘤(每年新增确诊病例超过210万例,死亡病例超过180万例)。非小细胞肺癌(non-small cell lung cancer,NSCLC)约占肺癌的85%。晚期才被确诊为NSCLC的患者超过七成,耽误了绝佳的治疗时机,失去了根治性手术治疗的机会,导致预后不良且疾病负担沉重,5年存活率低[1-5]。
根据综合癌症网络(national comprehensive cancer network,NCCN)发布的2022.V1版《非小细胞肺癌临床实践指南》里推荐的治疗方法,包括放化疗、靶向治疗和免疫治疗[6-7]。免疫治疗与前两种治疗的区别是,它作用的靶点不是癌细胞,而是人体免疫系统。免疫治疗通过激活人体免疫系统,增强自身免疫功能杀灭癌细胞。免疫检查点程序性死亡受体1(programmed cell death 1,PD-1)与程序性死亡受体配体1(programmed cell death ligand 1,PD-L1)结合可介导免疫逃逸,使癌细胞避开免疫系统的攻击。免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)可通过阻断PD-1与PD-L1的结合,抑制免疫逃逸、重启免疫应答,恢复T细胞的识别能力与杀伤活性,抑制癌细胞的生长[8]。作为ICIs的代表药,帕博利珠单抗(pembrolizumab)是一种人源化的抗PD-1的IgG4单克隆抗体,通过与PD-1受体结合,抑制PD-1与PD-L1结合导致的免疫逃逸。帕博利珠单抗于2015年被美国食品药品监督管理局(U.S.Food and Drug Administration,FDA)批准于美国上市。2018年9月肿瘤免疫治疗巨头美国默克集团宣布,欧洲药监局(European Medicines Agency,EMA)已批准PD-1肿瘤免疫疗法帕博利珠单抗联合培美曲塞及铂类化疗(顺铂或卡铂),一线治疗无表皮生长因子受体(epidermal growth factor receptor,EGFR)或间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)阳性突变的转移性非鳞状NSCLC成人患者[9]。在我国,由国家药品监督管理局(National Medical Products Administration,NMPA)批准,帕博利珠单抗获批的适应证有3个:①一线单药治疗适用于PD-L1肿瘤比例分数(tumor percentage score,TPS)≥1% 的EGFR基因突变阴性和ALK阴性的局部晚期或转移性NSCLC;②一线联合化疗适用于EGFR基因突变阴性和ALK阴性的转移性非鳞状NSCLC;③一线联合化疗适用于转移性鳞状NSCLC。
随机临床试验(randomised clinical trial,RCT)研究发现,在PD-L1肿瘤比例评分(tumor proportion score,TPS)≥50%的晚期NSCLC患者中,使用帕博利珠单抗治疗的患者,临床获益明显优于使用传统铂类进行化疗的患者[10-12]。虽然RCT研究可以很好地控制混杂因素对结果的影响,提高对结果内部效度的把握,但也正因为RCT的严格限制,如RCT的患者入组标准十分严格,很多RCT排除了美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)体能状态评分≥2分的,以及年龄较大的,病情复杂的患者(如合并脑转移、肝转移、既往有放疗史、化疗史等)[13],其所得结论外推到实际医疗环境中会产生差异。RCT入组的患者由于纳排标准较严格,导致其相关情况与真实世界的患者有一定的区别,因此RCT的结果不能简单外推应用到真实世界的患者中。RCT的临床疗效以及毒性反应,仍需真实世界研究(real world study,RWS)结果进一步证实。真实世界研究,即在真实世界环境下收集与患者有关的数据,通过整理和分析,获得帕博利珠单抗的使用价值及潜在获益或风险的临床证据。本研究旨在通过已发表的真实世界研究来进行Meta分析,探讨在真实世界中的帕博利珠单抗治疗晚期非小细胞肺癌的有效性与安全性。
1 材料和方法
1.1 纳入和排除标准
1.1.1 纳入标准
(1)公开发表的在真实世界中帕博利珠单抗治疗晚期NSCLC的有效性或安全性的研究;(2)所有病例必须经影像学和病理组织确诊为非小细胞肺癌;(3)包含或可计算得出的有效性结局指标和(或)安全性结局指标。
1.1.2 研究对象
确诊为NSCLC的患者,性别、年龄、种族、患病时间等不限。
1.1.3 干预措施
使用帕博利珠单抗单药治疗或联合化疗治疗为试验组,剂量与疗程不限。
1.1.4 结局指标
有效性结局指标:客观缓解率(objective response rate,ORR)、疾病控制率(disease control rate,DCR);安全性结局指标:不良反应发生率,因为不良反应而终止治疗的发生率和3~5级不良反应发生率(经过药物关联性评价均为帕博利珠单抗所致的不良反应)。
1.1.5 排除标准
(1)无法提取相关研究数据;(2)试验组或对照组的样本量小于15例的小样本研究;(3)二线或以上接受帕博利珠单抗治疗晚期NSCLC的研究;(4)患者使用了其他的ICIs的研究;(5)低质量文献;(6)排除非英文非中文文献;(7)同一临床研究在多个出版物中发表,以最完整和最新的版本为准,其余予以排除。
1.2 文献检索策略
检索的数据库:Cochrane Library、PubMed、EMBase、中国知网数据库、维普中文科技期刊数据库、万方医学数据库。以非小细胞肺癌、帕博利珠单抗(或可瑞达)为中文检索的主题词。两个中文主题词之间以“AND”连接;以non-small cell lung cancer、pembrolizumab(or keytruda)为英文检索的主题词,两个英文主题词之间以“AND”连接。检索时限为建库到2021年6月11日,检索不受发表文献类型的限制。
1.3 文献筛选及数据提取
根据事先设计的表格,由2名研究者独立对文献进行筛选和数据提取,并相互核对,若有意见不统一的则通过讨论或第三方解决。提取的资料包括纳入文献的基本资料(名称、作者、研究对象等)、结局指标和临床基线资料(如吸烟史、性别、年龄等)。
1.4 文献质量评价
使用MINORS量表[14]进行文献质量评价。MINORS量表可用于非对照研究评价。评价指标为共有8条,每条2分(0分表示该指标未报道,1分表示已报道但不充分,2分表示已报道并充分),总分16分,视13~16分为高质量并纳入。
1.5 统计学方法
本研究为单臂Meta分析。使用Stata14.0软件来统计分析的文献数据。对于Meta分析的Stata操作,并非采用传统的实现方法,而是使用王佩鑫等[15]的操作方法,实现类似于横断面研究的无对照组Meta分析(单臂Meta分析)。采用单臂Meta分析对试验组的ORR、DCR、不良反应发生率、3~5级不良反应发生率和因为不良反应而终止治疗的发生率进行合并分析,以ES为效应指标(反映具体事件的发生率),并给出95%可信区间(confidence interval,CI)。对纳入的研究进行异质性检验,若纳入研究间无异质性(P>0.1且I2<50%)时,采用固定效应模型进行合并分析;若存在则用随机效应模型。对异质性较大的结果,分析异质性来源,并进行亚组分析;若相应统计量不足或异质性过大,则进行描述性分析。亚组分析的效应量为比值比(odds ratio,OR)和组间差异P,P<0.05被认为具有统计学意义。研究间的发表偏移通过漏斗图来判断,结果的稳定性采用敏感性分析来判断。
2 结果
2.1 文献筛选结果与纳入研究基本信息
通过上述的检索方法初检出文献共2 345篇(英文2 233篇,中文112篇),将检索到的文献导入Endnote软件进行管理。使用Endnote删除重复文献后,通过阅读标题、摘要和全文,再剔除不符合纳排标准的文献,最终纳入文献16篇,均为真实世界的回顾性队列研究,详见图1。
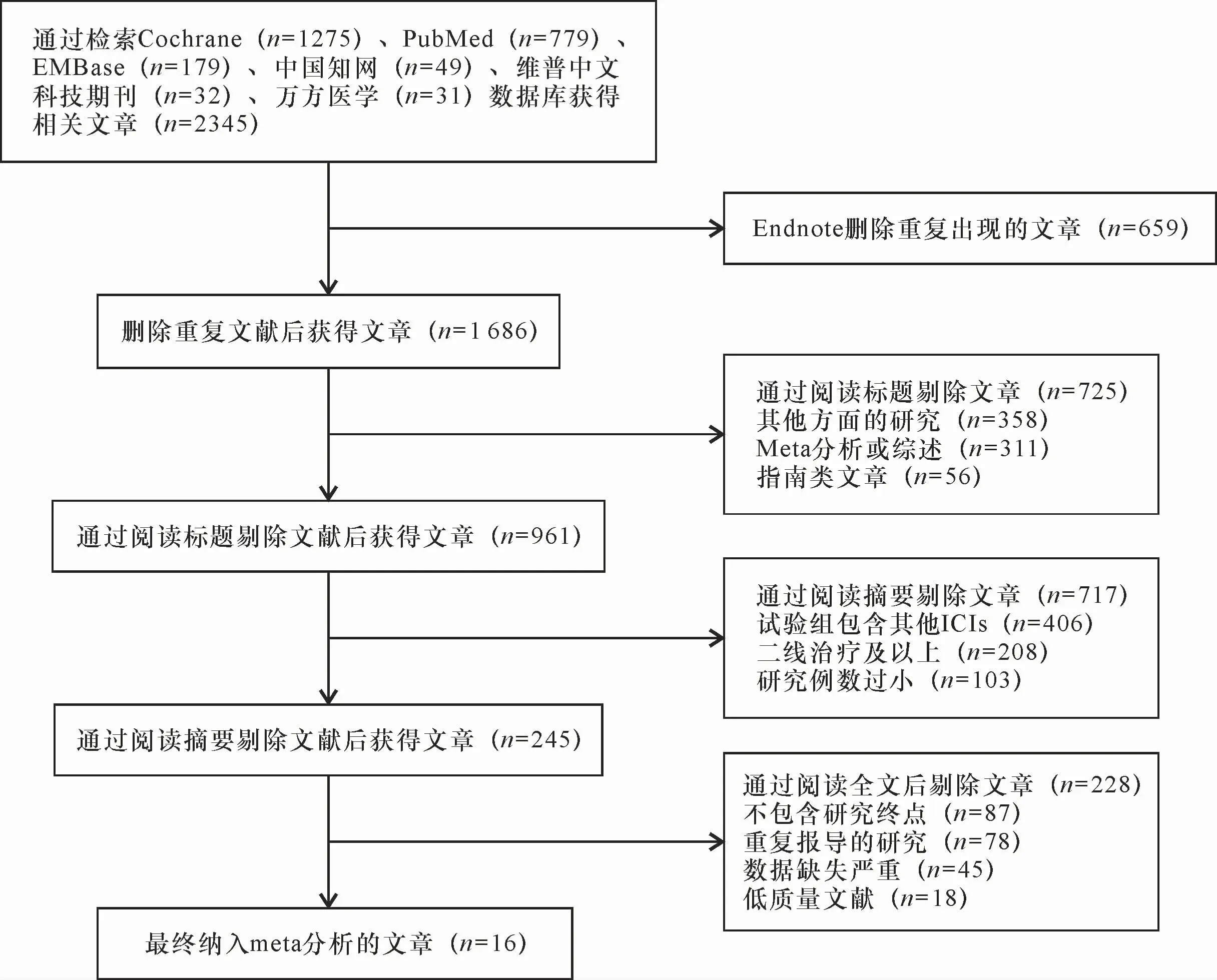
图1 文献检索结果和具体筛选流程Figure 1 Literature search results and specific screening process
2.2 纳入文献特征
共纳入16篇文献[16-31],均为真实世界研究,其中包括5篇单中心回顾性队列研究,11篇多中心回顾性队列研究,病人例数总共3 699例。其中符合纳入及排除标准且最少有1个有效性指标,被纳入有效性分析的有15篇文献;安全性分析中纳入了10篇文献。有效性分析一共有3 509例NSCLC患者;安全性分析一共有2 357例NSCLC患者。纳入的NSCLC患者有3 493例TNM分期为Ⅳ期,其余的206例大多为Ⅲ期或复发类病人,符合晚期NSCLC患者的范畴。纳入分析的文献的基本特征见表1。
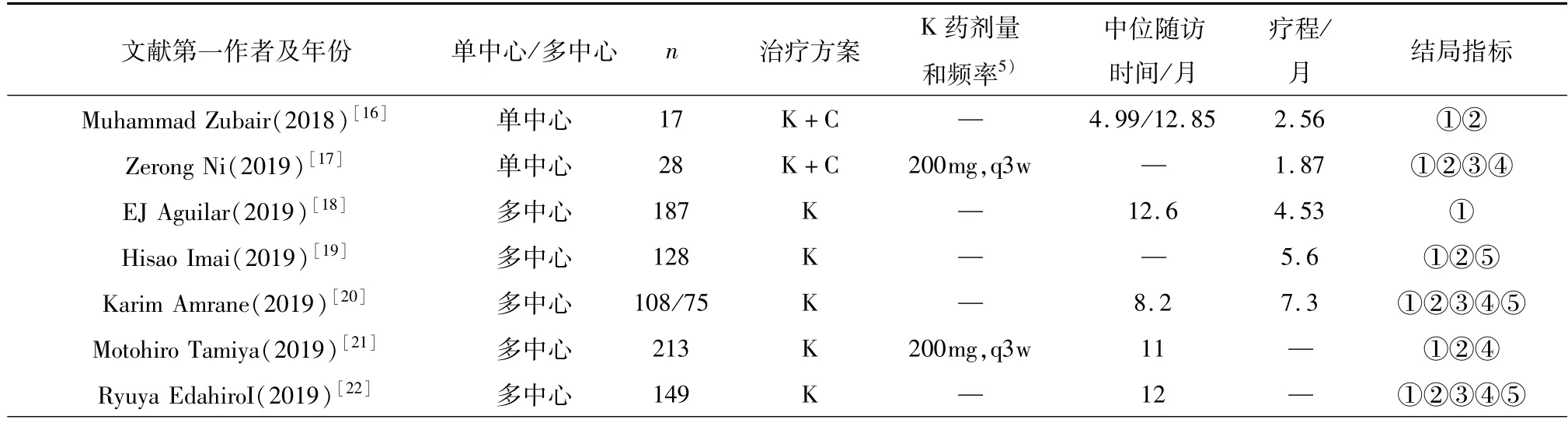
表1 纳入文献的基本特征与信息Table 1 Basic characteristics and information of the included literature

(续表)
2.3 纳入文献的质量评价结果
本研究共纳入的16篇回顾性研究,通过MINORS量表进行文献质量评价,均为高质量文献,详见表2。

表2 文献的质量评估Table 2 Quality assessment of literature
2.4 Meta分析结果
2.4.1 有效性
15篇文献[16-22,24-31]对ORR进行了统计与记录。对15篇文献的ORR进行Meta分析,发现存在统计学异质性(P=0.094,I2=34.4%),采用随机效应模型进行合并分析。结果如图2所示,合并的帕博利珠单抗组的3 480名患者的ORR为47%(95%CI:45%~49%)。

图2 帕博利珠单抗治疗晚期NSCLC客观缓解率(ORR)的Meta分析森林图Figure 2 Meta-analysis forest plot of the objective response rate(ORR)of pembrolizumab in the treatment of advanced NSCLC
10篇文献[16,17,19-22,28-29,31]对DCR进行了统计与记录。对这10篇文献的DCR进行Meta分析,显示存在统计学异质性(P=0.031,I2=51.1%),采用随机效应模型来进行合并分析。结果如图3所示,合并的帕博利珠单抗组的1 069名患者的DCR为75%(95%CI:71%,79%)。
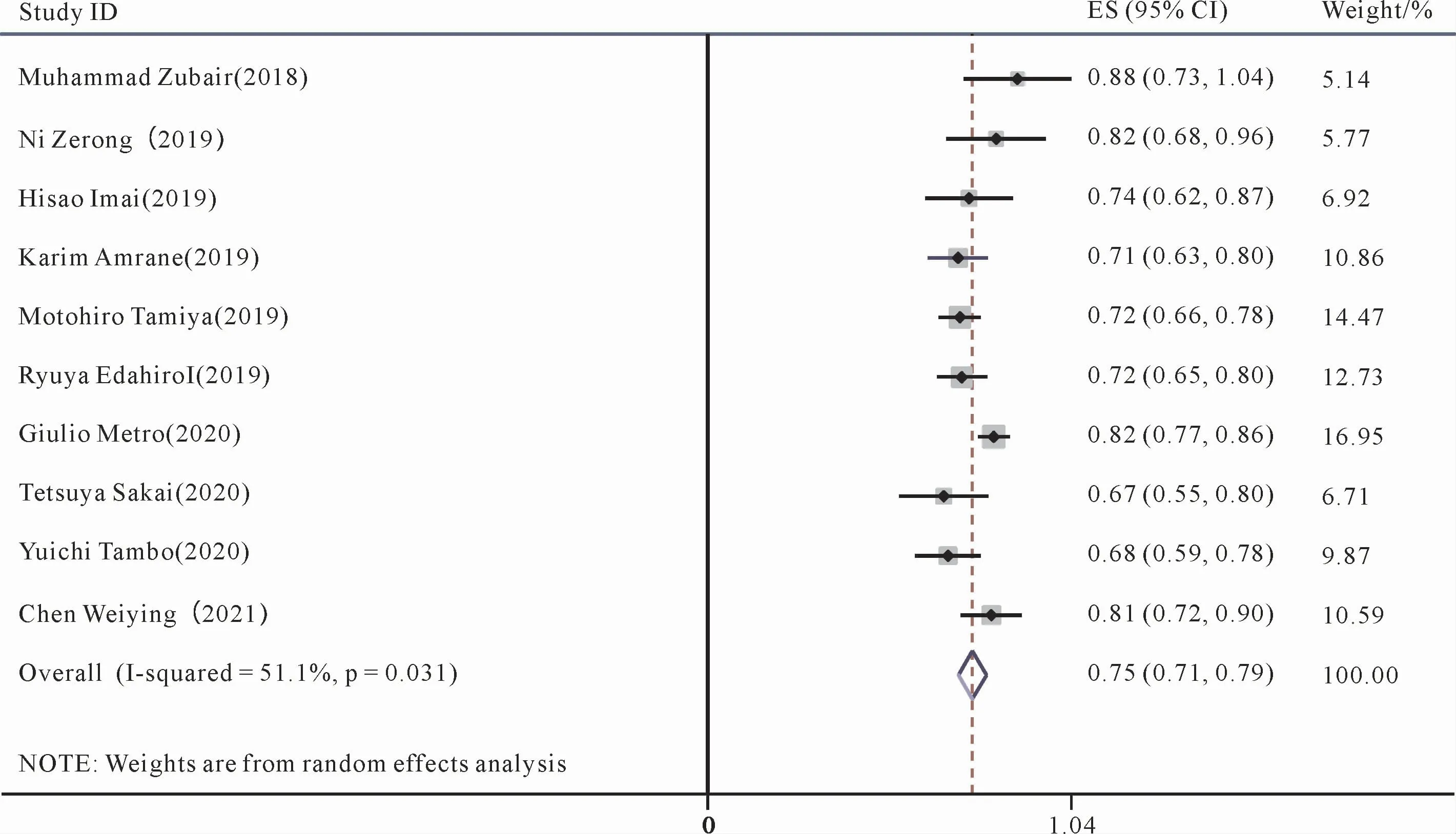
图3 帕博利珠单抗治疗晚期NSCLC疾病稳定率(DCR)的Meta分析森林图Figure 3 Meta-analysis forest plot of the disease stability rate(DCR)of pembrolizumab in the treatment of advanced NSCLC
2.4.2 安全性
7篇文献[17,20,22-23,25-26,29]对不良反应发生率进行了统计与记录。对7篇文献的不良反应发生率进行Meta分析,显示存在统计学异质性(P=0.015,I2=62.2%),采用随机效应模型来进行合并分析。结果如图4所示,帕博利珠单抗组的1 534名患者的不良反应发生率为37%(95%CI:32%,42%)。
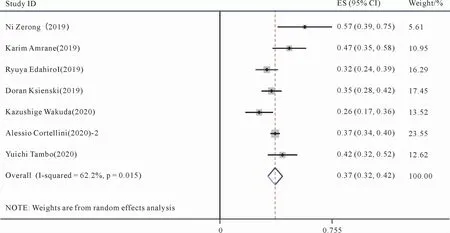
图4 帕博利珠单抗治疗晚期NSCLC不良反应发生率的Meta分析森林图Figure 4 Meta-analysis forest plot of the incidence of adverse reactions of pembrolizumab in the treatment of advanced NSCLC
8篇文献[17,20-23,25-26,29]对3~5级不良反应发生率进行了统计与记录。对8篇文献的3~5级不良反应发生率进行Meta分析,显示存在异质性(P<0.1,I2=77.4%),采用随机效应模型来进行合并分析。结果如图5所示,帕博利珠单抗组的1 747名患者的3~5级不良反应发生率为12%(95%CI:8%,15%)。
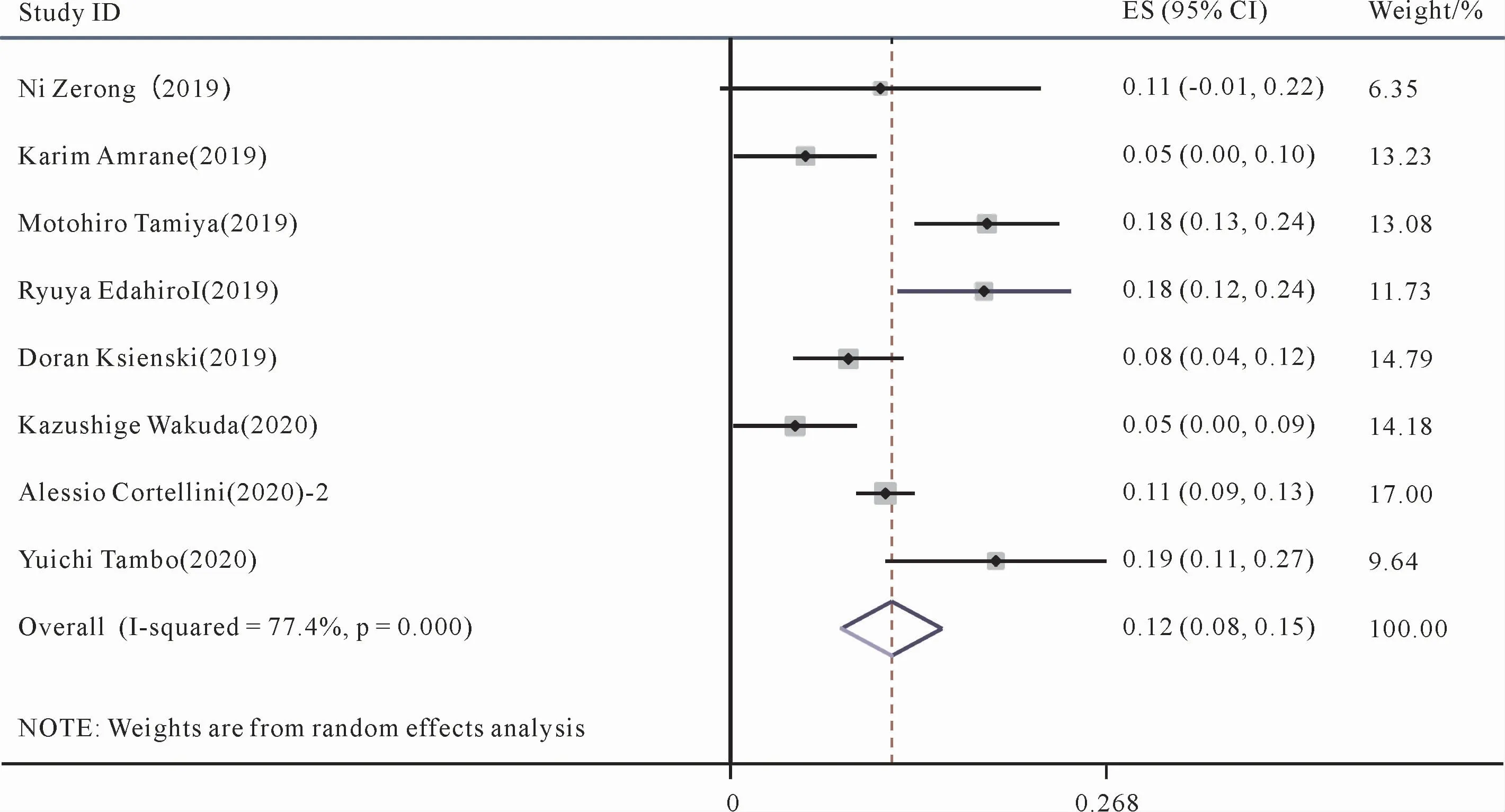
图5 帕博利珠单抗治疗晚期NSCLC 3-5级不良反应发生率的Meta分析森林图Figure 5 Meta-analysis forest plot of the incidence of grade 3-5 adverse reactions of pembrolizumab in the treatment of advanced NSCLC
7篇文献[17-18,20-24]对因不良反应而终止治疗的发生率进行了统计与记录。对7篇文献的因为不良反应而终止治疗的发生率进行Meta分析,显示存在统计学异质性(P=0.012,I2=63.5%),采用随机效应模型来进行合并分析。结果如图6所示,合并的帕博利珠单抗组的1 740名患者的因不良反应而终止治疗的发生率为8%(95%CI:6%,11%)。
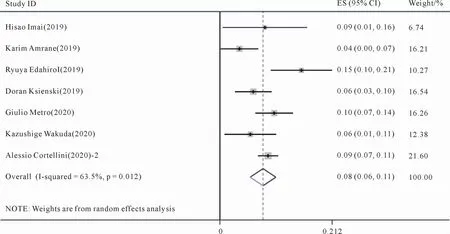
图6 帕博利珠单抗治疗晚期NSCLC因不良反应而终止治疗(LTD)的发生率的Meta分析森林图Figure 6 Meta-analysis forest plot of the incidence of pembrolizumab in the treatment of advanced NSCLC with discontinuation of treatment(LTD)due to adverse reactions
对8篇文献的3~5级不良反应事件进行收集,最终纳入7篇文献,共169例3~5级不良反应事件,对其进行分类汇总如表3所示。
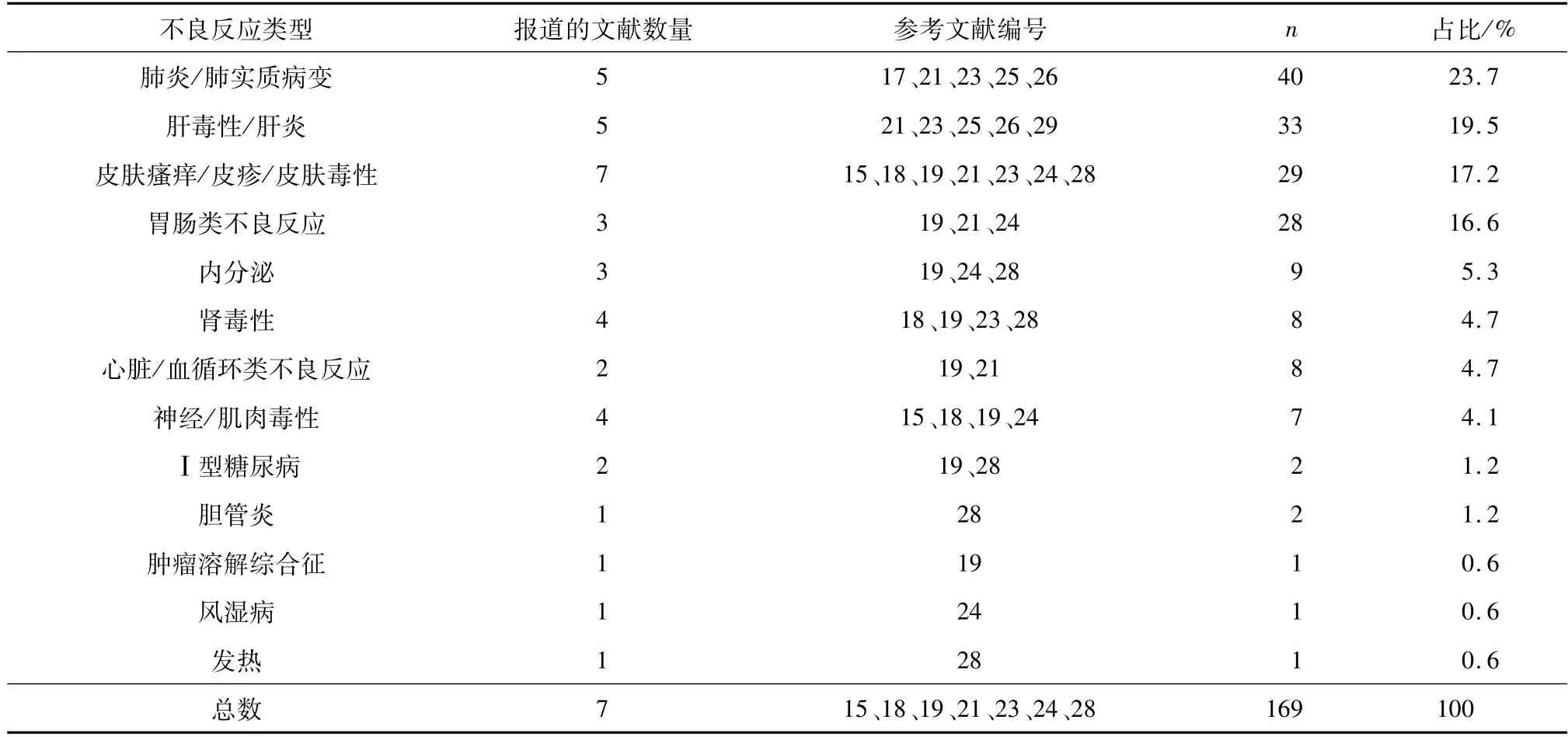
表3 3~5级不良反应汇总Table 3 Summary of Grade 3~5 adverse rea
2.4.3 亚组分析
本研究从晚期NSCLC患者的ECOG评分、PD-L1表达水平、脑转移率、病理组织学类型、性别、年龄对ORR进行亚组分析。结果如表4所示。亚组分析结果发现晚期NCLCC患者的ECOG评分、PD-L1表达水平可能影响帕博利珠单抗治疗晚期非小细胞肺癌的疗效。

表4 帕博利珠单抗治疗晚期NSCLC患者客观缓解率(ORR)的亚组分析Table 4 Subgroup analysis of objective response rate(ORR)of pembrolizumab in patients with advanced NSCLC
在ECOG评分的亚组分析里,分为ECOG评分0~1组和ECOG评分≥2组,使用随机效应模型进行合并,得到ECOG评分0~1组ORR达49%(95%CI:47%,52%),两个亚组之间的组间差异具有统计学意义,OR为2.52(95%CI:1.91,3.32),因此可得ECOG评分0~1的患者临床获益相对较好。在PD-L1表达水平的亚组分析中,纳入6篇文献,共986例患者,分为PD-L1=90%~100%组和PD-L1=50%~89%组,使用随机效应模型进行合并,PD-L1=90%~100%组的患者ORR较高(56%,95CI%:50%,62%)。组间差异,OR为1.83(95%CI:1.36,2.45),即PD-L1表达水平90%~100%组的疗效较好。在脑转移率的亚组分析中,分为无脑转移史和有脑转移史两个亚组,采用固定效应模型进行合并,没有脑转移史的病人ORR为46%(95%CI:43%,49%)。两亚组的比值比OR=1.21(95%CI:0.90,1.62),说明相对于有脑转移的病人,无脑转移的病人疗效存在更好的疗效趋势,但差异不显著。在病理组织学类型的亚组分析中纳入6篇文献,分为鳞状组和非鳞状组,采用随机效应模型进行合并,组间差异无统计学意义。在性别亚组分析中,分为女性组和男性组,使用随机效应模型进行合并得出,组间差异无统计学意义。在年龄的亚组分析中,分为患者≥70岁组和患者<70岁组,采用固定效应模型进行合并得出,组间差异无统计学意义。
2.4.4 发表偏倚及敏感性分析
真实世界研究中帕博利珠单抗治疗晚期非小细胞肺癌患者ORR的发表偏倚分析见图7。漏斗图显示纳入的研究主要分布在漏斗的内侧,说明纳入文献的发表偏倚较小。进一步通过Peters检验对纳入文献的发表偏倚进行量化分析,各项研究间不存在发表偏倚(P=0.28)。

图7 帕博利珠单抗治疗晚期非小细胞肺癌发表偏倚分析的漏斗图Figure 7 Funnel plot of publication bias for pembrolizumab in the treatment of advanced NSCLC
对ORR的合并结果进行敏感性分析(图8)。敏感性分析的横坐标为15篇文献合并后ORR的效应量及其95%CI,纵坐标为15篇文献。逐一剔除文献后,总结果变化轻微,故认为结果较稳可靠。
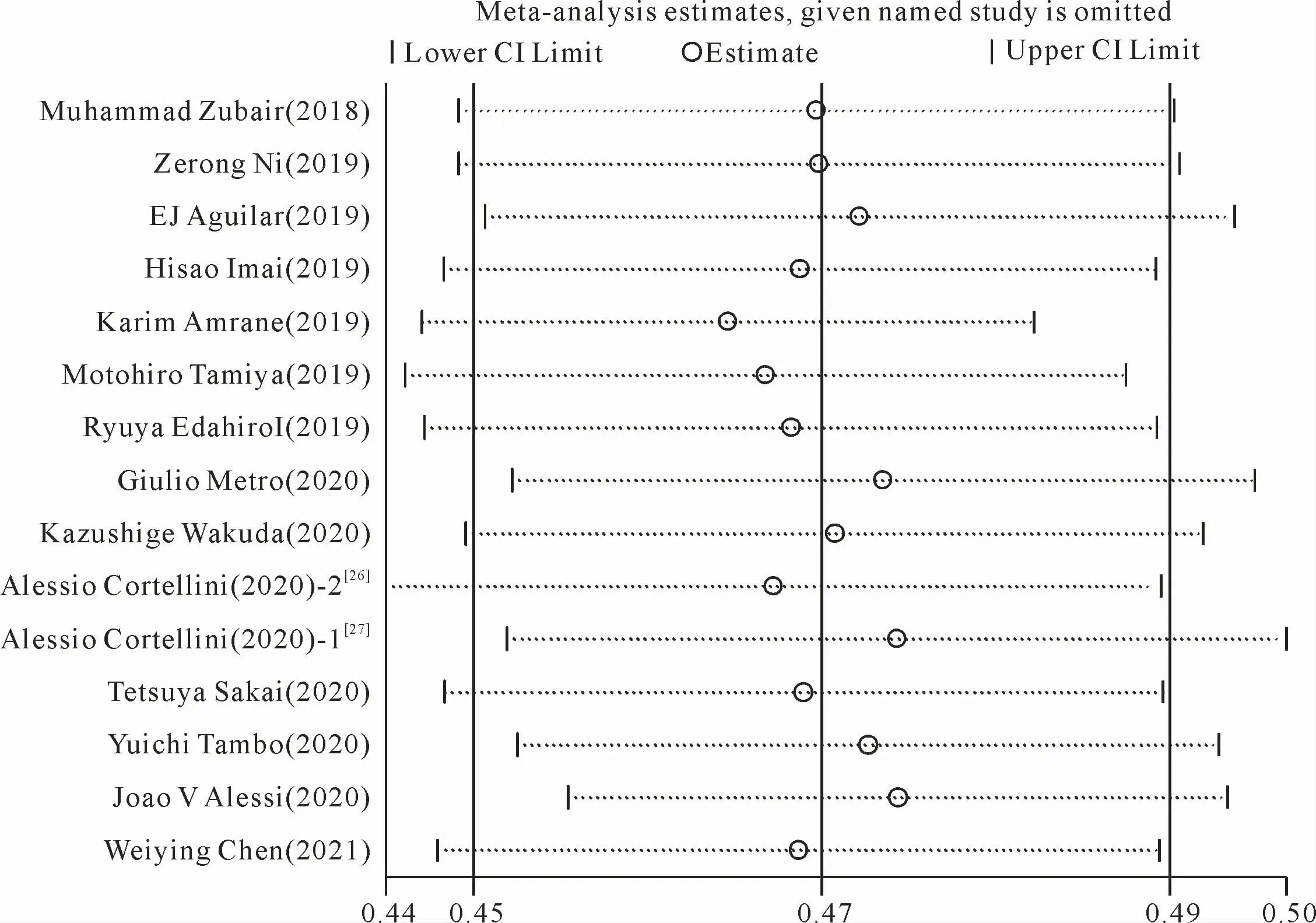
图8 帕博利珠单抗治疗晚期NSCLC的15篇文献敏感性分析Figure 8 Sensitivity analysis of 15 literatures on pembrolizumab in the treatment of advanced NSCLC
3 讨论
本研究最终纳入了16篇真实世界研究,纳入人群多为PD-L1高表达人群,患者治疗方案多为帕博利珠单抗单药方案。经过Meta分析合并后得出ORR为47%(95%CI:45%,50%)、DCR为75%(95%CI:71%,79%)、不良反应发生率为37%(95%CI:31%,42%)、3~5级不良反应发生率为11%(95%CI:8%,15%)、因不良反应而终止治疗的发生率为8%(95%CI:6%,10%)。在Keynote-024的Ⅲ期RCT研究中,当PD-L1表达水平为≥50%、EGFR突变和ALK重排阴性时,发现接受一线帕博利珠单抗治疗的NSCLC患者的总体存活率要比含铂双联化疗高,ORR为44.8%,中位无进展生存期(mPFS)为10.3个月,中位总生存期(mOS)为30.0个月,本研究的Meta分 析结果ORR 为47%(95%CI:45%,50%),与其接近[4,32]。有关的Meta分析发现帕博利珠单抗联合化疗治疗晚期NSCLC的3~5级免疫相关的不良反应发生率为9.2%(68/742),与本研究合并得出的3~5级不良反应发生率(11%)接近[10]。因为帕博利珠单抗作用的对象是免疫细胞,所以相对于传统的直接作用癌细胞的化疗药物,其不良反应相对较少、严重程度也相对较低。但是这也取决于ECOG评分、PD-L1表达等具体患者情况[33-35]。
有RCT研究发现,帕博利珠单抗也有特异的不良反应,如毛霉菌性肺炎、结肠炎等,虽然不良反应的发生率较低,但也应当引起足够的重视。此研究还发现,采用帕博利珠单抗的常用剂量下的339名患者,3~5级治疗相关不良事件发生率为13%[36],国内也有关注帕博利珠单抗不良反应的真实世界研究,发现60例患者不良反应发生率为35%,并且有毛霉菌性肺炎患者和结肠炎患者死亡的病例[37]。此外,还有研究发现帕博利珠单抗联合化疗不会增加不良反应发生率[38-41]。本Meta分析发现帕博利珠单抗不良反应大部分较轻,但也有少数特异性不良反应,可能会危及患者的生命。在应用帕博利珠单抗治疗晚期NSCLC时,无论是单药还是联合化疗,都应加强不良反应监测并及时处理,防止严重不良反应危害患者的生命[42-43]。本研究亚组分析结果发现PD-L1表达水平高、ECOG评分低可能与临床获益良好有关。
本研究也存在一定局限性。各研究之间异质性较大,可能来源于各研究之间的患者年龄、性别、PD-L1表达水平、其他用药方案、药物种类,患者种族等因素。此外检索到的真实世界研究大多是非对照研究,因此不能使用统计学方法统计PFS和OS的相对危险比。另外,由于帕博利珠单抗在中国上市的时间较晚,国内的相关研究较少,纳入的患者多为外国人。
综上所述,帕博利珠单抗真实世界研究Meta分析显示,在PD-L1高表达人群中,帕博利珠单抗具有较好的有效性及安全性,且对于PD-L1≥90%,PS评分0~1人群临床受益更为良好,但是缺乏长期疗效的评估。本研究中纳入研究存在样本量较小的问题,还需要继续开展帕博利珠单抗多中心真实世界研究。
作者贡献声明
何梓健:完成有效性、安全性、亚组分析、发表偏倚、敏感性分析、结果和讨论以及论文的主体书写;万宁:指导论文及修改论文,为基金项目负责人;梁蔚婷:修改论文,提供方法学的指导;杨蓓蓓:完成检索与筛选论文的主要工作;张建萍:修改论文,提供总体指导;季波:修改论文,指导方向。
利益冲突声明
本研究未受到企业、公司等第三方资助,不存在潜在利益冲突。

