GSK-J4对人结肠癌细胞的增殖抑制作用
郑稳稳,李安祺,刘子建,张存龙
(1.暨南大学 药学院,广东 广州 510632;2.深圳市坤健创新药物研究院,广东 深圳 518110;3.清华大学 深圳国际研究生院,广东 深圳 518000)
结直肠癌是一种消化道肿瘤,根据2022年美国癌症协会(American Cancer Society,ACS)的统计,其新发病率处于所有癌症中的前3位,且发病年龄日趋年轻化,严重威胁着人类的健康[1]。表观遗传调控异常作为癌症的重要特征[2],在癌症的发生发展过程中扮演着重要的角色[3-4],因此靶向表观遗传靶点是结直肠癌治疗的重要手段。
组蛋白的甲基化修饰是表观遗传调控的重要组成部分,它主要由组蛋白甲基转移酶(histone lysine methyltransferases,HMT)和组蛋白去甲基化酶(histone lysine demethylases,KDM)来执行[5]。JMJD3(Jumonji domain-containing protein 3)也称KDM6B,是组蛋白去甲基化酶KDM6家族的一种亚型,可以特异性催化组蛋白H3上第27位赖氨酸(H3K27)侧链的去甲基化,增强原癌基因的转录并促进癌症的发生发展[6-7]。H3K27上的甲基化水平异常和JMJD3蛋白的表达异常在多种肿瘤细胞中被发现,并在肿瘤的增殖、转移及去分化过程中起促进作用[8-9]。因此,开发JMJD3的小分子抑制剂是相关癌症靶向治疗的可行方案。
现已发现的JMJD家族的抑制剂包括琥珀酸[10]、戊邻酮二酸类[11]、铑金属络合物[12]及黄酮醇类似物[13]等。2012年Kruidenier等[14]报道了JMJD3抑制剂GSK-J1,并改造出细胞膜穿透效率更高的乙酯侧链化合物GSK-J4。现有研究显示,化合物GSK-J4可以有效地抑制JMJD3的活性,并且在儿童脑干神经胶质瘤[15]、急性淋巴细胞白血病[9]、成神经细胞瘤[16]、乳腺癌[17]及肺腺癌[18]等癌症的治疗中发挥了一定的效果。
以上研究表明JMJD3抑制剂GSK-J4对多种癌症有抑制作用,但是其在结直肠癌的研究依然相对欠缺。因此,本文将研究GSK-J4对人结肠癌细胞的抑制作用,对癌细胞的增殖、侵袭、凋亡、细胞周期等进行分析,并通过细胞内相关蛋白水平的检测探讨其中的作用机理。
1 材料与方法
1.1 试剂与仪器
细胞:人结肠癌细胞HCT116、DLD-1、SW480、SW620、LoVo和HT-29均购于中国科学院上海细胞库。
药品与试剂:GSK-J4,CAS:1797983-09-5,购于Selleck公司。噻唑蓝(MTT),CAS:298-93-1,购于上海生工生物科技有限公司。Annexin V-FITC/PI Apoptosis Detection Kit(货号:40302ES20)和细胞周期与细胞凋亡检测试剂盒(货号:40301ES100)均购于上海翊圣生物科技有限公司。McCoy's 5a(货号:PM150710)、Ham's F-12K(货号:PM150910)和Leibovitz's L-15(货号:PM151010)培养基,购于武汉普诺赛(Procell)生命科技有限公司。RPMI-1640培养基(货号:10-040-CVRC)购于CORNING公司。胎牛血清(FBS):购于默克Sigma公司。β-Actin抗体,货号AA128,购于碧云天公司。Histone H3(货号:4499S)、Mono-Methyl-Histone H3(Lys27,货号:84932S)、Di-Methyl-Histone H3(Lys27,货 号:9728S)、Tri-Methyl-Histone H3(Lys27,货号:9733S)、p27 Kip1(货号:2552P)、Cleaved Caspase-7(Asp198,货号:9491S)、Cleaved PARP(Asp214,货号:9541S)抗体均购于Cell Signaling Technology公司。
仪器:DTX880 型多功能检测酶标仪(Beckman Coulter公司)、MoFlo XDP流式细胞仪(Beckman Coulter公司)、BIO-RAD GelDoc XR凝胶成像仪(BIO-RAD公司)。
1.2 研究方法
1.2.1 细胞培养
HCT116和HT-29使用McCoy's 5a培养基,DLD-1使用RPMI-1640培养基,LoVo使用Ham's F-12K培养基,以上细胞的培养条件为37℃,CO2浓度为5%。SW480和SW620使用Leibovitz's L-15培养基,条件为37℃,无须补充CO2。所有的培养基中均加入10% FBS使用。
1.2.2 MTT法测定细胞抑制率
将细胞悬液接种于96孔板中,每孔100μL,细胞数为5 000个。过夜培养,向孔板中加入不同浓度的GSK-J4,培养72 h。每孔加入10μL 5 mg/mL的MTT溶液,继续培养4 h。除去培养液,每孔加入100μL DMSO溶解结晶物,在酶标仪490 nm处测量各孔的吸光值。细胞抑制率=1-(D实验组-D空白组)/(D对照组-D空白组),实验设置3个复孔,并重复3次。
1.2.3 Western Blot实验检测蛋白质表达水平
在对数期细胞的培养基中加入不同浓度的GSK-J4,培养24 h后,裂解细胞并提取总蛋白。使用二辛可宁酸法(BCA)测定蛋白的浓度,并煮沸变性,以SDS-聚丙烯酰胺凝胶电泳分离细胞蛋白。将蛋白转膜到硝化纤维膜,以5%脱脂牛奶封闭,之后加入所检测蛋白的抗体(一抗)孵育,TBST洗涤后加入对应的二抗,洗涤后加入显影液,在BIO-RAD GelDoc XR凝胶成像仪上检测并拍照,获得对应蛋白的表达情况。
1.2.4 流式细胞术检测细胞凋亡
药物处理细胞24 h后,收集(1~5)×105个细胞,用PBS清洗两遍后,加入100μL Binding Buffer及5μL Annexin V-FITC和10μL碘化丙啶(PI)染液,10~15 min后加入400μL Binding Buffer并进行流式细胞检测。
1.2.5 流式细胞术检测细胞周期
药物处理细胞36 h后,收集(1~10)×105个细胞,用PBS清洗一遍后,在乙醇中固定细胞。用PBS清洗后加入0.5 mL染色缓冲液、10μL碘化丙啶储液及10μL RNase A,37℃孵育0.5 h,通过流式细胞仪进行检测。
1.2.6 克隆形成实验检测细胞增殖
在6孔板中每孔接种约500个细胞,过夜培养,加入药物进行处理,每2 d更换一次培养基,数天后,用PBS洗去培养基,加入福尔马林进行固定,之后加入结晶紫染液染色,清洗干净,晾干并在显微镜下拍照。
1.2.7 Transwell实验检测细胞侵袭
使用8.0μm的Transwell小室,上室接种细胞、无血清培养液及加入GSK-J4,下室加入含血清培养液,培养数天后,用福尔马林固定,结晶紫染色并在显微镜下拍照。
1.3 统计学方法
采用GraphPad Prism 8对实验结果进行分析,组间差异采用两样本t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 GSK-J4对人结肠癌细胞的抑制能力
现有的小分子化合物中,GSK-J1(图1A)是最有效的JMJD3抑制剂,其JMJD3半抑制浓度(IC50)约为60 nmol/L,但它存在一个羧酸侧链,增大了化合物的极性,使其无法有效的穿透细胞膜,因而难以发挥活性。通过前药策略,Kruidenier等[14]将GSK-J1的羧酸侧链改造成乙酯侧链,得到了化合物GSK-J4(图1B),这样大大提高了化合物的穿透细胞膜效率,但对JMJD3的IC50从60 nmol/L提升到8.6μmol/L,尽管如此,仍然获得了较好的药物活性[14]。
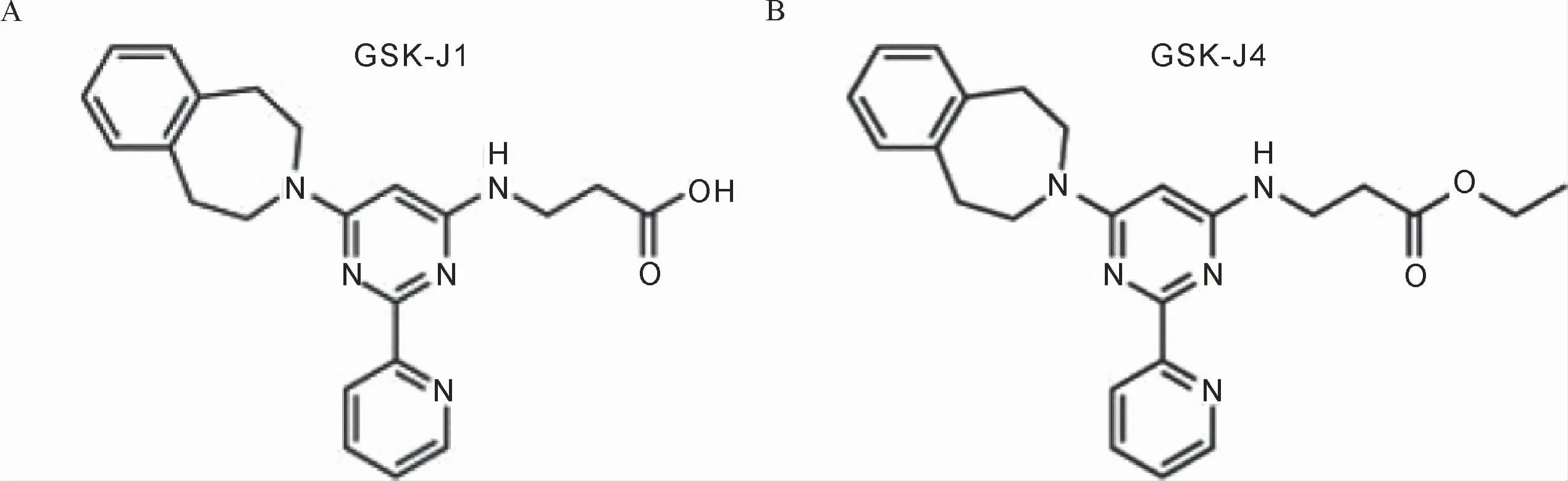
图1 JMJD3的抑制剂GSK-J1和GSK-J4Figure 1 GSK-J4 and GSK-J1 are JMJD3 inhibitors
本研究使用MTT方法评价GSK-J4对人结肠癌细胞增殖能力的影响。分别用不同浓度梯度的GSK-J4处理细胞72 h,并获得对应的细胞抑制率,进而计算出GSK-J4对结肠癌细胞的IC50。GSK-J4对HCT116、DLD-1、SW480、SW620、LoVo和HT-29的IC50分别为(2.07±0.71)、(1.17±0.21)、(0.71±0.31)、(0.72±0.81)、(4.37±0.43)和(4.57±1.09)μmol/L。说明GSK-J4具有良好的抗结肠癌细胞增殖的能力。下文将选择HCT116和DLD-1两种结肠癌细胞对GSK-J4的抑制作用进行评价。
2.2 GSK-J4对HCT116和DLD-1细胞的克隆形成、侵袭、凋亡及细胞周期的影响
首先,使用细胞克隆形成方法评价HCT116和DLD-1细胞的增殖能力。分别用0.2、0.5、1μmol/L浓度的GSK-J4处理细胞,与对照组相比,随着药物浓度的增加,HCT116和DLD-1细胞的克隆形成能力被逐步抑制(图2A)。随后,使用Transwell侵袭实验评价HCT116和DLD-1的细胞侵袭能力,1或2μmol/L的GSK-J4都能很好地抑制细胞的侵袭(图2B)。


图2 GSK-J4对HCT116和DLD-1细胞克隆、侵袭、凋亡和细胞周期的影响Figure 2 The effect on cell clone,invasion,apoptosis and cell cycle of HCT116 and DLD-1 by GSK-J4
除此之外,流式细胞术可以分析细胞凋亡比例及细胞周期分布。用Annexin V-FITC/PI细胞凋亡检测试剂盒测试细胞的凋亡状态,其中Annexin V-FITC可以将早期凋亡的细胞染色,而PI可以将晚期凋亡的细胞染色。由图2C和2D中可以看到,当加入的GSK-J4浓度增加时,HCT116和DLD-1的凋亡细胞比例在增加,5和10μmol/L的GSK-J4处理后,与未处理组的凋亡细胞比例存在显著差异。另外,以PI对细胞核内的DNA进行染色,并根据染色强度得到细胞内DNA的相对量,进而获得处于不同细胞周期内的细胞比例。图2E和2F中可以看到,在1、2、5 μmol/L浓度下,S期的细胞比例在不断增加,GSK-J4处理后与未处理组相比,S期细胞所占比例存在明显差异。
2.3 GSK-J4对HCT116和DLD-1细胞内蛋白质表达的影响
GSK-J4可以抑制HCT116和DLD-1细胞的生长,但相关的分子机理仍不清楚。使用0.5、2、10μmol/L的GSK-J4处理HCT116和DLD-1细胞24 h后,以蛋白免疫印迹实验评价细胞内相关蛋白质表达情况,并以β-actin作为内参(图3)。其中Histone H3为细胞内包含甲基化和非甲基化的总组蛋白H3水平,而Mono-Methyl-Histone H3(Lys27)、Di-Methyl-Histone H3(Lys27)和Tri-Methyl-Histone H3(Lys27)分别代表组蛋白H3的27位赖氨酸(Lys)被修饰1个、2个和3个甲基基团。通过检测组蛋白H3上27位Lys甲基化的水平,发现随着药物浓度的增加,组蛋白H3K27上单甲基化和二甲基化的水平无明显变化,三甲基化的比例有所增加。

图3 GSK-J4对HCT116和DLD-1细胞蛋白质表达的影响Figure 3 The effect on proteins expression in HCT116 and DLD-1 cell by GSK-J4
Caspase-7是细胞凋亡的主要执行者之一[19],裂解后形成Cleaved Caspase-7成熟亚基,并裂解下游底物[20],其中就包括PARP,因此Cleaved PARP也是细胞凋亡的标志[21]。图3显示,随着GSK-J4浓度的增加,检测到Cleaved Caspase-7和Cleaved PARP的表达出现上调,说明GSK-J4通过内源性途径诱导了HCT116和DLD-1细胞的凋亡。p27 Kip1是一种周期依赖性激酶抑制蛋白,可强化细胞周期的抑制[22-23],p27 Kip1的上调(图3)与前面S期细胞周期阻滞一致,说明GSK-J4抑制了HCT116和DLD-1细胞的无限增殖能力。
3 讨论
癌症是一种多基因疾病,现有研究认为表观遗传调控的异常与癌症的发生发展密切相关。其中JMJD3催化的组蛋白27位赖氨酸的去甲基化异常在多种癌症细胞中被发现,并促进癌症的发展和恶化。本文针对JMJD3靶向抑制剂GSK-J4影响多种结直肠癌细胞的增殖、侵袭迁移、凋亡和细胞周期进行研究,结果显示GSK-J4对结直肠癌细胞有显著的抑制作用。使用GSK-J4处理多种结肠癌细胞后发现,GSK-J4可有效抑制肿瘤细胞的生长,其72 h的IC50在0~5μmol/L级别;克隆形成和细胞侵袭实验表明 GSK-J4 可抑制HCT116和DLD-1细胞的增殖和侵袭;进一步研究发现,GSK-J4可降低HCT116和DLD-1细胞H3K27me3的水平。GSK-J4通过上调细胞周期相关蛋白p27 Kip1的表达,使细胞阻滞在S期,抑制HCT116和DLD-1增殖。HCT116和DLD-1的凋亡执行蛋白Cleaved Caspase-7和凋亡标志物Cleaved PARP也出现上调,证明GSK-J4是通过内源性途径诱导了细胞的凋亡。
JMJD3对于不同肿瘤、同一肿瘤不同细胞的作用可能存在差异,本研究仅针对部分结肠癌细胞,对其他种类的肠癌细胞的增殖抑制作用仍有待研究。并且本研究仅在体外细胞水平进行了评价,进一步的体内研究也是必要的。
作者贡献声明
郑稳稳:设计实验、开展实验,统计分析数据,撰写论文;李安祺:共同开展实验,撰写论文;刘子建:提出研究思路和框架,指导实验,修改论文;张存龙:提出研究思路和框架,修改论文。
利益冲突声明
本研究未受到企业、公司等第三方资助,不存在潜在利益冲突。

