川芎改善非酒精性脂肪性肝炎的作用机制
王玉平,龚瑾,李沙沙,章正,杨倩之,单璐琛
(1.暨南大学 附属第一医院 药学部,广东 广州 510630;2.暨南大学 附属第一医院 胃肠外科,广东 广州 510630;3.暨南大学 药学院,广东 广州 510000)
非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)是肝脏功能障碍的常见病因,目前已成为全球流行疾病,这种疾病可以发展为一种晚期形式,称为非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,NASH)[1]。在NAFLD谱系中,NASH发展为纤维化并进展为肝硬化的风险最高[2],影响约3%~5%的普通人群,NASH预计将成为肝硬化和终末期肝病的主要原因[3]。但目前NASH发病机制的分子基础尚不清楚,也无有效的治疗方法及药物,因此,寻找治疗NASH安全有效的方法和药物至关重要。
川芎(CX)是植物川芎(Ligusticum Chuanxiong Hort.)的干燥根茎,一种非常常见的中药,在中国被广泛应用,始载于《神农本草经》,在《本草纲目》中记载其燥湿、止泻痢、行气开郁,主要用于治疗风冷头痛眩晕、胁痛腹疼、寒痹痉挛、经闭、难产、产后瘀阻块痛、痈疽疮疡等症状[4]。研究认为其主要成分阿魏酸、川芎嗪等,已被发现其具有抗炎、改善血脂、提高血液流动性、抑制血小板聚集和发挥抗氧化活性等作用[5]。虽然川芎被报道具有抗炎、改善血脂等作用,但其对NASH或NAFLD的作用鲜有报道。
探究中药成分对于疾病的主要分子作用机制与信号通路,是目前探索中药方剂药理机制的综合有效的方法。本研究以川芎为研究对象,通过网络药理学的方法,采用多成分、多靶点、多通路的思路挖掘川芎改善NASH的作用机制,为后续研究提供依据。另外,本研究通过拟建立NASH小鼠动物模型,给予模型鼠川芎提取物治疗,观察川芎对NASH的改善效果,为临床药物的开发和应用提供依据。
1 材料与方法
1.1 化合物的筛选与潜在靶点的选取
在中药系统药理学分析平台(TCMSP,https://old.tcmsp-e.com/tcmsp.php)进行化合物成分和靶点的筛选,设置Herb name的检索条件下以“川芎”为关键词检索其化学成分,口服生物利用度(OB)≥30%、类药性(DL)≥0.18为筛选条件对川芎中的有效成分进行筛选。利用pubchem数据平台(https://pubchem.ncbi.nlm.nih.gov/),搜索SMILES结构后录入Swiss Target Prediction(http://www.swisstargetprediction.ch/),进行靶点预测获得化合物作用靶点,通过Uniprot数据库(http://www.uniprot.org/)得到上述靶点物种设定为人的基因名。
1.2 NASH相关靶点的选取
利用DisGenet数据库(http://www.disgenet.org)以“NASH”,“Nonalcoholic steatohepatitis”,“Non-alcoholic steatohepatitis”为关键词,搜索NASH的疾病靶点,将获得的靶点导出备用。
1.3 川芎改善NASH的核心靶点筛选
将所获得的川芎的潜在靶点与NASH疾病靶点导入Calculate and draw custom Venn diagrams平台(http://bioinformatics.psb.ugent.be/webtools/Venn/)绘制韦恩图并获得共有的靶点作为核心靶点,将核心靶点导入String数据库(http://string-db.org/)获得PPI蛋白互作相关信息,将上述信息导入Cytoscape 3.8.0软件进行编辑及网络分析,绘制PPI网络图及核心靶点相关性信息。
1.4 “川芎-成分-靶点-NASH”网络的构建
利用Cytoscape软件对川芎、有效成分、核心靶点、NASH的关联关系进行可视化,绘制关联网络。
1.5 GO富集分析和KEGG通路分析
将核心靶点录入到Metascape分析系统中(https://metascape.org/gp/index.Html#/main/step1),将筛选条件设置为“H.sapiens”,分别GO富集分析和KEGG通路分析,并将获得信息导入微生信网(http://www.bioinformatics.com.cn/)进行GO富集分析柱状图和KEGG通路分析气泡图的绘制。
1.6 分子对接验证
在PPI网络中选取度值排列前5的蛋白靶点与川芎有效成分度值排列前5的化合物进行分子对接验证。利用PDB数据库(https://www.rcsb.org/)下载PPI蛋白互作网络核心蛋白的结构,并Pymol去除其配体和水分子;利用PubChem数据库(http://pubchem.ncbi.nlm.nih.gov/)下载川芎核心化合物的sdf文件,用OpenBabel软件将其转化为mol2格式,得到的配体(化合物)及受体(蛋白结构)运用autodock软件进行分子对接,最后用Pymol软件将对接结果绝对值最大的4种组合进行可视化。配体和受体结合的构象越稳定能量越低,产生作用可能性越大。当结合能绝对值大于4.25 kcal/moL时,表示分子与靶点具有一定的结合能力,当结合能绝对值大于5.0 kcal/moL时,表示结合能力较强。
1.7 动物与试剂
C57雄性小鼠,SPF级,(20±2)g,购自浙江维通利华实验动物有限公司,许可证号SCXK(浙)2019-0001。高脂饲料(D12108C)购自美国Research Diets有限公司,其中含40%脂肪和1.25%胆固醇。TC、TG生化分析试剂盒购自南京建成科技有限公司。ALT、AST检测试剂盒和HE染色试剂盒购自北京索莱宝科技有限公司。高速低温离心机购自Sigma公司。
1.8 动物实验
1.8.1 川芎提取物制备
川芎饮片购自广东和祥制药有限公司,原产地为四川,为道地药材,符合中国药典2015年版一部的相关规定。饮片采用10倍量水煎煮提取2次,每次2 h,水煎浓缩;然后醇沉,第1次醇沉体积分数为60%,4℃冷藏24 h,浓缩;第2次醇沉体积分数为80%,4℃冷藏48 h,浓缩得到样品,再进行大孔树脂分离得到样品。根据川芎提取率计算,稀释成川芎组分质量浓度为1 mg/mL;川芎提取物(chuanxiong total extracts,CTE)给药组50 mg·kg-1·d-1灌胃。
1.8.2 动物造模及取材
试验前小鼠经过1周的适应性喂养,期间小鼠饲喂普通日粮,自由采食饮水。1周后随机将小鼠随机分为以下3组:正常对照组(Ctrl)、NASH模型组(NASH)、川芎提取物给药组(CTE),10只/组,5只/笼饲养,每天更换水瓶,每2 d更换1次垫料。Ctrl组小鼠给予普通饲料,NASH组及CTE组小鼠给予高脂饲料,同时CTE组采用灌胃的方式进行给药,每天给药2次。Ctrl组与NASH 组小鼠给予对应体积的生理盐水。实验持续10周,每周称量并记录小鼠体质量。实验结束后,小鼠禁食12 h,第2天取材。麻醉小鼠后心脏取血,于4℃,3 500 r/min的条件下离心15 min,测定各组小鼠血清中谷丙转氨酶(ALT)、谷草转氨酶(AST)含量。同时适量称取小鼠肝脏组织,用组织匀浆机制备肝脏组织匀浆,按照试剂盒说明书操作,检测小鼠肝脏组织中的TG、TC含量。部分小鼠肝脏组织约0.5 cm3固定于10%的甲醛液中,之后组织脱水,行HE染色。本研究通过暨南大学实验动物伦理委员会审批(20210603-01)。
1.9 统计学方法
采用SPSS 26.0统计学软件进行实验数据统计处理。计量资料采用mean±SD表示,3组间比较用One-Way ANOVA方差分析和Student's t检验进行两两比较,P<0.05为差异有统计学意义。
2 结果
2.1 川芎化合物和潜在靶点的收集
本研究通过对样本数量以及后续数据的研究价值考虑,选择OB≥30%且DL≥0.18作为筛选川芎化学成分的条件。通过TCMSP数据库检索得到川芎化学成分189个,其中符合筛选条件的化学成分7个(有效成分5个,川芎醌、川芎哚未预测到相关靶点),具体信息见表1。通过Swiss Target Prediction数据库搜索上述化合物的关联靶点共计307个,采用UNIPROT数据库将靶点名标准化。

表1 川芎主要活性成分信息Table 1 The main active components information of Chuanxiong
2.2 NASH相关靶点的选取
通过DisGenet数据库以“NASH”,“Nonalcoholic steatohepatitis”,“Non-alcoholic steatohepatitis”为关键词,检索非酒精性脂肪肝炎相关靶点434个。
2.3 川芎改善NASH的核心靶点筛选
绘制川芎改善NASH核心靶点韦恩图,并获得靶点44个(图1)。将核心靶点输入String数据库中,以medium confidence(0.400)为筛选条件,最终获得核心靶点39个,获得川芎改善NASH蛋白互作(PPI)网络图(图2)。将PPI数据导入Cytoscape软件,并按照度值排序获得核心靶点数据(表2)。

图1 核心靶点韦恩图Figure 1 Venn diagram of the core target

图2 蛋白互作网络Figure 2 Protein Interaction(PPI)Network

表2 川芎改善NASH核心靶点信息Table 2 The core target information of Chuanxiong
2.4 川芎改善NASH“药物-成分-靶点-疾病”网络的构建
分别将“药物-成分”、“成分-靶点”、“靶点-疾病”的关联数据导入Cytoscape软件,通过网络将其连接起来,并剔除不相关的靶点,将川芎改善NASH“药物-成分-靶点-疾病”网络关系进行可视化(图3)。
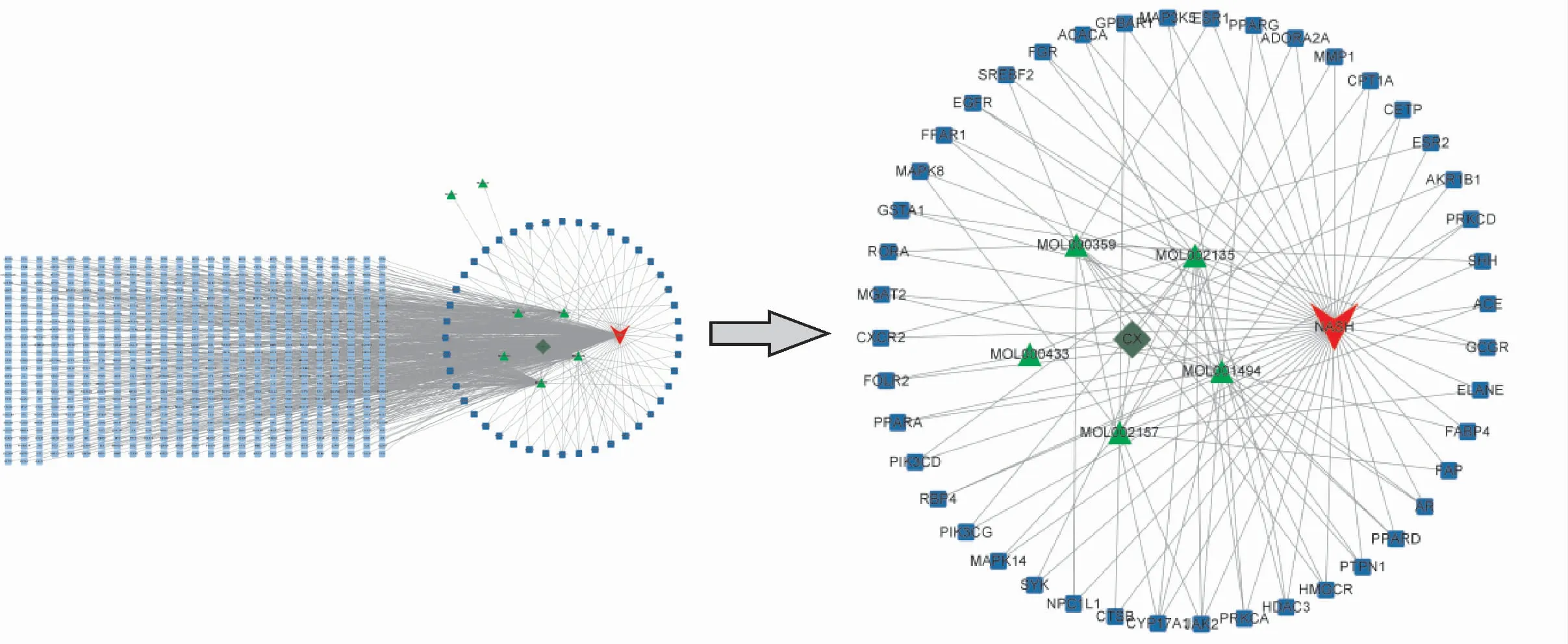
图3 川芎改善NASH网络Figure 3 The network of Chuanxiong improving NASH
2.5 GO富集分析和KEGG通路分析
川芎治疗NASH的GO富集结果见图4。富集的生物过程包括炎症反应的调节、蛋白质转运的调控、细胞对脂质的反应、蛋白激酶活性的调节、激素水平的调节、对营养水平的反应、类固醇代谢过程、脂质定位的调节等,涉及炎症反应、蛋白质与脂质代谢等生物过程;细胞组成主要涉及细胞膜、囊泡、受体、转录调节复合物、转移酶等;分子功能主要包括了核受体激活、蛋白酶激活、脂肪酸绑定、脂质转运活性等。

图4 川芎改善NASH GO富集分析柱状图Figure 4 GO enrichment analysis histogram
川芎治疗NASH的KEGG通路分析结果见图5,按基因在通路中的比例排序,具体通路信息见表3。川芎治疗NASH与众多通路有关,可能通过调节PPAR 信号通路、AMPK 信号通路、cAMP信号通路、Wnt信号通路等发挥作用。

图5 川芎改善NASH KEGG通路分析气泡图Figure 5 KEGG signaling pathway analysis bubble plot
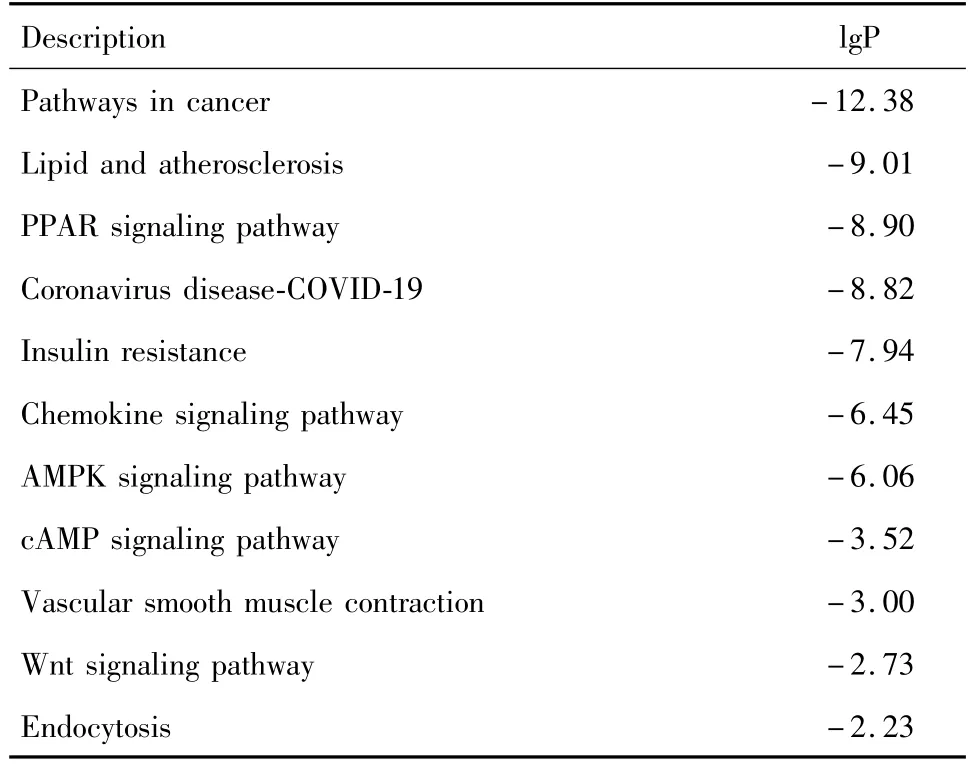
表3 川芎改善NASH KEGG通路分析Table 3 KEGG signaling pathway analysis
2.6 分子对接验证结果
在PPI网络中选取度值排列前5的蛋白靶点EGFR、ESR1、PPARG、MAPK14、PPARA与川芎有效成分度值排列前 5 的化合物谷甾醇(sitosterol)、杨梅酮(Myricanone)、亚油酸乙酯(Mandenol)、川芎萘呋内酯(wallichilide)、阿魏酸(FA)进行分子对接验证,其 中 PPARG 和Myricanone、PPARA 和 Myricanone、PPARA 和Sitosterol、PPARA和wallichilide的分子对接结果结合能绝对值最高,分别对其进行可视化,具体结构如图6、表4所示。

表4 川芎改善NASH KEGG分子对接信息Table 4 KEGG Molecular Docking Information

图6 川芎改善NASH分子对接图Figure 6 Molecular docking map
2.7 动物实验
2.7.1 一般情况及体质量变化
实验期间3组小鼠饮食及排便基本正常,正常组小鼠反应迅速,动作灵敏,皮毛整洁有光泽;NASH模型组小鼠活动较少,皮毛油腻;CTE给药组一般情况有所缓解,CTE组体质量较NASH组明显下降,但与对照组无显著差异(图7)。

图7 各组体质量曲线图Figure 7 Body mass graph of each group
2.7.2 血清酶学及肝脏脂质水平比较
与正常对照组比较,NASH模型组肝脏组织TC、TG水平,血清ALT、AST均明显升高,有显著差异(P<0.05)。与CTE组比较,NASH模型组血清ALT、AST,肝脏组织TG水平均明显下降(P<0.05),但肝脏组织TC水平差异无统计学意义(图8)。

图8 各组小鼠血清酶学及肝脏脂质水平比较Figure 8 Comparison of serum enzymology and liver lipid levels of mice in each group
2.7.3 小鼠肝病理变化
由图9可见正常对照组肝小叶结构完整,肝细胞核形态、大小均一,未见明显异常。NASH模型组肝细胞明显肿胀,水样变性,可见散在或灶性肝细胞气球样变,形成脂肪样空泡,CTE给药组小鼠肝小叶脂肪变程度较模型组明显改善。

图9 各组小鼠肝脏HE染色(×200)Figure 9 HE staining of mouse liver in each group(×200)
3 讨论
NASH是一种以炎性浸润和脂肪变性为主要特征的慢性肝病,其与肥胖、血脂异常、胰岛素抵抗等诸多代谢性致病因素密切相关,又被称为代谢性肝炎[6]。目前药物对NAFLD 患者并存的NASH特别是肝纤维都无肯定的治疗效果[7]。本研究根据文献报道[8],制备川芎提取物,并建造动物模型,结果表明体质量曲线及血液生化指标显示造模成功,川芎提取物治疗组较NASH模型组血清ALT、AST及肝脏组织TG均有明显改善作用(P<0.05),并明显减轻小鼠肝小叶脂肪变程度,显示该模型效果明显,成功率较高。
氧化应激所导致的脂质氧化和氧化过程中的系列产物,也是引起NASH肝损伤的主要机制之一[9]。本研究GO富集分析结果发现川芎改善NASH炎症反应与脂质代谢、核受体和蛋白酶激活、脂肪酸绑定、脂质转运活性等相关。据报道,NASH的病理生理学很复杂,主要特征是脂肪变性以及肝细胞损伤和炎症反应,常与2型糖尿病和胰岛素抵抗相关,也可能存在于许多其他内分泌疾病中,例如多囊卵巢综合征、甲状腺功能低下,男性性腺功能低下、生长激素缺乏或糖皮质激素过多[10];来自NASH患者的肝细胞检查结果发现具有异常的脂质成分,脂质的积累会导致细胞器功能障碍,细胞损伤和死亡以及慢性炎症,推断NASH发病机理和潜在治疗靶标的脂质种类和代谢途径,包括参与脂肪酸和甘油三酸酯合成的酶,生物活性鞘脂和多不饱和衍生的类花生酸,以及亲脂性脂质介体[11]。本研究的KEGG通路富集结果显示,川芎治疗NASH与众多通路有关,可能通过调节PPAR 信号通路、AMPK 信号通路、cAMP信号通路、Wnt信号通路等发挥作用。氧化物酶体增殖物激活受体(PPARs)是在脂质代谢和炎症中起调节作用的核受体,这使得PPARs被认为是一种潜在的治疗NASH的作用靶点[10,12],一些靶点PPARs激动剂已经被证实对NASH具有治疗作用[13-15]。研究发现NASH相关的肝细胞凋亡被AMPK细胞能量状态的主要传感器所抑制,NASH小鼠AMPK活性降低,而肝脏特异性AMPK敲除(LAKO)小鼠研究表明,AMPK的缺失会加大饮食诱导的NASH病理,包括肝脏损伤、纤维化和细胞死亡(特别是凋亡)的增加[16];AMPK还被认为可以调控脂肪组织炎症和NASH中的巨噬细胞极化,巨噬细胞中AMPK激活和脂肪酸氧化的增加可能为NASH治疗提供新的途径[17];肝脏特异性AMPK敲除能够加重小鼠NASH模型中的肝损伤,AMPK磷酸化促凋亡caspase-6蛋白以抑制其活化,从而控制肝细胞凋亡。AMPK活性的抑制缓解了这种抑制作用,使caspase-6在人和小鼠NASH中被激活。AMPK激活或caspase-6抑制,即使在NASH发作后,也能改善肝损伤和纤维化,预示着AMPK可能是NASH治疗的靶点[18]。Wnt信号通路的失调与NASH的发生密切相关,针对Wnt信号通路的调节被作为对抗NASH的潜在手段[19-21]。
分子对接结果表明,川芎改善NASH的过程中,由川芎中多个有效成分和核心靶点共同作用发挥治疗其中Myricanone、Sitosterol、wallichilide是起主要作用的成分,目前文献报道的川芎提取方法,得到的川芎提取物其中主要的部分活性成分[8,22-23]。PPARA和PPARG可能是川芎作用最紧密的靶点,PPARA和PPARG共属于PPAR信号通路,均是脂肪代谢和炎症反应中发挥重要作用的靶点,此结果为川芎改善NASH后续研究提供了理论依据。虽然本研究发现的NASH有关的可能靶点及机制已有文献先后报道,而更深的分子机制及完整通路需进一步验证和证实。
综上所述,本研究通过网络药理学的方法发现川芎可能主要通过谷甾醇、杨梅酮、亚油酸乙酯、川芎萘呋内酯和阿魏酸5种化合物作用于EGFR、PPARG、PPARA、ESR1、MAPK14等39个核心靶点,调节PPAR、AMPK等信号通路发挥对NASH的治疗作用,并通过动物模型进行验证,为川芎改善NASH后续研究提供了理论依据及初步验证。虽然网络药理学研究手段日趋成熟,数据库信息逐渐完善,但仍需进一步的分子机制研究进行验证,为川芎改善NASH提供现实参考。本研究表明,川芎可以改善高脂饮食所致的小鼠非酒精性脂肪性肝炎,具有一定临床应用可能,值得进一步研究。
作者贡献声明
王玉平:文章构思、统计分析数据,撰写论文;龚瑾:分析数据,修改论文建议;李沙沙:部分作图分析;章正:部分作图分析;杨倩之:部分作图分析;单璐琛:提出研究思路和框架,修改论文。
利益冲突声明
本研究未受到企业、公司等第三方资助,不存在潜在利益冲突。

