葡聚糖硫酸钠诱导体外溃疡性结肠炎的细胞损伤及细胞焦亡机制
王康,邓牧文,唐立,张军,陆岩,欧阳满照
(南方医科大学 顺德医院 胃肠外科,广东 佛山 顺德 528308)
溃疡性结肠炎(ulcerative colitis,UC)是指由多种原因导致的慢性非特异性肠道炎症性疾病,以局限于黏膜层的炎症反复发作为特征[1]。消化道稳态的紊乱会导致肠黏膜持续炎症,从而引起肠上皮细胞(intestinal epithelial cells,IEC)的屏障功能障碍,这可能是UC发病的一个重要原因[2]。在UC组织中,可以明显观察到上皮屏障细胞的破坏[3],肠上皮细胞的结构性损伤会引发炎症性反应[4]。然而,肠上皮屏障的破坏与UC发生发展间的具体分子机制尚未明确。
细胞焦亡是炎性反应相关性的细胞死亡方式[5],焦亡的激活与细胞损伤密切相关,且通常伴随大量促炎性因子的释放[6]。细胞受到损伤及刺激时,炎症小体识别蛋白识别危险因素相关模式分子(damage-associated molecular patterns,DAMPs)等信号,形成炎症小体复合物,在由炎症小体复合物活化的含半胱氨酸的天冬氨酸蛋白水解酶1(cysteinyl aspartate specific proteinase-1,Caspase-1)剪切作用下,GSDMD-Full(Gasdermin D Full)形成切割活化的GSDMD-N(Gasdermin D Nterminal),活化的GSDMD-N发挥膜成孔效应(图1),会促进成熟的白细胞介素-1β(interleukin-1β,IL-1β)和白细胞介素-18(interleukin-18,IL-18)释放,导致细胞裂解[7-8]。细胞焦亡激活后炎性反应的发生,表明其与溃疡性结肠炎中有着重要关联[9]。研究发现在葡聚糖硫酸钠(dextran sodium sulfate,DSS)诱导的小鼠UC模型中,焦亡相关蛋白GSDMD-N表达显著增加[10]。然而,体外细胞的相关研究鲜有文献报道。因此,本研究拟通过体外培养Caco-2、NCM460细胞,使用DSS破坏体外屏障,检测细胞形态及焦亡相关蛋白,探讨在DSS诱导下结肠炎与细胞焦亡的联系。

图1 肠上皮屏障破坏过程中相关分子机制Figure 1 Related molecular mechanisms in the destruction of the intestinal epithelial barrier
1 材料与方法
1.1 材料与试剂
人肠癌细胞株Caco-2细胞、人正常肠上皮细胞株NCM460细胞(细胞均由中科院细胞库提供,并于本课题组细胞液氮罐中保存)。主要的试剂、耗材和仪器包括:RPMI-1640培养基(Thermo Fisher),葡聚糖硫酸钠(DSS,MP Biomedicals,216011080),CCK-8试剂盒(C0038,碧云天),AnnexinV-FITC/PI流式试剂盒(C1062S,碧云天),β-actin、GSDMD-Full、GSDME-Full、GSDME-N、GSDMD-N抗体(Proteintech),鼠二抗(Thermo Fisher);6孔板(Corning,康宁,3516);二氧化碳培养箱(Thermo Fisher),倒置显微镜(Leica),流式细胞仪(FACSCanto),酶标仪(Victor Nivo 3F),蛋白印迹系统(Bio-RAD)。以下实验均在南方医科大学顺德医院中心实验室完成。
1.2 方法
1.2.1 构建体外模型
①设置分组及给药方案:将Caco-2细胞、NCM460细胞均分成8组,分别以不同质量浓度DSS(0、10、20、30、40、50、60、70 mg/mL)干预。Caco-2细胞、NCM460细胞在含有上述质量浓度梯度DSS、10%胎牛血清以及1%双抗的RPMI-1640完全培养基中于37℃二氧化碳孵箱里孵育48 h,处理完毕则收集细胞培养上清液和细胞,检测相关指标。②细胞铺板:取Caco-2细胞、NCM460细胞悬液100μL加入96孔板(每孔约5×103细胞)。③CCK-8细胞活力检测:96孔板中,每孔加入10μL CCK-8溶液;在细胞培养箱内继续孵育2 h;用酶标仪检测450 nm处的吸光度,计算细胞活力,并绘制DSS药物质量浓度曲线;分别取DSS对Caco-2细胞和NCM460细胞48 h的IC50质量浓度作用于细胞,构建体外溃疡性结肠炎细胞屏障模型。
1.2.2 实验分组及细胞培养
①实验分组:对照组(NC,不加DSS)、24 h组(DSS处理24 h)和48 h组(DSS处理48 h)。②细胞培养:细胞接种于6孔板,用RPMI-1640培养基培养,细胞接种量为(5~8)×105cells/孔,每组设置3个重复。③DSS处理:将Caco-2细胞、NCM460细胞分别于含10%胎牛血清、1%双抗以及IC50质量浓度DSS的RPMI-1640完全培养基中培养,3组分别于37℃二氧化碳孵箱里培养0、24、48 h,处理完毕则收集细胞培养上清液和细胞,检测相关指标。
1.2.3 分析细胞结构完整性
细胞培养板置于荧光倒置显微镜的载物台上,分别观测Caco-2细胞和NCM460细胞的对照组、24 h组、48 h组的细胞形态变化,拍照记录,显微镜下(×100、×400)观察细胞的胞膜完整性。
1.2.4 检测细胞凋亡情况
取经1.2.2中处理的细胞悬液100μL于5 mL流式管中,加入5μL FITC Annexin V和1~2μL PI,轻轻混匀。室温、避光、反应15 min后加入400μL 1×Annexin-binding buffer,轻柔混匀,冰上放置。1 h内,进行流式细胞仪的观察和检测,分析细胞的凋亡比例。
1.2.5 检测相关蛋白表达
取1.2.2中培养的细胞,分别收集培养基上清和贴壁细胞。将培养基上清在离心机中以14 000 g离心2 min,取其沉淀,收集蛋白;贴壁细胞加入裂解液裂解细胞,收集蛋白。采用UV法测定蛋白质量浓度,取10μg上样,经SDSPAGE电泳、转膜,用5%脱脂牛奶封闭1 h。Caco-2细胞的蛋白条带PVDF膜用GSDME-Full(Gasdermin EFull)一抗稀释液(VGSDMD-Full一抗∶V抗体稀释液=1∶1 000)、GSDME-N(Gasdermin E Nterminal)一抗稀释液(VGSDMD-N一抗∶V抗体稀释液=1∶1 000)、β-actin一抗稀释液(Vβ-actin一抗∶V抗体稀释液=1∶1 000)4℃孵育过夜;NCM460细胞的蛋白条带PVDF膜用GSDME-Full一抗稀释液(VGSDME-Full一抗∶V抗体稀释液=1∶1 000)、GSDME-N一抗稀释液(VGSDME-N一抗∶V抗体稀释液=1∶1 000)、β-actin一抗稀释液(Vβ-actin一抗∶V抗体稀释液=1∶1 000)4℃孵育过夜。用PBST洗膜3次,10 min/次,加入对应荧光二抗稀释液(V二抗∶V抗体稀释液=1∶2 000),室温孵育3 h。洗膜3次,10 min/次,将PVDF膜置于ChemiDoc XRS+成像系统的白光平板中心位置,进行发光孵育监测,胶片扫描存档,Image Pro Plus软件对特异条带灰度值进行数字化分析。
1.2.6 获取焦亡蛋白RNA表达情况
人类蛋白图谱在线数据库(human protein atls,HPA)(https://www.proteinatlas.org/)通过转录组学和蛋白质组学技术,整合了人类不同组织和器官中的蛋白质和RNA表达情况。本研究以“GSDMD”为检索词,在HPA数据库中进行搜索,选择出GSDMD在人类肠组织中单细胞集群的RNA表达情况。
1.3 统计学分析
本次研究采用Graphpad Prism 8软件进行图片绘制和统计学分析。多组间比较采用单因素方差分析,数据用均数±标准误表示,P<0.05表示差异具有统计学意义。图片处理使用ImageJ软件。所有实验数据均重复3次及以上。
2 结果
2.1 DSS对人肠上皮细胞活性的影响
CCK-8实验检测细胞活性显示:经过质量浓度梯度DSS分别处理Caco-2细胞、NCM460细胞,发现处理时间为48 h时,Caco-2细胞和NCM460细胞的活力随着DSS浓度的升高而降低(图2),Caco-2细胞、NCM460细胞的IC50质量浓度分别为10 mg/mL、40 mg/mL。
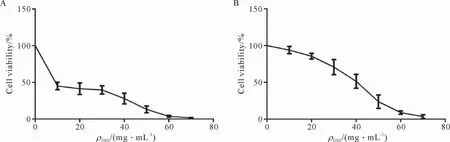
图2 在DSS诱导体外UC模型实验中人肠上皮细胞活性的变化Figure 2 Changes of the activity of human intestinal epithelial cells in DSS-induced UC cell model experiments in vitro
2.2 DSS对UC细胞模型细胞膜完整性的影响
在体外UC细胞模型中,本研究评估了DSS处理对Caco-2细胞以及NCM460细胞形态产生的应激作用。荧光倒置显微镜观察结果显示:与对照组(图3A、D;图4A、D)相比,实验组的细胞均在一定程度上出现细胞肿胀,在放大400倍时特征性肿胀气泡主要表现在细胞的细胞膜上(图4B、C、E、F),在放大100倍时,可观察到48 h组变化更剧烈(图3C、F)。结果显示,DSS可破坏Caco-2细胞、NCM460细胞的细胞膜完整性。
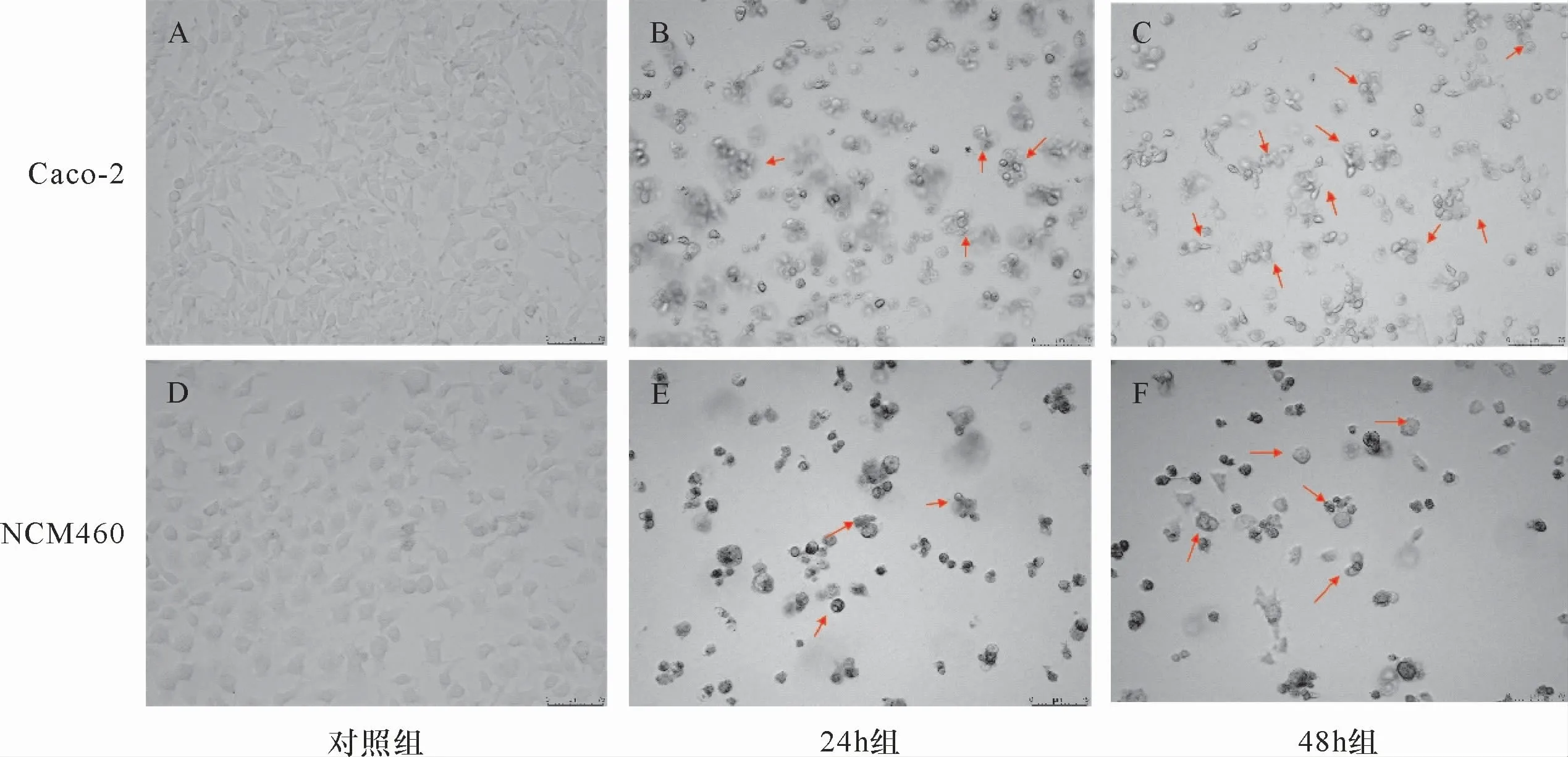
图3 在DSS诱导UC体外细胞模型实验中细胞形态的变化(×100)Figure 3 Changes of cell morphology in DSSinduced UC cell model in vitro(×100)

图4 在DSS诱导UC体外细胞模型实验中细胞形态的变化(×400)Figure 4 Changes of cell morphology in DSSinduced UC cell model in vitro(×400)
对DSS处理的细胞进行细胞流式实验,来进一步研究细胞膜完整性的破坏所造成的影响。在Caco-2细胞中,DSS处理48 h后,Caco-2细胞的凋亡比例显著增加(25.7% vs 6.8%,P<0.01)(图5A)。在NCM460细胞中,DSS处理48 h后,NCM460细胞的凋亡比例显著增加(33.3% vs 17.2%,P<0.01)(图5B)。
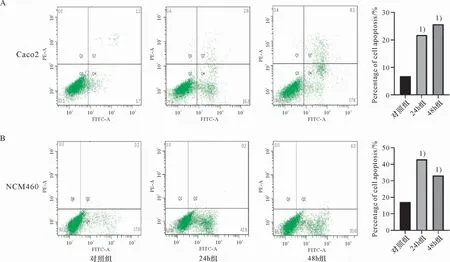
图5 在DSS诱导UC体外细胞模型实验中细胞凋亡情况的变化Figure 5 Changes of the apoptosis in DSS-induced UC cell model in vitro
2.3 DSS对UC细胞焦亡蛋白表达的影响
通过蛋白免疫印迹实验检测DSS诱导的体外溃疡性结肠炎细胞屏障模型中焦亡相关蛋白GSDMD、GSDME的表达情况。结果发现,在Caco-2细胞中,与对照组相比,DSS处理的24 h组及48 h组的GSDMD-Full蛋白表达均减少(0.173±0.001 vs 0.864±0.008,P<0.05;0.081±0.001 vs0.864±0.008,P<0.05),活化GSDMD-N蛋白表达均增加(0.771±0.008 vs 0.269±0.003,P<0.05;0.889±0.008 vs 0.268±0.003,P<0.05)(图6A)。在NCM460细胞中,相较于对照组,DSS处理的24 h组及48 h组的GSDME-Full蛋白表达均减少(0.706±0.006 vs1.345±0.097,P<0.05;0.594±0.030 vs 1.345±0.097,P<0.05),活化的GSDME-N 蛋白表达均增加(0.987±0.029 vs 0.472±0.058,P<0.05;2.205±0.090 vs0.472±0.058,P<0.05)(图6B)。

图6 在DSS诱导UC体外细胞模型实验中细胞凋亡相关蛋白表达的变化Figure 6 Changes of the expression of pyroptosis-related proteins in DSS-induced UC cell model in vitro
2.4 焦亡蛋白在肠组织上皮细胞中的表达情况
通过检索HPA 数据库发现,焦亡蛋白GSDMD集中表达于肠组织中腺体上皮细胞集群(enterocyte c-6、c-5、c-7、c-4、c-9、c-0)及未分化细胞集群(undifferentiated cell c-8),而在肠组织中血液及免疫细胞集群(blood&immune cells c-3、c-12)中表达较少(图7)。

图7 各细胞类型中GSDMD RNA的表达情况Figure 7 The expression of GSDMD RNA in various types of cells
3 讨论
完整的肠上皮细胞为构成机体内外环境之间的一道机械保护屏障,在阻止病原微生物入侵黏膜的过程中发挥着重要的作用,多项研究证实肠上皮屏障功能受损与UC的发生发展密切相关[11]。并且最新研究表明,细胞焦亡在肠上皮屏障功能受损中具有重要作用[12]。因此,本研究利用DSS诱导肠癌细胞Caco-2及肠上皮细胞NCM460来探究细胞焦亡与溃疡性结肠炎发生发展的联系。在UC中,受到损害的肠上皮细胞会发生细胞焦亡,其炎症主要集中在黏膜及黏膜下层[13-14]。研究表明,机体自身的免疫异常在UC的发病中起主要作用[15],自身免疫异常会使肠道黏膜出现损害,但本研究用DSS诱导Caco-2细胞和NCM460细胞后发现,细胞焦亡也参与肠道屏障的破坏,这与之前的研究报道小鼠UC模型中焦亡相关蛋白的表达较正常对照小鼠增加一致,焦亡相关蛋白表达的增加与细胞损伤比例成正相关[16],为细胞焦亡在肠上皮屏障的损坏机制提供了细胞层面的证据。在小鼠UC模型中,由细胞焦亡所致的屏障破坏可被焦亡相关抑制剂双硫仑缓解[17],此外在黏蛋白2(Mucin 2,Muc2)基因敲除所致的自发性小鼠UC模型中,NOD样受体热蛋白结构域相关蛋白3(NLR family pyrin domain containing 3,NLRP3)抑制剂MCC950可减少膜成孔效应所导致的炎症因子的释放[18]。鉴于细胞焦亡在细胞损伤反应机制中扮演着重要角色,因此,探究UC中细胞损伤与细胞焦亡的关系可为寻找新的UC诊治方法提供新的视角。
虽然已有研究报道小鼠模型中细胞焦亡与UC的联系[19],但关于DSS诱导的Caco-2细胞和NCM460细胞与细胞焦亡的联系少有报道,本研究发现在DSS诱导后,Caco-2细胞和NCM460细胞均发生了焦亡。在以往体外模型中,DSS的刺激可使肠上皮细胞间的紧密连接遭到破坏[20],因此本模型更趋向于物理急性损伤。除此之外,在DSS诱导的体外模型中,相关免疫细胞的免疫反应不会被激活[21],所以本研究为探究DSS诱导Caco-2细胞和NCM460细胞损伤与UC的联系提供了基础。国内外许多研究证实,Caco-2细胞由于其良好的单层细胞吸收能力而被广泛用于屏障模型的构建[22],因此本研究选择Caco-2细胞进行进一步研究。本研究在Caco-2细胞系中观察到细胞肿胀以及焦亡相关蛋白的表达与细胞损伤比例呈正相关,在一定程度上证明了此研究的有效性。同时,最新研究表明,经DSS处理的Caco-2细胞除了细胞的胞膜通道及受体蛋白改变外,其内质网压力和跨膜电阻也显著改变,从而导致Caco-2细胞的胞膜通透性增加[23],这一特性很好的契合了UC相关的表型。
近年来,越来越多的研究试图从细胞死亡机制中寻求UC新的治疗靶点[24-26]。本研究通过DSS诱导Caco-2细胞和NCM460细胞,探寻了体外屏障细胞的破坏与细胞焦亡的关联,结合HPA数据库的焦亡蛋白RNA在肠组织上皮细胞中的表达特异性,为进一步研究UC复杂的发病机制及探寻潜在的治疗策略提供了一定理论基础。最新研究也发现,抑制经典细胞焦亡信号通路可以减轻巨噬细胞焦亡[27-28],表明细胞焦亡在细胞损伤中的关键作用,为UC的诊治提供了新的思路[29-31]。与之前已发表的UC细胞机制研究相比,本研究在细胞形态变化的基础上分析了细胞损伤焦亡相关蛋白的变化,探究了细胞焦亡与UC的联系。本研究也存在一定局限性,目前研究发现越来越多的分子参与细胞焦亡通路,因此还需要结合更多标志性分子来进一步探索细胞焦亡与UC的关系。
综上所述,本研究通过DSS诱导Caco-2细胞和NCM460细胞验证了体外UC模型中细胞焦亡的发生,并发现焦亡相关蛋白的表达与细胞损伤比例呈正相关。因此,本研究从细胞焦亡角度出发,为探寻UC新的诊治方法提供了一定理论基础。细胞屏障破坏在溃疡性结肠炎的发生发展中有一定促进作用,但细胞屏障破坏的具体分子机制仍未知,值得进一步深入研究。
作者贡献声明
王康:设计实验、统计分析数据,撰写论文;邓牧文:参与实验,数据统计;唐立:细胞实验,文献收集;张军:细胞实验,参与论文写作;陆岩:实验指导,修改论文;欧阳满照:提出研究思路和框架,修改论文。
利益冲突声明
本研究未受到企业、公司等第三方资助,不存在潜在利益冲突。

