子宫内电穿孔法调控鼠胚大脑皮质神经干细胞基因表达体系的建立
欧伟明 何龙楷 王晓钰 杨雪松 王广 李冰肖 金雅 韩莎莎 柳国胜
(1.暨南大学附属第一医院新生儿科,广东广州 510632;2.暨南大学医学院组织与胚胎学系,广东广州 510632)
大脑皮质的发育是神经干细胞(neural stem cell,NSC)分化发育和成熟的过程[1-2]。NSC不断进行增殖和凋亡,非对称性分裂而来的子细胞在特定部位分化为具有层特异性表型的神经元并逐渐成熟,最终形成大脑皮质的各层神经元,这些不同层次的神经元拥有各自独特的形态特征和电生理特性,共同维系着大脑皮质的正常结构和功能[3-5]。
动物模型体内靶向调控大脑皮质NSC 基因表达是研究基因对大脑皮质发育影响的重要方法,目前体内调控基因表达主要有以下几种方法:模式动物构建、腺相关病毒外源基因导入和子宫内电穿孔(in uteroelectroporation,IUE)技术等[6]。由于部分基因改变可导致胚胎死亡,因此无法进行模式动物构建,而腺相关病毒外源基因导入需要至少2周的时间才可稳定表达载体蛋白,因而不适用于部分胚胎发育学的研究。IUE技术是一种利用电穿孔技术注射DNA 质粒,将基因引入子宫内胚胎特定位置以便靶向调控目的基因表达的技术。IUE 技术诞生于20 世纪80 年代,是体内研究胚胎神经发育与基因功能的一种重要手段,通过调整电极的结构和方向,可以转染脑组织不同部位的神经元(如大脑皮质、海马、脑干和小脑等),具有时间和空间的可调控性[7]。
在进行大脑皮质发育相关研究时,可利用IUE技术将质粒DNA 导入鼠胚侧脑室,电脉冲在细胞膜上产生瞬时孔隙,使质粒DNA 进入大脑皮质NSC,从而靶向调控发育中的鼠胚大脑皮质区域的基因表达,可用于NSC 的增殖、凋亡、分裂、定向分化、迁移和神经元成熟等体内研究[8],对神经发生的研究具有重要价值。与其他体内靶向调控基因表达技术相比,IUE技术靶向调控大脑皮质NSC 基因表达的优势还在于,质粒DNA 导入胚胎侧脑室24 h 后即可在NSC 稳定表达载体蛋白,从而迅速观察到靶基因对NSC分化发育的影响[6]。
尽管利用IUE技术进行鼠胚大脑皮质发育的研究在国外已得到应用,但国内目前对该技术的应用尚处于探索阶段。本研究详细阐述如何利用IUE技术观察大脑皮质NSC 的增殖、凋亡、分裂、定向分化、迁移和神经元成熟,以期为国内学者深入开展大脑皮质神经发生的相关研究提供参考。
1 材料与方法
1.1 实验动物
8周龄C57BL/6J小鼠购于北京华阜康生物科技有限公司[SCXK(京)-2019-0008],动物饲养于暨南大学实验动物中心[SYXK (粤) -2017-0174]。雄性小鼠1只,雌性小鼠7只,将2~3只雌性小鼠和1只雄性小鼠在同一笼里合笼过夜,次日早上检查阴道精栓(阴道精栓呈淡黄色)观察到阴道精栓的当天即定义为孕0.5 d。所有操作均符合实验动物伦理学要求(IACUC-20210807-03)。
1.2 主要仪器与试剂
仪器:ECM399胚胎电转仪(BTX,美国)。试剂:绿色荧光蛋白(green fluorescent protein,GFP,ab13970,1∶1 000)、性别决定基因相关转录 因 子 2 (SRY-related HMG box-containing transcription factor-2,Sox2,ab97959,1∶200)、T型盒结构域神经元蛋白2(T-box brain protein 2,Tbr2,ab23345,1∶100)、染色质重塑复合物亚基蛋 白2 (chromatin remodeling complex subunit,Ctip2,ab18465,1∶200)、荧光二抗(1∶500)抗体均购自美国Abcam公司,多同源复合物蛋白3(polyhomeotic homolog 3,pH3,1∶400,9713)、剪切半胱天冬酶3(cleaved caspase-3,CC3,9661,1∶200)抗体均购自Cell Signaling Technology公司,4', 6- 二 脒 基-2- 苯 基 吲 哚(4', 6-diamidino-2-phenylindole,DAPI,1∶1 000,C1002,上海碧云天生物技术有限公司,中国),质粒去内毒素中提试剂盒(9783S,宝日医生物技术有限公司,中国),pCIG质粒(P24992,武汉淼灵生物科技有限公司,中国)。
1.3 IUE实验
(1)麻醉、备皮、消毒、铺巾:称量孕14.5 d孕鼠体重,腹腔注射戊巴比妥钠40 mg/kg,将孕鼠放置在37℃恒温加热板上,在以脐为中心约4 cm×4 cm方形区域上进行术前脱毛备皮,使用碘伏消毒手术区域3 次,在手术区域放置无菌手术单,完全覆盖孕鼠。(2)暴露子宫:用剪刀在腹部切开约2 cm 手术切口,在切口周围放置无菌纱布,并用加热至37℃的0.9%氯化钠溶液湿润纱布,用镊子暴露出子宫,将子宫放置在纱布上(图1A)。(3)侧脑室内质粒注射:轻柔地用左手拇指和食指稳定胚胎(胚胎在羊膜袋中是可移动旋转的,调整合适的位置以准确地注射质粒至脑室内,在操作时注意不要损坏胎盘和血管,这对胚胎后续的存活非常重要)。在胚胎眼球上方约2 mm处可见透明侧脑室,用微毛细玻璃管,轻轻戳入侧脑室,术者会有2次轻微的落空感(对应于毛细玻璃管穿过子宫,然后穿过胚胎的皮肤和颅骨),使用嘴式显微注射管注入0.2~0.3 μL 混绿色染料(固绿)的质粒DNA 至胚胎侧脑室中,若侧脑室由透明变为绿色则说明注射成功(图1B),质粒浓度范围为1 μg/μL(单一质粒)至2 μg/μL(混合质粒)。(4)电转:将ECM399胚胎电转仪电极夹的正极放在质粒注射侧,将负极放在胚胎头的另一侧,然后按下电击按钮,直至电穿孔完全结束(图1C)。在电穿孔过程中可见胚胎的轻微收缩运动。电转条件为:电压40 V,脉冲5 次[7,9-10];当一侧的所有胚胎都被电转后,小心将子宫放回腹腔内,开始电转另一侧。(5)术后缝合及观察:胚胎电转结束后进行手术切口缝合,将孕鼠放回鼠笼里。鼠笼下放置37℃恒温加热垫保证手术后孕鼠的体温恒定,手术后15 min,孕鼠应在鼠笼中自发活动。本实验取7 只孕鼠,每只孕鼠电转2~4 个胚胎,设为电转组,余下未进行电转操作的胚胎作为对照组。
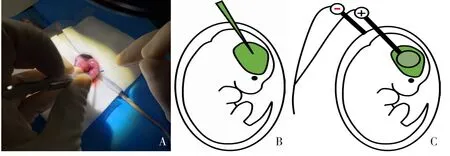
图1 子宫内电穿孔操作示意图
1.4 脑组织切片制备和免疫荧光染色
鼠胚电转后于孕16.5 d 或孕17.5 d 取出胚胎并分离出鼠脑,于4%多聚甲醛过夜固定后,放置于30%蔗糖溶液中4℃保存。约24 h后可见组织块沉于30%蔗糖溶液底部。将组织块移入包埋盒,填充包埋剂,放置于-80℃冰箱长期保存。使用冰冻病理切片机,切成厚度为15~30µm 的冰冻切片。选择目的切片后,冰冻切片取出浸泡于PBS中洗3次,每次5 min。用封闭液室温封闭60 min,弃去封闭液,滴加用封闭液稀释的相应一抗,湿盒中4℃孵育36 h。浸泡于磷酸盐缓冲液中洗3 次,每次5 min,滴加荧光二抗和DAPI,室温避光孵育3 h,结束后清洗3 次,每次5 min,滴加抗荧光淬灭封片剂并用盖玻片封片。荧光显微镜或激光共聚焦显微镜下观察并拍照。采用Fiji软件统计免疫染色阳性细胞的数量、形态和荧光表达强弱等。
1.5 统计学分析
采用SPSS 25.0统计软件对数据进行统计分析,符合正态分布的计量资料采用均数±标准差(±s)表示,两组间比较采用成组t检验。P<0.05为差异有统计学意义。
2 结果
2.1 IUE实验对小鼠胚胎生长发育的影响
电转组胚胎的存活率约为90%,胚胎重为(0.874±0.024)g,头重为(0.293±0.007)g,与对照组相比差异均无统计学意义(P>0.05),提示IUE实验不影响胚胎生长发育(表1)。
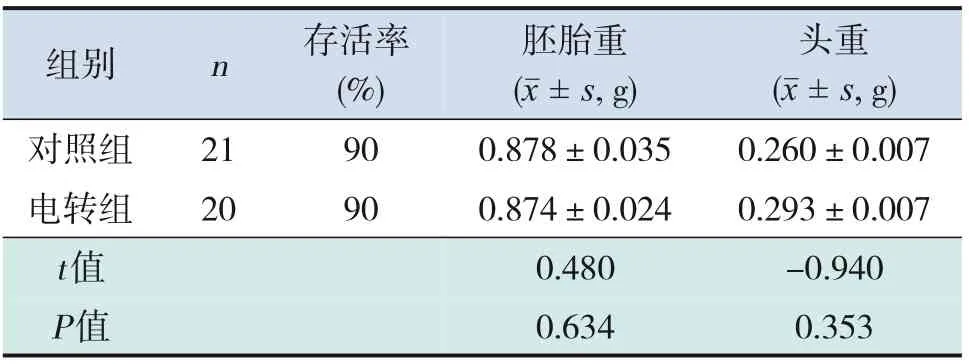
表1 2组胚胎存活率和体格发育情况比较
2.2 大脑皮质NSC的增殖、凋亡、分裂和定向分化情况
本研究对孕14.5 d孕鼠胚胎大脑皮质NSC电转pCIG 质粒,pCIG 质粒表达重组增强型绿色荧光蛋白(enhanced green fluorescent protein,EGFP)。孕16.5 d取材切片观察脑室区NSC的增殖、凋亡、分裂和定向分化的情况。pH3标记处于有丝分裂期的细胞,用pH3(红色)和EGFP(绿色)进行双标可观察调控目的基因后对NSC 增殖的影响,若两者共标细胞数量明显增多或减少,则提示电转调控的目的基因与NSC 的增殖功能相关(图2A)。CC3 为细胞凋亡的标记物,用CC3(红色)和EGFP(绿色)进行双标可观察目的基因后对NSC凋亡的影响,若两者共标细胞数量明显增多或减少,则提示电转调控的目的基因与NSC 的凋亡功能相关(图2B)。在大脑皮质发育过程中,脑室区的NSC不断向外分化迁移,Sox2是NSC的标记物,Tbr2 阳性细胞是由Sox2 标记的NSC 分化而来的中间前体神经元,用Tbr2(红色)和EGFP(绿色)进行双标,可观察调控目的基因后NSC 分化成为中间前体神经元数量的变化(图2C)。用Sox2(红色)和EGFP(绿色)进行双标,可观察调控目的基因后停留在NSC 阶段未分化的细胞数量变化(图2D),结合Tbr2 和Sox2 阳性细胞的统计结果,可观察调控目的基因后对NSC定向分化的影响。γ-Tublin标记细胞的中心体,当细胞进入有丝分裂后期,中心体一分为二,分别牵引着纺锤丝和染色质,通过测量两个中心体之间的夹角可判断该细胞是在进行对称性分裂还是非对称性分裂[11-12],若该角度大于60°而小于等于90°,则定义为对称性分裂,若该角度大于0°而小于等于60°,则定义为非对称性分裂。对称性分裂可产生2 个相同的NSC从而扩大神经祖细胞池;而非对称性分裂可产生1 个NSC 和1 个子代细胞(可为中间前体细胞、Ⅴ~Ⅵ层内层神经元或Ⅱ~Ⅳ层外层神经元)。通过统计分析其角度,从而明确NSC 自我更新和分化的比例(图2E~F)。放射状胶质细胞(radial glial cell,RGC)是在大脑皮质发育过程中最主要的NSC,典型的RGC 呈现出放射轴形态,底部的胞体与脑室表面连接,向上伸出长长的放射轴,当RGC 发育异常时,与脑室表面连接的胞体形态会出现紊乱和脱离,放射轴的末端“尾足”分支会增多。本研究中,孕16.5 d取材切片后在脑室区可观察到呈典型放射轴形态的RGC(图2G),在皮质板区域可观察RGC 放射轴尾足的结构(图2H),从而进一步研究目的基因对RGC 形态和功能的影响。

图2 大脑皮质NSC的增殖、凋亡、分裂和定向分化情况
2.3 大脑皮质NSC的迁移和成熟情况
大脑皮质的NSC 首先从脑室区分裂产生,在胚胎发育的过程中,经过迁移区向外分化迁移,最终在大脑皮质表面皮质板区域形成成熟的神经元。孕17.5 d 取材切片后,可见EGFP 阳性细胞存在于脑室区,此处细胞为未分化的NSC 和中间前体神经元;迁移区的细胞为正在迁移的神经元;皮质板区域的细胞为成熟的神经元(图3A)。可通过统计EGFP阳性细胞在各个分区所占的百分率来明确NSC 迁移的情况。在大脑皮质发育中,先形成Ⅴ~Ⅵ层神经元,后形成Ⅱ~Ⅳ层神经元。Ctip2(红色)是大脑皮质Ⅴ~Ⅵ层的标记物,孕17.5 d已初步发育完全,可通过与EGFP双标来观察NSC向大脑皮质Ⅴ~Ⅵ层发育的情况(图3B)。正在迁移的神经元形态呈双极神经元形态,下端膨大部分为胞体,上端细长部分为树突,以胞体为中心测量其远端树突的长度可确定迁移神经元发育的情况(图3C~E)。神经元的成熟包括树突、树突棘和突触形成等,孕17.5 d 皮质神经元树突已初步形成,在大脑皮质板区域可见大量发育成熟的神经元,通过测量神经元树突分支的密度、长度和胞体的面积,确定神经元成熟的情况(图3F~G)。
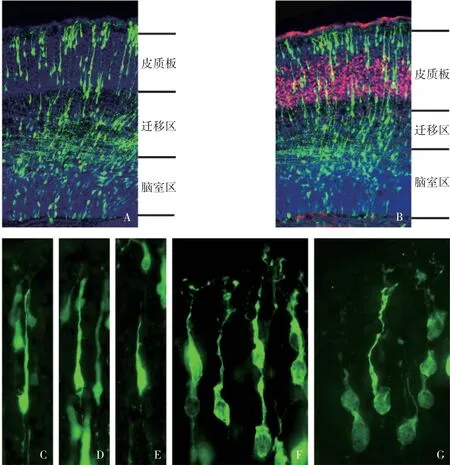
图3 大脑皮质NSC 的迁移和成熟情况
3 讨论
IUE实验技术具有高效、操作简单、可重复性强、费用低及胚胎发育研究适用范围广等优势[3]。IUE技术过程中胚胎的存活率高,质粒转染成功率高,Baumgart 等[13]研究发现IUE 电转后胚胎的存活率和转染成功率均大于90%,本实验结果与之一致。同时我们发现电转组胚胎重、头重指标与对照组胚胎相比差异无统计学意义。Comer 等[14]研究发现,IUE电转胎鼠出生后正常生长,可进行胚胎期调控大脑皮质基因表达对小鼠行为学影响的相关研究。以上研究说明IUE实验技术并不影响胚胎体格发育,是目前研究胚胎期大脑皮质发育学与功能学的最佳实验手段。
鼠胚神经发生的高峰期是孕12.5~18.5 d,期间NSC神经发育相关基因大量表达,在此时间段调控大脑皮质NSC 靶基因的表达,可对大脑皮质发育过程中靶基因功能进行充分研究。电转时间点可结合研究目的和可操作性来进行选择,一般选择孕12.5~15.5 d 进行[9],但孕12.5 d 和孕13.5 d 鼠胚脑室结构不清,肉眼下电转操作难度较大且鼠胚死亡率较高,从孕14.5 d开始鼠胚脑室结构清晰可见,电转后鼠胚存活率高。孕12.5~16.5 d 是NSC向中间前体神经元大量分化的时期;孕14.5~18.5 d是NSC 向皮质神经元分化迁移的高峰时期;孕16.5~18.5 d是神经元树突和突触早期发育的重要时期,本研究选择孕14.5 d电转既能保证胚胎的存活率和电转成功率,又能通过在电转后不同时间点取材,完整地观察到NSC 增殖、凋亡、分裂、定向分化、迁移和成熟的发育过程[15],因此孕14.5 d也是国外研究选择较多的电转时间点[9,16]。
大脑皮质正常的分层结构和完整的神经通路对认知、行为、运动、感觉和意识整合等高级功能至关重要,胚胎时期大脑皮质的正常发育是保证生后大脑正常生理功能的结构基础。研究发现,大脑皮质发育过程中NSC 的增殖、凋亡、定向分化、迁移和成熟等发生异常均会导致后代大脑皮质结构和功能出现障碍[17-18]。目前,利用IUE技术对NSC 的增殖、凋亡、定向分化、迁移和成熟等进行胚胎大脑皮质发育研究的方法在国外已成熟开展:László等[19]通过IUE技术调控迁移α/β神经元水解酶结构域蛋白4 (alpha/beta-hydrolase domain-containing 4,Abhd4)的表达,发现Abhd4促进大脑皮质迁移神经元的凋亡;Da Silva等[20]研究利用IUE 技术与细胞周期标志物EdU 和BrdU 进行双标发现当Wnt信号通路缺失时会导致大脑皮质NSC增殖减少、细胞周期延长,进一步利用IUE技术上调Wnt信号通路能够逆转上述表型,从而揭示了Wnt信号通路在NSC增殖和细胞周期中的分子机制;Geng 等[21]研究利用IUE 技术结合实时录像细胞工作站发现NSC 在缺失有丝分裂样蛋白2(mtotic kinesin-like protein 2,Kif20a)时出现定向分化异常,缺失Kif20a促进NSC分化成为中间前体神经元,NSC细胞数量减少,分化成为成熟神经元的数量也随之减少,最终导致皮质变薄;Nakagawa 等[22]通过IUE 技术联合启动子驱动质粒调控大脑皮质RGC 细胞运动介质蛋白1(mediator of cell motility 1,Memo1)的表达,发现Memo1基因敲除后RGC 细胞的放射轴结构紊乱,从而抑制NSC迁移;IUE技术也大量运用于神经元成熟的研究中,Zhong等[23]通过IUE技术调控神经元mTOR信号通路的表达,观察电转后神经元树突、兴奋性和抑制性突触等结构,发现突触上γ-氨基丁酸受体的形成依赖于mTOR信号通路。可见,国外学者已利用IUE技术在胚胎NSC和大脑皮质发育相关研究方面取得重要进展,但目前国内对于IUE技术尚处于提高成功率[24]和转染效率[25]的探索阶段。
除本研究中所涉及的大脑皮质NSC 增殖、凋亡、分裂、定向分化、迁移和成熟等研究外,利用IUE技术在胚胎脑室内转染目的基因后,还可结合启动子驱动表达质粒、时差显微镜和脑片培养等技术,进行NSC 行为追踪等多种胚胎神经发生相关研究[6]。
综上所述,利用IUE技术在胚胎脑室内转染目的基因,可进行大脑皮质NSC 的增殖、凋亡、分裂、定向分化、迁移和成熟等神经发育相关研究,IUE技术调控小鼠胚胎大脑皮质NSC基因表达体系的建立,能对深入研究大脑皮质发育相关基因的生理功能和致病机制具有重要的方法学意义。

