TXNIP/Trx-1/GPX4通路促进新生大鼠缺氧缺血后海马神经元铁死亡的作用机制
张新月 刘晨萌 马瑜徽 孟楠 蒋景英 余小河 王晓莉
(1.潍坊医学院医学影像学院,山东潍坊 261053;2.北京航空航天大学,北京 100191;3.中南大学湘雅医院,湖南长沙 410008)
新生儿缺氧缺血性脑病(hypoxic-ischemic encephalopathy,HIE)是围生期常见的严重疾病,可导致癫痫、永久性认知和神经功能障碍等并发症[1],但其发病机制尚不清楚。氧化应激在缺氧缺血 性 脑 损 伤 (hypoxic-ischemic brain damage,HIBD)中发挥重要作用[2],铁死亡作为氧化应激依赖性的新型程序性细胞死亡,不同于细胞凋亡、自噬和焦亡,多由铁积累和谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)的丢失诱导脂质过氧化引起[3]。有研究表明,新生大鼠缺氧缺血可导致海马神经元铁死亡,引起HIBD[4],但其发生铁死亡的具体机制尚待阐明。硫氧还原蛋白-1(thioredoxin-1,Trx-1)作为抗氧化剂,可以维持氧化还原稳态,在清除脂质活性氧和还原氧化蛋白方面发挥重要作用[5]。已有研究表明Trx-1 在抑制帕金森病相关的神经细胞铁死亡中起关键性作用,可上调GPX4表达参与调控铁死亡[6]。硫氧还原蛋白互作蛋白(thioredoxin-interacting protein,TXNIP)是硫氧还原蛋白系统的内源性抑制剂,可结合并负调控Trx-1,抑制其氧化还原调节能力,从而引起细胞的氧化应激反应、炎症和细胞死亡[7-8]。缺氧缺血(hypoxia-ischemia,HI)后是否通过TXNIP/Trx-1/GPX4通路导致铁死亡,从而导致HIBD,目前尚不清楚。因此,本研究通过建立HIBD模型,观察造模后海马TXNIP/Trx-1/GPX4通路诸分子及铁死亡的变化,并于侧脑室注射TXNIP 小干扰RNA(small interfering RNA,siRNA),沉默上游信号分子TXNIP mRNA的表达,观察下游信号分子及铁死亡的变化,从而探讨HI后脑神经细胞铁死亡的发生机制,以期为HIE的临床诊疗提供新思路。
1 材料与方法
1.1 实验动物及分组
SPF 级7 日 龄Sprague-Dawley 新 生 大 鼠72 只[SCXK(鲁)20190003,山东省济南朋悦实验动物繁育有限公司],雌雄不限,平均体重(11.8±1.5)g,采用随机数字表法分为假手术组(n=30)、HIBD 组(n=30) 及siRNA (TXNIP siRNA) 组(n=12)。假手术组与HIBD组根据造模后时间分为6 h、24 h、72 h 及7 d 4 个亚组,行Western blot 法检测(n=3);造模后24 h,假手术组与HIBD 组行激光散斑成像、组织切片检测(n=6);假手术组、HIBD组及siRNA组行组织铁、血清铁测定(n=4),实时荧光定量聚合酶链式反应(quantitative realtime polymerase chain reaction,qPCR)检测(n=4)和Western blot法检测(n=4)。
1.2 HIBD 模型的建立
采用经典的Rice-Vannucci 法建立HIBD 模型[9]。7日龄新生大鼠乙醚吸入麻醉后,剪开颈部正中皮肤,分离损伤(右)侧颈总动脉,电凝笔(RS-300,Roboz 公司,美国)电凝,消毒并缝合皮肤,置于低氧舱(DYC-Ⅲ,武汉七〇一研究所)内缺氧(氧舱氧浓度8.0%±0.1%,温度37℃)2 h,实验过程中全程监测,后放回母鼠笼中喂养。HIBD组与siRNA 组大鼠均建立HIBD 模型,假手术组大鼠仅分离右侧颈总动脉,不予电凝及缺氧处理。
1.3 颅骨表面血流量测定
造模后24 h,HIBD 组和假手术组新生大鼠乙醚吸入麻醉后,手术剪沿头背部正中纵向剪开皮肤,暴露颅骨,将新生大鼠置于激光散斑成像台内,调整焦距使图像清晰。采用moorO2Flo 组织血流血氧实时成像系统观察新生大鼠脑血流量,激光检视光源,前囟到“人”字点设置感兴趣区(region of interest,ROI)[10],观察过程中可滴入丙三醇保持颅骨表面湿润。通过系统将原始散斑图像转换成脑血流图像并计算ROI脑血流量。
1.4 侧脑室注射TXNIP siRNA
siRNA组新生大鼠固定于立体定位仪上,正中剪开头皮,于损伤侧侧脑室(坐标AP:-0.5 mm,ML:-2 mm,DV:-2 mm)缓慢注入3 μL TXNIP siRNA 与转染试剂混合液[11],1 μL/min 缓慢注入,留针2 min后拔针缝合头皮,复温苏醒后回母鼠身边饲养。假手术组与HIBD组于相同部位注射3 μL 0.9%氯化钠溶液。
1.5 标本的采集与处理
造模后24 h,3 组新生大鼠腹腔注射3%戊巴比妥钠15 mg/kg,分别取血清和损伤侧海马组织,放至-80℃冰箱冻存,行血清铁含量、组织铁含量、Western blot及qPCR检测;另行常规心脏灌注取脑组织,4%多聚甲醛后固定,梯度乙醇脱水、二甲苯透明,浸蜡、石蜡包埋,取海马层面脑组织行冠状位连续切片,厚度为4 μm,每3~5 张切片取1 张切片,分别行苏木精-伊红(hematoxylineosin,HE)染色、免疫荧光染色。
1.6 HE染色
石蜡切片,二甲苯脱蜡、梯度酒精水化,采用HE 染色试剂盒(北京索莱宝科技有限公司,G1120)染色,行苏木精染核10 min后,盐酸酒精分色30 s,去离子水冲洗,伊红染液染浆2 min,无水乙醇脱水、二甲苯透明,中性树胶封片。置于光学显微镜下观察新生大鼠损伤侧海马CA1 区神经细胞病理形态学改变。
1.7 Western blot 法检测新生大鼠损伤侧海马组织TXNIP、Trx-1及GPX4蛋白表达
造模后6 h、24 h、72 h 及7 d,Western blot 法检测造模后新生大鼠损伤侧海马组织GPX4蛋白表达。造模后24 h,Western blot 法检测造模后新生大鼠损伤侧海马组织TXNIP、Trx-1 蛋白表达。提取新生大鼠损伤侧海马组织,采用BCA 蛋白浓度测定试剂盒(北京索莱宝科技有限公司,PC0020)测定蛋白浓度。制备12%SDS-PAGE分离胶,经电泳、转膜、封闭后,加入兔抗TXNIP、Trx-1、GPX4 (浓 度 均 为1∶500), 鼠 抗GAPDH(Proteintech,武汉三鹰生物技术有限公司,浓度1∶10 000)一抗后,4℃冰箱过夜。次日,分别加入山羊抗兔或山羊抗鼠二抗。使用高性能成像系统(Protein Simple,美国) 曝光并拍照,采用Image J进行灰度值测定。
1.8 免疫荧光染色法检测新生大鼠损伤侧海马CA1区神经细胞TXNIP、Trx-1及GPX4蛋白表达
造模后24 h,石蜡切片,脱蜡、水化,进行抗原修复,0.3%TritonX-100透膜,5%BSA-PBS封闭1 h 后,加入兔抗GPX4(1∶200,Affinity,英国)与鼠抗NeuN(1∶200,Chemicon,美国)一抗混合液或兔抗GPX4(1∶200,Affinity,英国)与鼠抗GFAP(1∶200,武汉博士德生物工程有限公司) 一 抗 混合液、兔抗Trx-1 (1∶200,Cell Signaling Technology, 美 国)、 兔 抗 TXNIP(1∶200,Affinity,英国),4℃冰箱过夜。次日37℃孵育箱复温,0.01M PBS 洗涤3 遍后,滴加Alexa Fluor 488 标记的山羊抗兔IgG (1∶200)、Alexa Fluor 594标记的山羊抗鼠IgG(1∶200)荧光二抗(北京中杉金桥生物技术有限公司)混合液,37℃避光孵育1 h 后PBS 冲洗,含4',6-二脒基-2-苯 基 吲 哚(4',6-diamidino-2-phenylindole,DAPI)的荧光封片剂(F6507,Sigma,美国)封片。置于正置荧光显微镜下进行观察、拍照并统计各组损伤侧 海 马CA1 区NeuN+GPX4+/NeuN+、 GFAP+GPX 4+DAPI+、TXNIP+DAPI+、Trx-1+DAPI+细胞数。
1.9 血清铁测定
造模后24 h,3组取新生大鼠上层清亮血清,采用血清铁测定试剂盒(A039-1-1,南京建成生物工程研究所),加入铁显色剂,取上清液置于96孔板中,酶标仪在520 nm波长下测定各孔吸光度OD值。
1.10 损伤侧海马组织铁测定
造模后24 h,采用组织铁含量测定试剂盒(北京索莱宝科技有限公司,BC4355)测定新生大鼠损伤侧海马组织铁含量。3组分别称取损伤侧海马组织,以1 g/mL 比例加入提取液进行冰浴匀浆。5 952 r/min,4℃离心10 min,取上清120 μL,加入组织铁试剂,后加入60 μL 氯仿,充分震荡混匀,室温下10 000 r/min 离心10 min,吸取上层无机相200 μL置于96孔板,酶标仪在520 nm波长下测定吸光度。组织铁含量计算公式:每克组织中铁 含 量(μg/g) =6.98× ΔA 测 定(定 义 为0.125 μmol/mL Fe3+标准液吸光度A-蒸馏水吸光度A)÷ΔA 标准(定义为样本吸光度A-蒸馏水吸光度A)÷样本质量(g)。
1.11 qPCR 检测新生大鼠损伤侧海马组织TXNIP、Trx-1、GPX4 mRNA表达
3组分别取新生大鼠损伤侧海马组织,提取样本总RNA,将总RNA 逆转录为cDNA。以cDNA 为模板,采用Bio Rad CFX Manager荧光定量PCR仪,SYBR Green 荧光染料法进行相对定量。采用20 μL体 系,加 入cDNA 模 板1 μL、无 酶 水7.8 μL、SYBR Premix 荧光定量反应试剂10 μL,上游、下游引物各0.6 μL,反应条件:95℃预变性10 min,PCR 反应 阶段:95℃变 性10 s,60℃退 火10 s,72℃延伸30 s,共循环40 次,结果以Cq 值表示,采用2-△△Cq法比较TXNIP、Trx-1、GPX4 mRNA 在各组新生大鼠损伤侧海马组织中表达的差异。
引 物 序 列 为: GAPDH: 上 游(5'-3'):ACAGCAACAGGGTGGTGGAC, 下 游 (5'-3'):TTTGAGGGTGCAGCGAACTT;TXNIP:上游(5'-3'):CATGTTCCCGAATCGTGGTC,下游(5'-3'):CTTGGAGCCAGGGACACTAA;Trx-1:上游(5'-3'):AAGGAAGCTTTTCAGGAGGC,下游(5'-3'):GGCAGTCATCCACGTCTACT;GPX4:上 游(5'-3):AATTCGCAGCCAAGGACATC,下游(5'-3):AGGCCAGGATTCGTAAACCA。
1.12 统计学分析
数据分析采用SPSS 22.0 统计学软件。计量资料采用均数±标准差(±s)表示,两组间比较采用两样本t检验分析,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 造模后24 h,新生大鼠损伤侧脑血流量变化
造模后24 h,假手术组新生大鼠可维持一定的脑血流量;HIBD组损伤侧ROI脑血流量急剧下降,低于假手术组[(687±75)PU vs(1 432±99)PU,t=14.654,P<0.001]。见图1。

图1 造模后24 h,新生大鼠损伤侧脑血流量变化
2.2 造模后24 h,新生大鼠损伤侧海马CA1区神经细胞形态学变化
造模后24 h,假手术组新生大鼠损伤侧海马CA1 区神经细胞排列紧密整齐,形态规则;HIBD组新生大鼠损伤侧海马CA1 区神经细胞排列疏松紊乱,形态不规则。见图2。
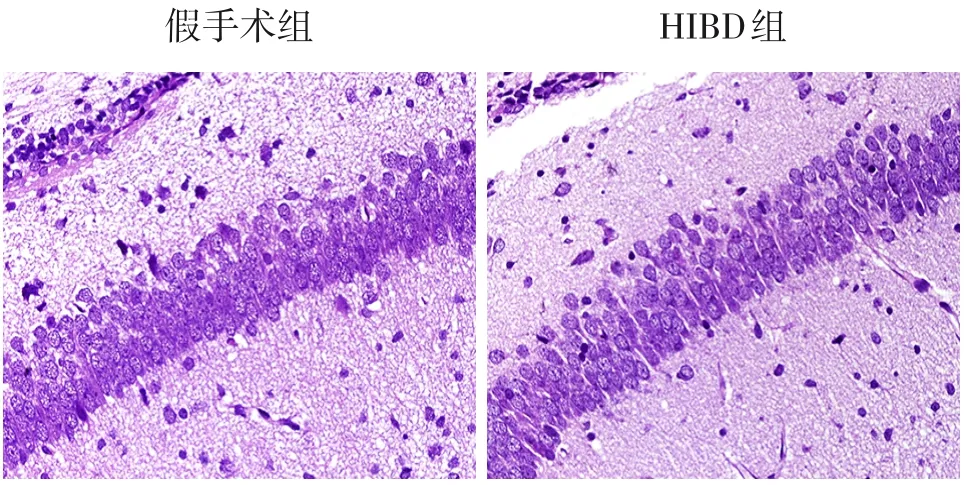
图2 造模后24 h,新生大鼠损伤侧海马CA1 区神经细胞形态学变化
2.3 造模后,新生大鼠损伤侧海马组织TXNIP、Trx-1、GPX4蛋白表达水平变化
造模后6 h,HIBD 组损伤侧海马组织GPX4 蛋白表达水平低于假手术组(P<0.05);造模后24 h,HIBD 组损伤侧海马组织GPX4 蛋白表达水平低于造模后6 h(P<0.05);造模后72 h、7 d,HIBD 组损伤侧海马组织GPX4 蛋白表达水平高于造模后24 h(P<0.05);造模后各时间点,HIBD 组GPX4蛋白表达水平均低于假手术组(均P<0.05),见图3、表1。造模后24 h,siRNA 组损伤侧海马组织GPX4 蛋白、Trx-1 蛋白表达水平高于HIBD 组,但低于假手术组(均P<0.05);HIBD组损伤侧海马组织GPX4 蛋白、Trx-1 蛋白表达水平低于假手术组;HIBD 组、siRNA 组损伤侧海马组织TXNIP 蛋白表达水平均高于假手术组,且siRNA组TXNIP蛋白表达水平低于HIBD组(均P<0.05)。见图4、表2。
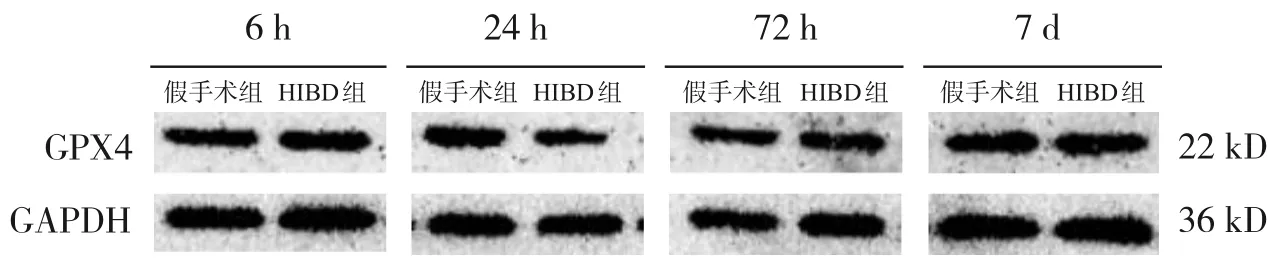
图3 各组新生大鼠造模后不同时间点损伤侧海马组织GPX4蛋白表达条带图
表1 新生大鼠造模后不同时间点损伤侧海马组织GPX4蛋白表达水平比较 (± s,n=3)
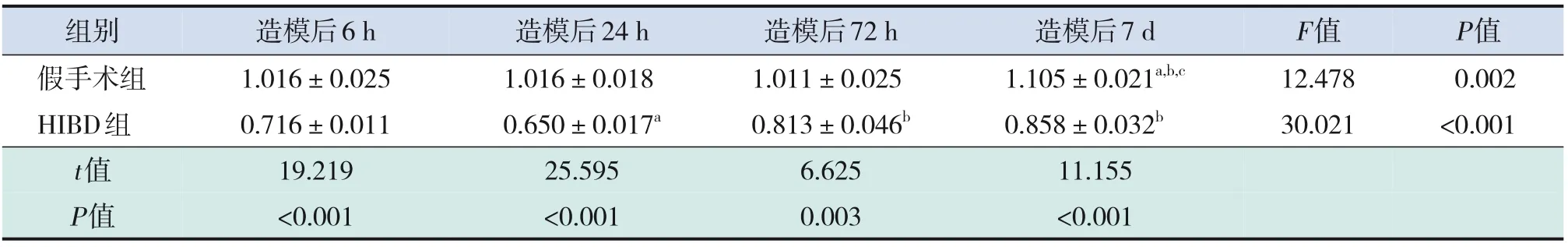
表1 新生大鼠造模后不同时间点损伤侧海马组织GPX4蛋白表达水平比较 (± s,n=3)
注:a示与同组造模后6 h相比,P<0.05;b示与同组造模后24 h相比,P<0.05;c示与同组造模后72 h相比,P<0.05。[HIBD]缺氧缺血性脑损伤;[GPX4]谷胱甘肽过氧化物酶4。
组别假手术组HIBD组t值P值造模后6 h 1.016±0.025 0.716±0.011 19.219<0.001造模后24 h 1.016±0.018 0.650±0.017a 25.595<0.001造模后72 h 1.011±0.025 0.813±0.046b 6.625 0.003造模后7 d 1.105±0.021a,b,c 0.858±0.032b 11.155<0.001 F值12.478 30.021 P值0.002<0.001
表2 造模后24 h,3组新生大鼠损伤侧海马组织GPX4、TXNIP、Trx-1蛋白表达水平比较 (± s,n=4)
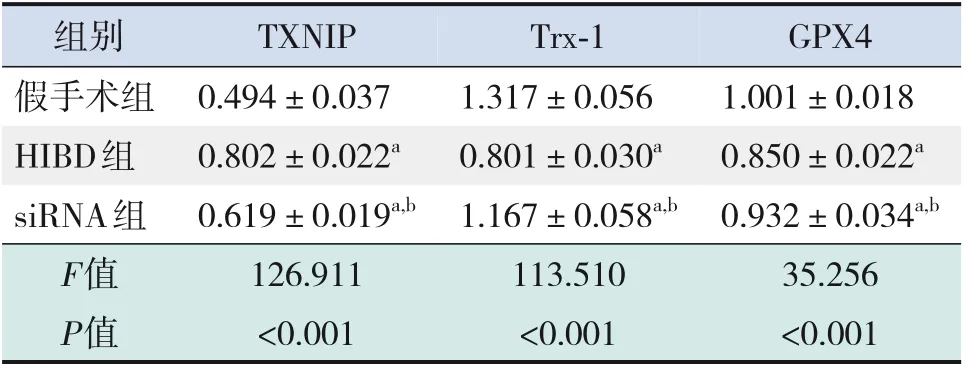
表2 造模后24 h,3组新生大鼠损伤侧海马组织GPX4、TXNIP、Trx-1蛋白表达水平比较 (± s,n=4)
注:a 示与假手术组相比,P<0.05;b 示与HIBD 组相比,P<0.05。[HIBD] 缺氧缺血性脑损伤;[siRNA] 小干扰RNA;[TXNIP]硫氧还原蛋白互作蛋白;[Trx-1]硫氧还原蛋白-1;[GPX4]谷胱甘肽过氧化物酶4。
组别假手术组HIBD组siRNA组F值P值TXNIP 0.494±0.037 0.802±0.022a 0.619±0.019a,b 126.911<0.001 Trx-1 1.317±0.056 0.801±0.030a 1.167±0.058a,b 113.510<0.001 GPX4 1.001±0.018 0.850±0.022a 0.932±0.034a,b 35.256<0.001
2.4 造模后24 h,新生大鼠损伤侧海马CA1区神经细胞中TXNIP、Trx-1、GPX4蛋白表达水平变化
NeuN 是神经元标志物,GFAP 是星形胶质细胞标志物。造模后24 h,HIBD 组损伤侧海马CA1区NeuN+GPX4+/NeuN+低于假手术组(P<0.05);假手术组、HIBD 组损伤侧海马CA1 区均几乎未见GFAP+GPX4+细胞。HIBD 组损伤侧海马CA1 区TXNIP+细胞数高于假手术组(P<0.05);HIBD组损伤侧海马CA1 区Trx-1+细胞数低于假手术组(P<0.05)。见图5~8,表3。
表3 造模后24 h,损伤侧海马CA1区神经细胞中TXNIP、Trx-1、GPX4蛋白表达水平比较 (± s,n=6)
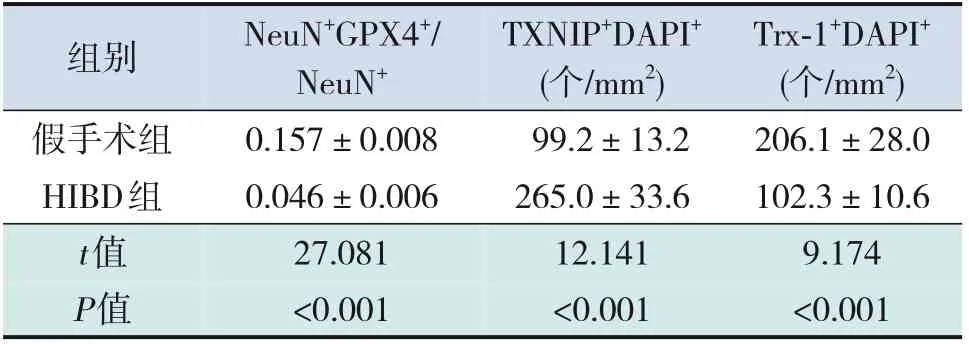
表3 造模后24 h,损伤侧海马CA1区神经细胞中TXNIP、Trx-1、GPX4蛋白表达水平比较 (± s,n=6)
注:[NeuN]神经元核抗原;[GPX4]谷胱甘肽过氧化物酶4;[TXNIP]硫氧还原蛋白互作蛋白;[Trx-1]硫氧还原蛋白-1;[DAPI]4',6-二脒基-2-苯基吲哚;[HIBD]缺氧缺血性脑损伤。
组别假手术组HIBD组t值P值NeuN+GPX4+/NeuN+0.157±0.008 0.046±0.006 27.081<0.001 TXNIP+DAPI+(个/mm2)99.2±13.2 265.0±33.6 12.141<0.001 Trx-1+DAPI+(个/mm2)206.1±28.0 102.3±10.6 9.174<0.001
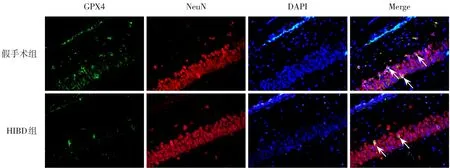
图5 造模后24 h,新生大鼠损伤侧海马CA1区神经元中铁死亡的变化
2.5 3 组新生大鼠血清及损伤侧海马组织铁含量变化
造模后24 h,HIBD 组与siRNA 组血清铁、损伤侧海马组织铁含量均高于假手术组;siRNA组血清铁、损伤侧海马组织铁含量均低于HIBD组(均P<0.05)。见表4。
表4 3组血清铁及损伤侧海马组织铁含量比较(± s,n=4)

表4 3组血清铁及损伤侧海马组织铁含量比较(± s,n=4)
注:a 示与假手术组相比,P<0.05;b 示与HIBD 组相比,P<0.05。[HIBD]缺氧缺血性脑损伤;[siRNA]小干扰RNA。
组别假手术组HIBD组siRNA组F值P值血清铁(mg/L)3.103±0.092 4.529±0.216a 4.245±0.186a,b 75.811<0.001组织铁(μg/g)1.663±0.134 2.183±0.096a 1.845±0.037a,b 29.062<0.001
2.6 3 组新生大鼠海马组织TXNIP、Trx-1、GPX4 mRNA表达水平变化
造模后24 h,HIBD 组与siRNA 组损伤侧海马组织TXNIP mRNA表达水平高于假手术组;siRNA组TXNIP mRNA 表达水平低于HIBD 组(均P<0.05)。HIBD 组损伤侧海马组织Trx-1、GPX4 mRNA表达水平低于假手术组,siRNA组损伤侧海马组织Trx-1、GPX4 mRNA 表达水平高于HIBD 组(均P<0.05)。见表5。
表5 造模后24 h,3组损伤侧海马组织各mRNA表达水平比较 (±s,n=4)
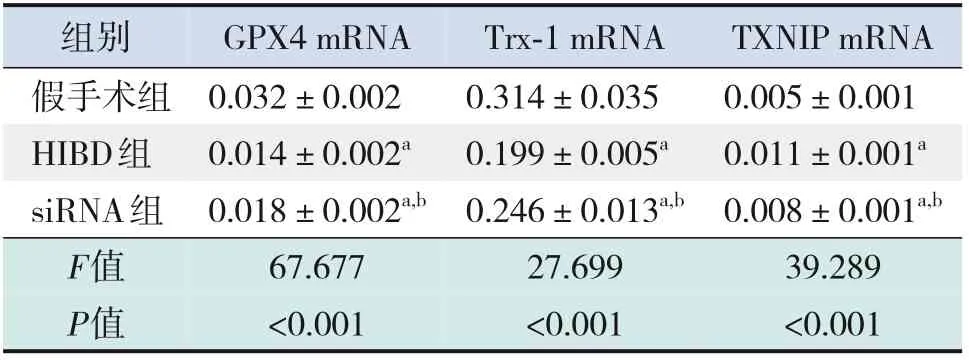
表5 造模后24 h,3组损伤侧海马组织各mRNA表达水平比较 (±s,n=4)
注:a 示与假手术组相比,P<0.05;b 示与HIBD 组相比,P<0.05。[HIBD] 缺氧缺血性脑损伤;[siRNA] 小干扰RNA;[GPX4] 谷胱甘肽过氧化物酶4;[Trx-1] 硫氧还原蛋白-1;[TXNIP]硫氧还原蛋白互作蛋白。
组别假手术组HIBD组siRNA组F值P值GPX4 mRNA 0.032±0.002 0.014±0.002a 0.018±0.002a,b 67.677<0.001 Trx-1 mRNA 0.314±0.035 0.199±0.005a 0.246±0.013a,b 27.699<0.001 TXNIP mRNA 0.005±0.001 0.011±0.001a 0.008±0.001a,b 39.289<0.001
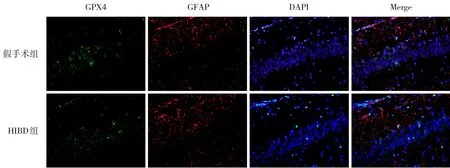
图6 造模后24 h,新生大鼠损伤侧海马CA1区星形胶质细胞中铁死亡的变化

图7 造模后24 h,新生大鼠损伤侧海马CA1区神经细胞中TXNIP 蛋白表达的变化
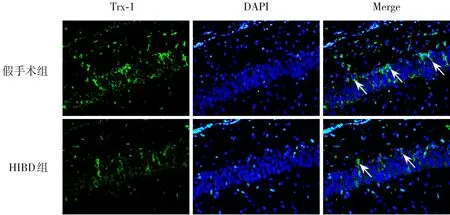
图8 造模后24 h,新生大鼠损伤侧海马CA1区神经细胞中Trx-1蛋白表达的变化
3 讨论
最新研究表明,铁死亡是一种新型程序性细胞死亡,与HIBD密切相关[12]。本研究发现造模后24 h,激光散斑成像结果显示HIBD 组新生大鼠损伤侧脑血流量低于假手术组,提示HIBD新生大鼠模型损伤侧颈总动脉血流已阻断;HE 染色结果显示,新生大鼠损伤侧海马CA1 区神经细胞排列紊乱,形态不规则,均提示HIBD模型建立成功。
本研究还发现HIBD组血清铁、损伤侧海马组织铁含量均高于假手术组,提示HI 后新生大鼠血液及组织中铁含量超载可能导致铁死亡。
GPX4是铁死亡关键蛋白[13]。Western blot结果发现造模后各时间点HIBD 组损伤侧海马组织GPX4蛋白表达水平均低于假手术组,造模后24 h,HIBD组损伤侧海马组织GPX4蛋白表达水平较低,且低于造模后其他时间点,提示HI后可致GPX4蛋白表达下调,导致铁死亡,这与文献[14]报道一致,但HI 后海马CA1 区铁死亡的细胞定位尚不清楚。本研究采用NeuN/GPX4、GFAP/GPX4 免疫荧光双标染色,结果显示造模后24 h,HIBD 组损伤侧海马CA1 区NeuN+GPX4+/NeuN+低于假手术组,假手术组和HIBD 组损伤侧海马CA1 区几乎未见GFAP+GPX4+细胞,提示HI后,铁死亡主要发生在海马神经元。
TXNIP 是Trx-1 的抑制剂,可与其结合并抑制Trx-1 的抗氧化功能,导致氧化应激,但TXNIP/Trx-1通路是否与HI后海马神经元铁死亡相关尚不清 楚[15-16]。本 研 究 发 现 造 模 后24 h,qPCR 与Western blot 结果提示HIBD 组损伤侧海马组织TXNIP mRNA 与蛋白表达水平均高于假手术组,Trx-1、GPX4 mRNA与蛋白表达水平均低于假手术组,提示HI 可上调信号分子TXNIP 的表达,进而抑制Trx-1、GPX4蛋白表达,导致铁死亡。免疫荧光染色结果亦发现,HIBD 组损伤侧海马CA1 区TXNIP+细胞数较假手术组增多,Trx-1+细胞数较假手术组减少,进一步说明HI 可通过TXNIP/Trx-1/GPX4通路调控铁死亡。
为验证HI 能否通过激活TXNIP/Trx-1/GPX4 通路导致新生大鼠铁死亡,本研究采用损伤侧侧脑室注射TXNIP siRNA法干扰TXNIP基因表达,造模后24 h,siRNA组血清铁、损伤侧海马组织铁含量均低于HIBD 组,表明沉默TXNIP基因可抑制HIBD 新生大鼠血液中铁超载及损伤侧海马组织铁死亡。qPCR 和Western blot 检测结果显示,siRNA组损伤侧海马组织TXNIP mRNA 及蛋白表达水平低于HIBD 组,Trx-1、GPX4 mRNA 及蛋白表达水平高于HIBD 组,说明沉默TXNIP基因可调控HIBD 新生大鼠TXNIP 下游因子Trx-1、GPX4基因及其蛋白表达变化,引起铁死亡,导致HIBD。
综上,新生大鼠HI 通过激活TXNIP/Trx-1/GPX4通路,诱发新生大鼠海马神经元铁死亡,进而导致HIBD。
利益冲突声明:所有作者均声明不存在利益冲突。

