卵巢低级别浆液性肿瘤中KRAS、NRAS、PIK3CA、BRAF突变及其与患者临床病理特征和激素表达的相关性分析
陆婷,张娟娟,王晚璞,韦红果,魏金玲,张勇,王丽*
1昆明医科大学第一附属医院肿瘤科,云南昆明 650500;2云南省第一人民医院病理科,云南昆明 650500
卵巢癌是最常见的妇科癌症之一,病死率位居首位[1]。卵巢癌的发生与遗传、环境和生活方式等因素密切相关,怀孕、哺乳和口服避孕药等可降低卵巢癌的发生风险[2-3]。卵巢恶性肿瘤中约90%为上皮性卵巢癌(epithelial ovarian carcinoma,EOC),其中浆液性卵巢癌(serous ovarian carcinoma,SOC)约占EOC的75%[4]。近年来,已将浆液性卵巢肿瘤分为浆液性囊腺瘤、浆液性交界性肿瘤(serous borderline tumour,SBT)、低级别浆液性癌(lowgrade serous carcinoma,LGSC)和高级别浆液性癌(high-grade serous carcinoma,HGSC),其中SBT又分为普通型SBT和微乳头型SBT[5-6]。目前认为,LGSC与HGSC在本质上是不同类型的肿瘤,LGSC多见于较年轻的育龄女性,通常继发于SBT,且存在KRAS、NRAS、BRAF基因突变[7-8]。在临床病理中,普通型SBT被认为是微乳头型SBT的前体病变,而微乳头型SBT则被认为是一种非浸润性低级别浆液性癌。KRAS、NRAS、PIK3CA和BRAF基因是表皮生长因子受体(epidermal growth factor receptor,EGFR)依赖的下游信号转导通路RASRAF-MAPK途径和PI3K-AKT途径的4个重要基因,它们可持续激活下游信号通路,引起细胞异常增殖分化,导致肿瘤的发生发展[9-12]。本研究检测KRAS、NRAS、PIK3CA、BRAF基因在卵巢低级别浆液性肿瘤中的突变情况,并分析其与临床病理特征及雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)表达的关系,旨在为卵巢浆液性肿瘤的临床诊断、治疗和预后评估提供一定的参考。
1 资料与方法
1.1 研究对象 收集云南省第一人民医院病理科2017年1月-2021年4月诊断为SBT或LGSC患者的病理资料。排除标准:非原发病例;术前接受新辅助治疗者;无法获得病理石蜡切片标本及临床信息不足者。基于世界卫生组织(WHO)和国际妇产科联盟(FIGO)的相关诊断标准,收集所有标本对应的患者临床资料,包括年龄、累及部位(单侧或双侧)、组织学类型、肿块大小、TNM分期、淋巴结累及情况。共纳入64份甲醛溶液固定石蜡包埋(FFPE)的卵巢浆液性肿瘤组织样本进行评估。所有组织切片均由两位副高级别的医师独立复阅且诊断意见一致。本研究获云南省第一人民医院伦理委员会批准(KHLL2022-YJ005),所有患者及其家属均签署知情同意书。
1.2 主要试剂及仪器 核酸提取试剂盒、AmoyDx人类KRAS/NRAS/PIK3CA/BRAF基因突变联合检测试剂盒购自厦门艾德生物医药科技股份有限公司;免疫组化试剂盒均购自福州迈新生物技术开发有限公司;NanoDrop ND-1000购自上海赛默飞创新科技公司。光学显微镜购自德国Leica公司;Applied Biosystems ABI 7500购自上海邦典机电设备有限公司。
1.3 方法
1.3.1 石蜡组织处理 为再次核对石蜡组织切片的肿瘤类型,HE染色后由两位副高级别的病理医师进行评估。随后,按照试剂盒说明书提取石蜡组织DNA。具体操作步骤如下:组织脱蜡后,加入DTL缓冲液和蛋白酶K,混匀后56 ℃消化过夜;加入DES缓冲液,混匀后90 ℃孵育1 h;加入DTB缓冲液和无水乙醇,混匀后13 000×g离心1 min,离心后弃去管中液体;加入DW1缓冲液(已加入17 ml无水乙醇并充分混匀),10 000×g离心1 min后弃去管中液体;加入缓冲液DW2(已加入24 ml无水乙醇并充分混匀),10 000×g离心1 min后更换新的收集管,再次13 000×g离心1 min;将DNA吸附柱转移至新的离心管,加入DTE缓冲液,静置5 min后13 000×g离心1 min,离心管中为样品DNA;使用NanoDrop ND-1000测定DNA浓度和纯度,并将DNA稀释至3 ng/μl待用。
1.3.2 基因突变检测 采用扩增阻碍突变系统-聚合酶链反应技术检测人类KRAS基因第2、3、4号外显子上15种体细胞突变(其中12种为热点突变),NRAS基因第2和3外显子上12种体细胞突变(其中3种为热点突变),PIK3CA基因20号外显子的2种体细胞突变(其中1种为热点突变),BRAF基因15号外显子的4种体细胞突变(其中1种为热点突变)。试剂盒采用12联PCR反应条设计,每一个12联PCR条检测一个样本,12联条的1-11号管内装有相应的基因突变检测和内控试剂,12号管作为DNA提取质量的外控检测管。严格按照试剂盒说明书进行样本DNA的浓度稀释、配制、加样、PCR反应循环参数设置及结果分析解释。具体操作如下:分别向体积均为65.8 μl的待测样品DNA、KNPB阳性对照(PC)和纯化水(NTC)中加入4.2 μl KNPB混合酶,混匀后3000×g离心15 s;将混匀的DNA样品依次取5 μl分别加入12联KNPB PCR反应条中,KNPB阳性对照(PC)和阴性对照(NTC)操作同上;按照PCR反应条1-12号管方向,依次将阳性对照、阴性对照和样本KNPB PCR反应条平行放入实时定量PCR仪检测。PCR反应条件为:95 ℃ 5 min;95 ℃ 25 s、64 ℃ 20 s、72 ℃ 20 s,15个循环;93 ℃ 25 s、60 ℃35 s、72 ℃ 20 s,31个循环。
1.3.3 免疫组化检测ER、PR水平 阳性对照为乳腺导管浸润癌组织标本切片,阴性对照则以磷酸盐缓冲液(PBS)代替一抗,严格按照制造商说明书进行操作。具体操作如下:将石蜡组织脱蜡至水,PBS洗3次;高压加热EDTA抗原修复液(pH:9.0)修复,PBS洗3次;加3%H2O2阻断内源性过氧化物酶,室温下孵育15 min后PBS洗3次;加ER抗体或PR抗体,28 ℃下孵育75 min,PBS洗3次;加酶标羊抗小鼠/兔IgG聚合物二抗,28 ℃下孵育45 min,PBS洗4次;DAB显色、苏木精复染、乙醇脱水、二甲苯透明、封片后观察。结果判定标准:ER和PR表达均位于细胞核。以染色强度和阳性细胞综合计分作为判定标准。染色强度(无色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分)和阳性细胞百分比(无阳性细胞为0分,阳性细胞≤10%为1分,阳性细胞10%~50%为2分,阳性细胞50%~75%为3分,阳性细胞>75%为4分)分值相乘,乘积不低于3分者判定为免疫组化染色阳性。
1.4 相关指标分析 分析KRAS、NRAS、PIK3CA、BRAF基因突变的类型和频率,各基因的突变状态与肿瘤组织学类型、患者临床病理特征的关系,以及ER、PR表达与肿瘤组织学类型和各基因突变之间的关系。
1.5 统计学处理 采用SPSS 26.0软件进行统计分析。计量资料以±s表示,肿瘤组织中ER、PR的免疫组化评分比较采用单因素方差分析,进一步两两比较采用SNK-q检验;计数资料以例(%)表示,各基因突变状态与不同临床病理特征、激素受体表达状态之间的比较采用χ2检验或Fisher精确概率法。P<0.05为差异有统计学意义。
2 结 果
2.1 基本临床资料 64例患者中,普通型SBT 23例,微乳头型SBT 27例,LGSC 14例;≤35岁者30例,>35岁者34例;肿瘤累及单侧42例,双侧22例;肿瘤最大径<10 cm者38例,≥10 cm者26例;TNM分期为早期(Ⅰ-Ⅱ期)者50例,晚期(Ⅲ-Ⅳ期)者14例;淋巴结受累者3例,淋巴结未受累者61例。
2.2KRAS、NRAS、PIK3CA、BRAF基因突变的类型和频率 共检测出36例突变,其中KRAS突变21例、BRAF突变12例、PIK3CA突变2例、NRAS突变1例。KRAS突变均为2号外显子的12、13密码子突变,检出率为32.8%(21/64),其中G12S、G12D占42.9%(9/21),G12C、G12R*、G12V、G12A、G13C*占47.6%(10/21),G13D占9.5%(2/21)。BRAF突变检出率为18.8%(12/64),突变类型为V600E、V600K*、V600R*、V600D*。PIK3CA突变检出率为3.1%(2/64),突变类型为H1047R、H1047L*。NRAS突变检出率为1.7%(1/64),突变类型为G13R*、G12C*、G12V*、G12A*、G13V*。未发现KRAS、NRAS、PIK3CA、BRAF基因之间存在交叉突变。基因突变扩增图谱详见图1。
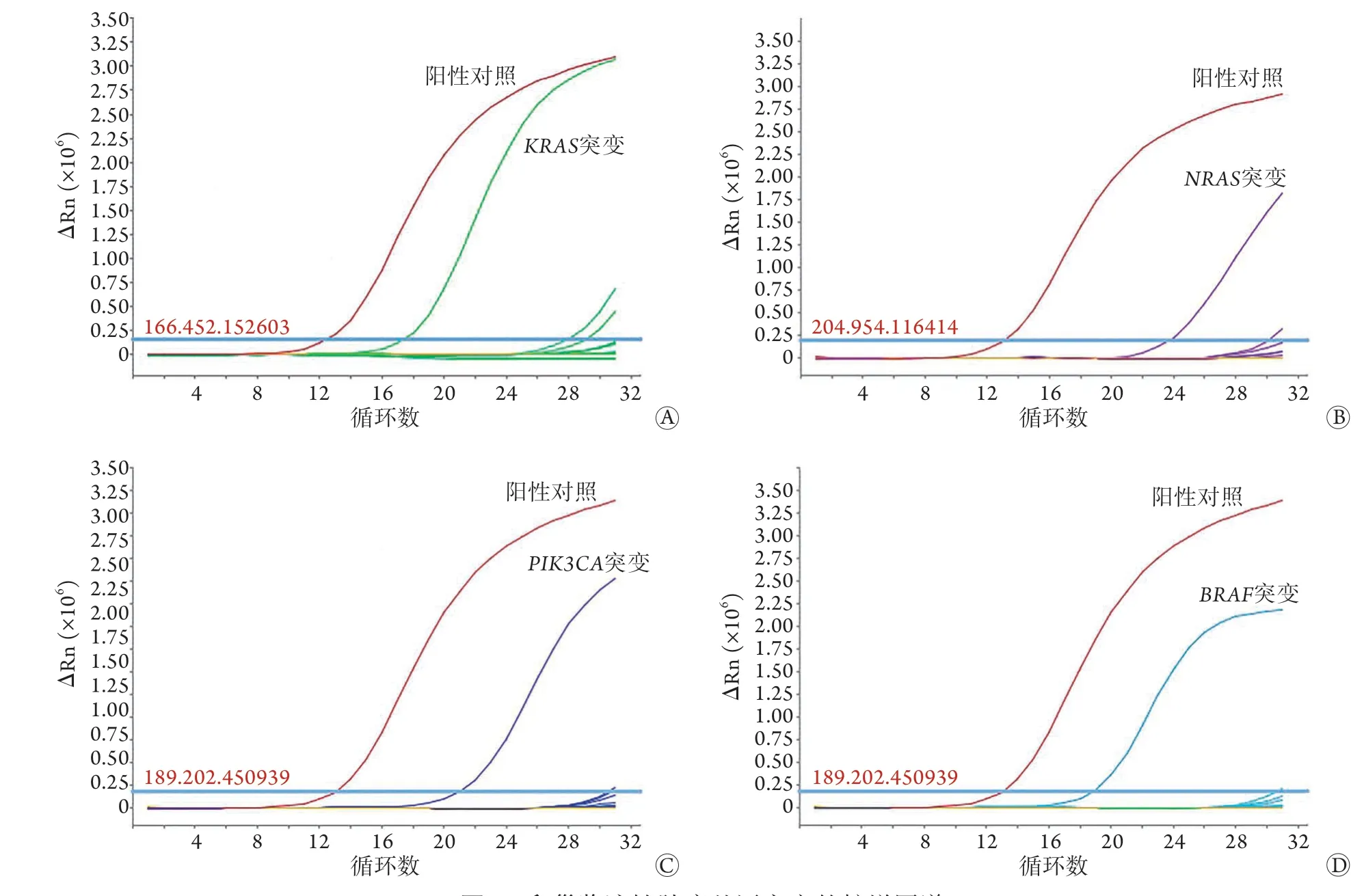
图1 卵巢浆液性肿瘤基因突变的扩增图谱Fig.1 Amplification map of the gene mutations in ovarian serous tumors
2.3 各基因突变状态与肿瘤组织学类型的关系普通型SBT组织中基因突变检出率(73.9%)最高,其次为微乳头型SBT(51.9%),LGSC最低(35.7%)。SBT与LGSC间BRAF突变检出率差异无统计学意义(P>0.05)。在KRAS突变亚型中,普通型SBT组织中G12C、G12R*、G12V、G12A、G13C*的检出率明显高于微乳头型SBT和LGSC(P<0.05),而微乳头型SBT组织中KRAS突变亚型G12S、G12D的检出率高于普通型SBT和LGSC(P<0.05)。KRAS突变亚型G13D仅在LGSC中被检出,明显高于普通型SBT和微乳头型SBT(P<0.05),卵巢浆液性肿瘤中KRAS、BRAF突变类型详见表1。此外,1例NRAS突变在LGSC中被检出,2例PIK3CA突变分别在LGSC、微乳头型SBT中被检出。
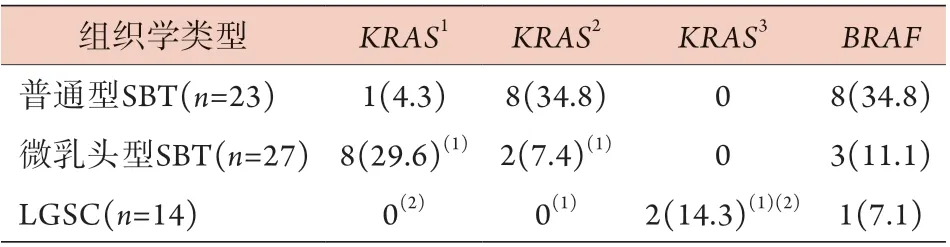
表1 卵巢浆液性肿瘤中KRAS、BRAF突变分析[例(%)]Tab.1 Analysis of KRAS and BRAF mutations in ovarian serous tumors [n(%)]
2.4 各基因突变状态与临床病理特征的关系≤35岁患者的肿瘤组织中KRAS总突变率明显高于>35岁者(P=0.027),其中以G12C、G12R*、G12V、G12A、G13C*突变最突出,但差异无统计学意义(P=0.052)。KRAS突变亚型在不同肿瘤累及部位、TNM分期、肿瘤最大径及淋巴结累及患者中差异无统计学意义(P>0.05)。BRAF突变常发生于≤35岁(P=0.030)或单侧受累(P=0.015)的患者。所有BRAF突变均见于疾病早期阶段的患者,且无淋巴结受累。BRAF突变在不同TNM分期、肿瘤最大径及淋巴结累及患者中差异无统计学意义(P>0.05,表2)。NRAS、PIK3CA突变在不同临床病理特征的患者中差异均无统计学意义(P>0.05)。
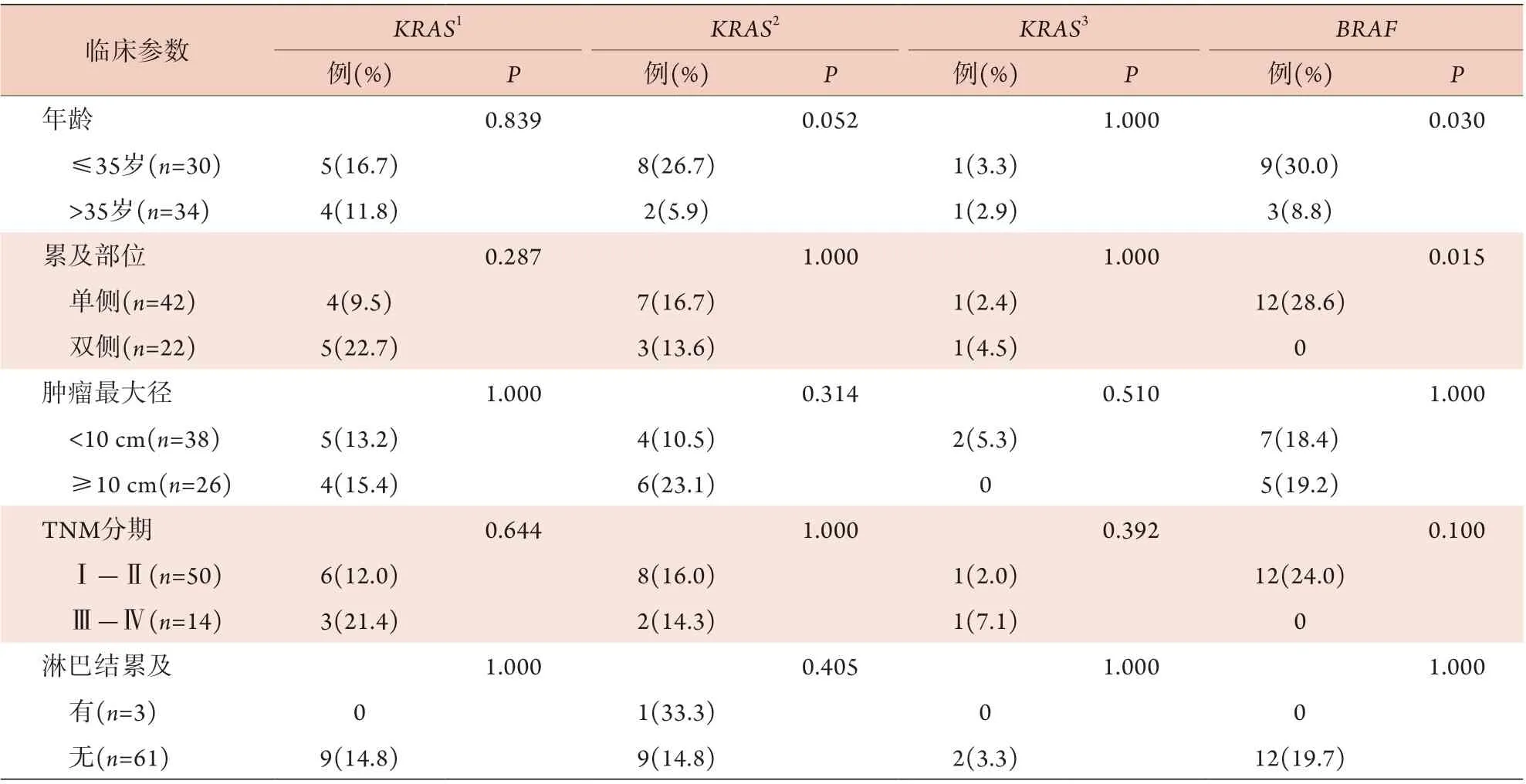
表2 卵巢浆液性肿瘤KRAS、BRAF突变与临床病理特征的关系Tab.2 Relationship between KRAS and BRAF mutations and the clinicopathological features in ovarian serous tumors
2.5 ER、PR表达与肿瘤组织学类型的关系 64例标本中ER、PR的免疫组化平均得分分别为6.7分、7.2分,其中普通型SBT、微乳头型SBT、LGSC中ER平均得分分别为6.7分、8.6分、3.0分,PR平均得分分别为8.4分、8.8分、2.4分。ER和PR阳性表达率均为76.6%(49/64、49/64)。免疫组化检测结果显示,普通型SBT、微乳头型SBT中的ER、PR表达水平均明显高于LGSC(P<0.01或P<0.001),而普通型SBT与微乳头型SBT间差异无统计学意义(P>0.05)(图2)。
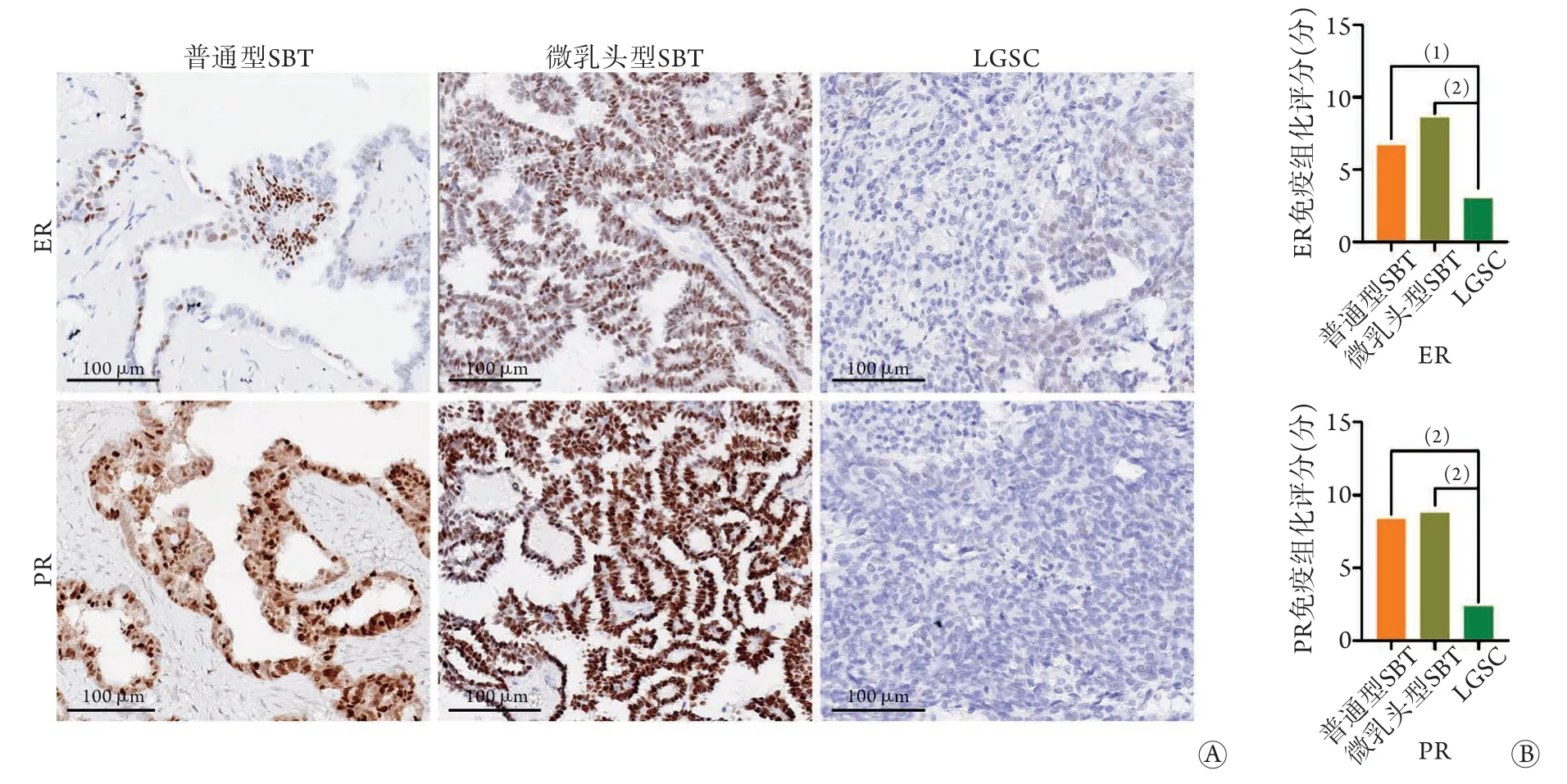
图2 卵巢浆液性肿瘤中ER、PR的表达情况Fig.2 Expression of ER and PR in ovarian serous tumors
2.6 各基因突变类型与ER、PR表达的关系 在36例基因突变组织中,ER、PR阳性表达率(均为86.1%)明显高于阴性表达率(分别为13.9%、13.9%)。21例KRAS突变组织中,ER、PR阳性表达率分别为90.5%、85.7%,其中G12S、G12D突变中ER、PR阳性表达率均为38.1%,G12C、G12R*、G12V、G12A、G13C*突变中ER、PR阳性表达率均为47.6%,G13D突变中ER、PR阳性表达率分别为4.7%、0.0%。KRASG13D突变组织中PR阴性表达率明显高于阳性表达率(P=0.014)(表3)。12例BRAF突变组织中,ER、PR阳性表达率分别为83.3%、91.7%;2例PIK3CA突变组织中,ER、PR阳性表达率均为50.0%;1例NRAS突变组织中,ER、PR阳性表达率均为100%。BRAF、NRAS、PIK3CA突变组织中的ER、PR阳性表达率差异均无统计学意义(P>0.05)。
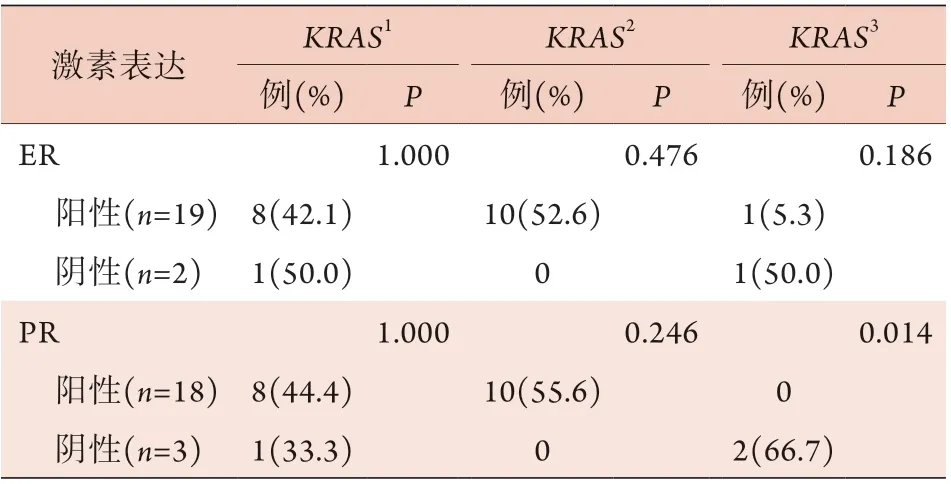
表3 卵巢浆液性肿瘤KRAS突变亚型与ER、PR表达率的关系Tab.3 Association between KRAS mutant subtypes and ER and PR expression in ovarian serous tumors
3 讨 论
EOC是一组异质性肿瘤,包括具有不同临床病理和分子特征的各种恶性肿瘤,而浆液性卵巢肿瘤是其最常见的组织类型,因而需要更好地了解其分子基础。影响细胞内信号转导通路的致癌突变与癌变直接相关。RAS/RAF/MAPK和PI3K/AKT/mTOR通路是细胞内信号转导中最重要的机制,因此,检测卵巢浆液性肿瘤中KRAS、NRAS、PIK3CA和BRAF的突变状况,有助于探索这些基因突变与癌变及临床病理特征之间的关系。
在不同类型的癌症中,KRAS、NRAS、PIK3CA和BRAF基因的突变频率不同[13-15]。本研究发现普通型SBT的基因突变检出率为73.9%(17/23),其中39.1%(9/23)为KRAS突变、34.8%(8/23)为BRAF突变;微乳头型SBT的基因突变检出率为51.9%(14/27),其中37.0%(10/27)为KRAS突变、3.7%(1/27)为PIK3CA突变、11.1%(3/27)为BRAF突变;LGSC的基因突变检出率为35.7%(5/14),其中14.3%(2/14)为KRAS突变、7.1%(1/14)为NRAS突变、7.1%(1/14)为PIK3CA突变、7.1%(1/14)为BRAF突变。由此可见,随着疾病的进展,卵巢低级别浆液性肿瘤组织中BRAF、KRAF基因突变率逐渐下降,其中BRAF突变最明显。BRAF、KRAS基因突变与卵巢浆液性肿瘤的组织学类型相关,SBT组织中基因突变率高于LGSC,且相对于BRAF基因突变,LGSC组织中KRAS基因突变更为常见。KRAS、NRAS和PIK3CA突变可能是LGSC的致癌驱动因子。
KRAS突变与SBT的浸润性植入明显相关,是肿瘤复发风险增高和患者生存率降低的重要预后指标[16]。Tsang等[17]发现,在未复发的SBT中BRAFV600E突变常见,而在复发的LGSC中KRAS基因突变更常见(>70%),且带有KRASG12V突变的患者总生存期较无该突变者缩短,这与Renaud等[18]的研究结果相似,后者发现存在KRASG12V突变的非小细胞肺癌患者表现出较差的总生存期和较高的复发率。Ohnishi等[19]基于Sanger测序发现,携带KRASG12D或G13D突变的黏液性交界性卵巢肿瘤可能更易进展为黏液性卵巢癌。另一项研究发现,与KRASG12V突变相比,具有KRASG12D突变的LGSC患者预后相对良好,但差异无统计学意义[20]。本研究发现,在普通型SBT和微乳头型SBT组织中,KRAS基因总突变率相似(39.1%vs. 37.0%),但突变亚型存在明显差异:G12C、G12R*、G12V、G12A、G13C*突变更常见于普通型SBT(P<0.05),在LGSC中未被检出;G12S、G12D突变多见于微乳头型SBT(P<0.05),在LGSC中未被检出;KRASG13D突变仅在2例LGSC中被检出。KRAS突变亚型可能与患者的预后有关,但由于本研究纳入病例不多,且缺乏跟踪随访记录,未能明确各突变亚型与患者预后的联系,有待后续扩大样本量进一步研究。
Malpica等[21]发现,含有SBT成分的卵巢浆液性囊腺瘤中可检测到BRAF或KRAS突变,而在单纯的浆液性囊腺瘤中未检测出该突变。具有BRAFV600E突变的SBT进一步发展为浆液性癌的风险相对较低,且发生该突变的LGSC患者多处于疾病早期阶段,晚期罕见[22-24]。Zeppernick等[25]发现,携带BRAF突变的SBT与细胞衰老相关的标志物p16和肿瘤抑制基因上调有关,患者预后较好。本研究结果显示,BRAF基因突变仅见于疾病早期阶段,12例SBT患者均为Ⅰ期,1例LGSC患者为Ⅱ期。此外,与微乳头型SBT比较,普通型SBT组织中BRAF基因突变率明显增高,而LGSC中则少见BRAF基因突变,这与Turashvili等[26]和Chui等[27]的报道一致,提示BRAF突变可能抑制了SBT向LGSC的进展。
本研究仅在1例Ⅲ期LGSC组织中检测出NRAS外显子2突变(7.1%),提示NRAS突变率较低,且可能与疾病进展和患者不良预后有关。这与Xing等[28]的发现一致,后者在SBT中均未检测出该突变(0/42),仅在3.6%的LGSC中检测出NRASQ61R突变(2/56)。Al-Qahtani等[29]发现,PIK3CA基因突变在EOC中的发生率较低(3.0%~12.8%),可通过介导PI3K/AKT信号通路改变而引起恶变。此外,Al-Qahtani等[29]还发现,PIK3CA突变与患者年龄及不良预后呈正相关,且多见于SOC和子宫内膜癌。本研究在Ⅱ期LGSC和Ⅱc期微乳头型SBT中各检测出1例PIK3CA基因突变(7.1%、3.7%),提示PIK3CA突变在浆液性卵巢癌的发生发展中可能起到一定作用,但仍有待后续扩大样本量进一步明确。
据报道,LGSC的发病机制可能与女性激素有关[7],与ER或PR阴性表达者相比,ER或PR阳性的SOC患者预后相对较好[30-31]。Ring等[32]通过查询癌症基因组图谱和体外实验发现,携带KRAS突变的肿瘤PR表达明显降低(P=0.047),携带KRAS突变的子宫内膜癌细胞中ERα和PR的表达明显降低(P≤0.001)。结合本研究KRAS突变类型与肿瘤组织学类型和激素表达状态之间的关系,提示随着疾病的发展,KRAS突变类型可能发生改变,且携带G13D突变亚型的肿瘤中ER或PR阳性表达率明显低于其他突变亚型,推测G13D突变可能通过某一途径介导ER或PR低表达,但不排除受肿瘤组织学类型的影响所致。Vannucchi等[33]发现,在ERα或PR高表达的甲状腺乳头状癌中,BRAFV600E突变的发生率较高。Liu等[34]发现,在ER或PR阳性表达的乳腺癌患者中,较高的BRAF/MEK通路活性与生存率更高有关。本研究结果显示,BRAF突变组织中ER和PR阳性表达率分别为83.3%、91.7%,结合临床病理资料,提示BRAF突变与ER、PR表达有关,携带该突变的患者预后较好。尽管在黑色素瘤中ERβ激动剂可抑制携带NRAS突变的癌细胞的增殖[35],在不同ERα和PR表达状态的乳腺癌中PIK3CA突变频率存在明显差异[36-37],但本研究未发现NRAS或PIK3CA突变与ER或PR的表达状态有关,这可能与样本量不足有关。
本研究在KRAS、NRAS、PIK3CA和BRAF突变检测中未发现交叉突变。KRAS、BRAF突变与患者的年龄、组织学类型有关。ER、PR高表达在SBT向LGSC发展过程中起抑制作用。KRAS突变可能是浆液性肿瘤的致癌驱动因子,在不同组织学类型中突变亚型存在明显差异。KRASG13D突变与LGSC的关系较为突出,与PR阴性表达也明显相关,是LGSC的重要致癌基因,可能成为预测患者预后的重要指标,但仍有待进一步研究。BRAF突变具有两面性,一方面在疾病早期阶段促进肿瘤的发生,另一方面又可阻碍SBT向LGSC的进一步发展。NRAS突变仅发生于少数的LGSC。NRAS、PIK3CA突变在浆液性卵巢癌的发生发展中起重要作用,但由于样本量有限,未发现有统计学意义的结果,有待扩大样本量进一步明确。卵巢浆液性肿瘤患者进行KRAS、NRAS、PIK3CA、BRAF突变检测可以为临床诊治、预后评估提供指导。

