细胞色素P450 2C19快代谢基因型缺血性卒中患者氯吡格雷抵抗的影响因素分析
尹书会 曹清禹 张倩 王默力
抗血小板聚集治疗能降低缺血性卒中的复发率,其作为二级预防的策略已被指南明确推荐[1]。临床中,有部分患者经正规抗血小板聚集药物治疗后仍发生了复发缺血性脑血管事件。氯吡格雷是临床常用的抗血小板聚集药物,可有选择、不可逆地阻断腺苷二磷酸(adenosine diphosphate,ADP)与血小板上的受体结合,从而抑制血小板聚集。该药需经肝脏细胞色素P450 2C19(cytochrome P450 2C19,CYP2C19)氧化后成为有活性的代谢产物,因此,CYP2C19的遗传变异可能降低氯吡格雷的转化效率。既往研究表明,CYP2C19的遗传变异与氯吡格雷抵抗有关[2-4],但也有研究认为二者的关系不肯定[5-7]。本研究团队前期对251例缺血性卒中患者CYP2C19不同代谢型基因的血小板抑制水平进行比较,结果显示其差异无统计学意义(P>0.05)[8],故本研究对CYP2C19快代谢基因型缺血性卒中患者的临床资料进行分析,拟探讨其与氯吡格雷抵抗的相关临床因素。
1 对象与方法
1.1 对象
连续纳入2014年5月至2019年2月首都医科大学宣武医院神经内科住院的204例缺血性卒中患者进行回顾性分析,缺血性卒中的诊断符合《中国急性缺血性脑卒中诊治指南2018》标准[9],且均为需要服用氯吡格雷的CYP2C19快代谢型基因(CYP2C19*1/*1)。204 例患者中,男153 例,女51 例;年龄31~86 岁,平均(62±11)岁。本研究方案已获得首都医科大学宣武医院伦理委员会批准[伦理号:临研审(2017)011号],患者或其家属签署了诊疗知情同意书。
1.2 纳入与排除标准
纳入标准:(1)汉族;(2)年龄≥18 岁;(3)距最近一次非心源性脑梗死≤1 个月;(4)卒中风险评估量表(essen stroke risk score,ESRS)评分≥3分[10];(5)CYP2C19基因分型为快代谢型(CYP2C19*1/*1)[11];(6)影像学及基线资料完整;(7)生命体征平稳,依从性好。
排除标准:(1)对氯吡格雷过敏;(2)丙氨酸转氨酶和(或)天冬氨酸转氨酶大于正常值上限的2倍;(3)重度肾功能不全(内生肌酐清除率<30 ml/min);(4)血小板计数<100×109/L、白细胞计数<4.0×109/L;(5)入院前1个月内活动性出血(颅内出血、消化性溃疡等);(6)存在可能造成心源性栓塞的疾病(心房颤动、心脏瓣膜病、入院前4周内心肌梗死、心室壁瘤形成等);(7)患有其他系统疾病不能配合治疗。
1.3 资料收集及药物治疗策略
收集并记录入组患者的基线资料和实验室检测指标,基线资料包括年龄、性别、既往史(高血压病、高脂血症、糖尿病、冠心病),实验室检测指标包括血常规、空腹血糖、糖化血红蛋白、肝肾功能、血脂、尿酸、同型半胱氨酸等。
既往史的诊断依据为入院前已诊断或正在使用相关药物,或入院时符合相应的诊断标准,分别为《中国高血压防治指南(2018 年修订版)》[12]、《中国成人血脂异常防治指南(2016 年修订版)》[13]、《中国2型糖尿病防治指南(2020年版)》[14]、《稳定性冠心病诊断与治疗指南》[15]。
根据《中国急性缺血性脑卒中诊治指南2018》[9],于确认后给予患者口服氯吡格雷(杭州赛诺菲公司,批号:5A797)75 mg/d,除阿司匹林肠溶片外,禁止使用其他抗血小板聚集药物,并进行调脂、降压、降糖等治疗。连续服用氯吡格雷7 d,第8天晨起空腹抽取静脉血,2 h内完成血栓弹力图血小板图的检测。实验室指标均为入院次日晨起空腹静脉血检测所得。
1.4 基因测序方法
入院次日晨起抽取空腹静脉血,使用CYP2C19基因检测试剂盒(上海百傲科技有限公司生产),从外周血中提取基因组DNA。用CYP2C19基因特异引物,经聚合酶链反应扩增后,将扩增产物与试剂盒(DNA微阵列芯片)杂交。使用BE-2.0生物芯片识读仪分析图像并判断基因型。检测的CYP2C19基因位点有*1/*1、*1/*2、*1/*3、*2/*2、*2/*3、*3/*3,利用CYP2C19基因检测试剂,经基因测序筛选出CYP2C19基因快代谢型(野生纯合子CYP2C19 *1/*1)。
1.5 血小板抑制率检测及分组标准
使用血栓弹力图分析仪(型号:TEG5000,Haemoscope公司,美国)测定的数据计算血小板抑制率。由2 μmol/L ADP诱导的血小板抑制率<30%为氯吡格雷抵抗,血小板抑制率≥30%为氯吡格雷非抵抗[16],分别分为氯吡格雷抵抗组和氯吡格雷非抵抗组。
由计算机软件计算血小板抑制率,其计算方法[17]:血小板抑制率(%)=[1-(MAADP-MAfibrin)/(MAthrombin-MAfibrin)]×100%,其中MA为最大幅度,表示形成血凝块的最大强度;MAADP为ADP诱导的血凝块强度,包括纤维蛋白和服用氯吡格雷未被抑制的血小板;MAfibrin为纤维蛋白的血凝块强度;MAthrombin为凝血酶诱导的血凝块强度。
1.6 统计学分析

2 结果
2.1 基线资料和实验室检测指标比较
204 例CYP2C19快代谢型(CYP2C19*1*1)缺血性卒中患者中,氯吡格雷抵抗组65 例(31.9%),氯吡格雷非抵抗组139例(68.1%)。氯吡格雷抵抗组女性、高血压病史比例及白细胞计数均高于氯吡格雷非抵抗组,组间差异均有统计学意义(均P<0.05)。两组患者年龄、高脂血症、糖尿病、冠心病、血小板计数、糖化血红蛋白、丙氨酸转氨酶、空腹血糖、三酰甘油、总胆固醇、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇、尿酸、同型半胱氨酸的组间差异均无统计学意义(均P>0.05)。见表1。
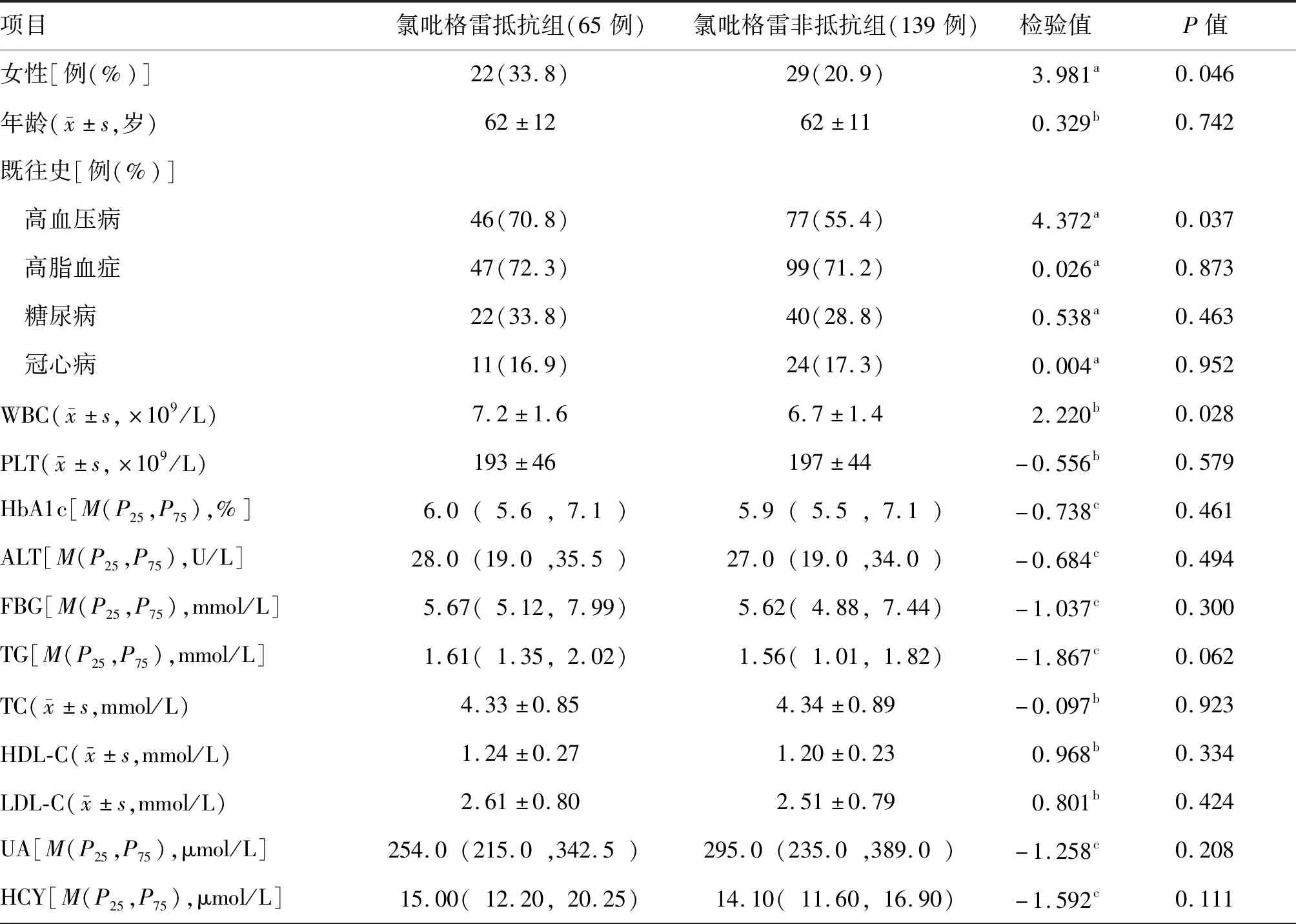
表1 两组CYP2C19快代谢型缺血性卒中患者基线资料和实验室检测指标比较
2.2 氯吡格雷抵抗的影响因素分析
以氯吡格雷抵抗为因变量,将单因素分析中P<0.05的项目作为自变量纳入二元Logistic回归分析,结果显示,女性、既往高血压病史、高白细胞计数均为发生氯吡格雷抵抗的独立危险因素(均P<0.05)。见表2。

表2 CYP2C19快代谢型缺血性卒中患者氯吡格雷抵抗的多因素Logistic回归分析
3 讨论
氯吡格雷是临床常用的一种抗血小板聚集药物,其抗血小板聚集效果存在差异。经标准剂量氯吡格雷治疗后,ADP诱导的血小板功能未达到有效抑制,称为氯吡格雷抵抗[18],也有研究将其称为血小板高反应性,其发生率报道不一[19-20]。Jover等[19]对缺血性脑血管病患者服用氯吡格雷7 d后分别使用血小板功能分析仪、血管扩张刺激磷蛋白磷酸化法、光学比浊法、VerifyNow P2Y12测定法检测血小板功能,结果显示,治疗后血小板高反应性占比分别为7/18、8/18、9/18、10/18,且治疗后90 d与7 d的血小板高反应性占比差异无统计学意义(P>0.05)。Fu等[20]对急性缺血性卒中患者服用氯吡格雷7 d后的血小板功能应用光学比浊法进行检测,显示仍有48.1%(63/131)的患者呈现血小板高反应性。Kinsella等[21]对服用氯吡格雷的短暂性脑缺血发作或缺血性卒中患者应用血小板功能分析仪检测血小板功能,研究发现治疗后血小板高反应性患者占比达92.0%(23/25)。上述研究对治疗后血小板高反应性占比存在差异的原因可能与检验方法和评定标准不同有关,光学比浊法是检验血小板功能的“金标准”,但该方法的影响因素较多,稳定性欠佳,可重复性差[22]。血栓弹力图检测血小板功能是近几年常用的一种快速、可靠的检测方法[23-25]。本研究利用血栓弹力图检测CYP2C19快代谢型(CYP2C19*1*1)缺血性卒中患者连续服用氯吡格雷7 d后的血小板功能,显示氯吡格雷抵抗发生率为31.9%(65/204)。
除了药物代谢酶的基因多态性对氯吡格雷疗效的影响,氯吡格雷抑制血小板聚集的作用还可能受很多因素的影响,包括年龄[26-28]、性别[26-27,29]、吸烟[26]、体质量指数[28,30]、高脂血症[26,31]、高血压病[32]、糖尿病[28,33-35]、糖耐量减低[36]、炎症因子[27,34]、白细胞计数[27,31]、平均血小板体积[37]、糖化血红蛋白[26]、同型半胱氨酸[31]、钙通道阻滞剂[38-39]、质子泵抑制剂[40]、苯二氮类药物[30]等。既往研究多针对临床因素及药物代谢酶CYP2C19基因多态性对氯吡格雷抗血小板聚集药物疗效的影响,而本研究未对主要药物代谢酶CYP2C19基因多态性的影响,仅纳入了CYP2C19快代谢基因型(CYP2C19*1*1)的缺血性卒中患者,结果显示,氯吡格雷抵抗组女性、高血压病史比例及白细胞计数均高于氯吡格雷非抵抗组,组间差异均有统计学意义(均P<0.05),且进一步行多因素Logistic回归分析发现,女性、高血压病、高白细胞计数水平均是发生氯吡格雷抵抗的独立危险因素(均P<0.05)。
有研究表明,女性可能无法从抗血栓治疗中获得与男性相同的益处[41]。性别不同导致抗血小板聚集药物效果不同的机制尚未完全清楚,Patti 等[42]研究表明,抗血小板聚集药物效果不同的可能机制:血小板功能存在性别差异,包括血小板黏附或聚集分子机制的位点、血小板计数、血小板表面受体及结合的纤维蛋白原数量等均有差异,并且血管因素、凝血机制,甚至雌激素水平、体型等因素均可能参与其中。因此,女性缺血性卒中患者需要服用氯吡格雷时要考虑到可能出现的氯吡格雷抵抗风险,必要时监测血小板抑制率。
目前,高血压病史影响氯吡格雷抗血小板聚集药物疗效的机制尚未清楚。Nadar和Lip[43]认为,高血压病患者血小板功能可因多种原因处于活化状态,且可有更强的聚集性和黏附性。既往研究发现,钙通道阻滞剂的使用可能与氯吡格雷抵抗有关,并且钙通道阻滞剂在伴高血压病的缺血性卒中患者中使用率较高,其与氯吡格雷的代谢均需经肝脏药物代谢酶CYP3A4的作用,后者为氯吡格雷代谢过程中比较重要的酶,因此,钙通道阻滞剂可能影响氯吡格雷的转化而使血小板抑制率降低[38-39]。Lee等[44]在氯吡格雷与其他药物相互作用的研究中进一步肯定了氯吡格雷抵抗与钙通道阻滞剂的使用有关。因此,伴高血压病的缺血性卒中患者使用氯吡格雷时最好监测血小板抑制率,尤其同时使用钙通道阻滞剂时,更需要考虑可能出现的氯吡格雷抵抗。本研究不足之处在于未统计高血压病患者降压药的使用情况,因此,服用氯吡格雷的缺血性卒中患者选用钙通道阻滞剂降压是否合适,尚需今后的研究进一步探讨。
目前,白细胞计数水平参与氯吡格雷抵抗的机制尚未明确。谢文剑等[45]在冠心病存在氯吡格雷抵抗患者的外周血白细胞中发现3个长链非编码RNA的表达,与氯吡格雷非抵抗组的差异有统计学意义,研究提示3个长链非编码RNA可作为潜在生物标志物以评估氯吡格雷反应性。动脉粥样硬化与血管内皮的非特异性炎性反应有关,而白细胞尤其是中性粒细胞在这种非特异性炎性反应中发挥了重要作用[46]。在动脉粥样硬化过程中,中性粒细胞不仅数量增多,功能增强,并且中性粒细胞可促进动脉粥样硬化局部炎性反应,促进组织因子表达,并释放中性粒细胞外诱捕陷阱,中性粒细胞外诱捕陷阱内的组织因子诱导凝血酶生成和血小板活化、黏附和聚集,从而促进血栓形成[47]。因此,对于需要服用氯吡格雷的缺血性卒中患者,若其白细胞处于正常偏高水平,应警惕氯吡格雷抵抗。
本研究仍有很多不足之处:本研究为单中心回顾性研究,样本的选择上可能存在偏倚;未对CYP2C19基因多态性对氯吡格雷代谢的影响进行研究,故未能全面考虑氯吡格雷从肠道吸收、代谢及作用于血小板受体等过程中基因多态性及合并用药的影响;样本量较少,尤其是女性比例较低,可能使结果产生偏倚。另外,本研究仅在服用氯吡格雷7 d后检测1次血小板抑制率,尚不能反映服用氯吡格雷过程中血小板抑制率的总体水平。尽管血小板抑制率与实际临床事件之间的关系、导致氯吡格雷抵抗的因素均未明确,基于精准治疗的目的,根据实验室检测指标调整治疗有一定的临床指导意义。

