瑞马唑仑联合舒芬太尼抑制无痛人工流产术扩张宫颈体动研究
陈秋红,刘博文,杨文明,胥露露
南昌大学第一附属医院,江西 南昌 330006
人工流产术是妇科常见的终止早期妊娠的方法,术中需置入窥阴器、扩张宫颈、刮吸子宫内膜等操作,对患者身心均可造成严重的创伤。随着舒适化医疗理念不断深入,无痛诊疗技术的日渐成熟,越来越多的患者更倾向于在无痛状态下完成人工流产术。目前,丙泊酚广泛运用于无痛人工流产术麻醉,但其注射痛明显,呼吸、循环抑制作用较强[1]。瑞马唑仑(CNS7056)是一种超短效新型镇静药物,具有安全、高效的镇静效果,且对呼吸循环影响轻微,几乎没有注射痛等特点[2]。因此,本研究采用瑞马唑仑联合舒芬太尼麻醉方案用于无痛人工流产术,测定抑制扩张宫颈体动反应瑞马唑仑的ED50及95%CI,为临床用药提供参考。
1 资料与方法
1.1 一般资料
本研究选取2021 年11 月至2022 年2 月南昌大学第一附属医院自愿要求行无痛人工流产术患者53 例,分为无分娩史患者组(N1 组,n=29)和有自然分娩史患者组(N2 组,n=24)。两组患者组内有体动反应和无体动反应、患者年龄、体质量指数(BMI)、妊娠天数和手术时间均差异无统计学意义,见表1。
表1 两组患者一般情况比较()

表1 两组患者一般情况比较()
注:与同组内有体动反应比较,aP>0.05。
1.2 选取标准
(1)纳入标准:①美国麻醉医师协会(ASA)分级为I~Ⅱ级;②符合《妇产科疾病诊断标准》[4]中妊娠的相关诊断标准;③辅助检查提示宫内早孕,符合人工流产手术适应证;④不存在麻醉相关禁忌证;⑤患者及家属均知情研究目的并签署麻醉知情同意书。(2)排除标准:①对苯二氮类药物及相关成分过敏者;②精神分裂症或严重抑郁状态患者;③BMI>30 kg/m2、阻塞性睡眠呼吸暂停低通气综合征(OSAHS)患者;④近2 周有急性上呼吸道感染,哮喘急性发作期;⑤存在严重妇科疾病或异位妊娠患者;⑥合并重要脏器严重功能障碍者。
1.3 研究方法
所有患者术前常规禁食8 h、禁饮2 h,均不予术前用药。入室后取膀胱截石位,开放外周静脉通道,鼻导管吸氧3 L/min,连接心电监护监测心电图(ECG)、无创血压(NBP)、血氧饱和度(SpO2)等生命体征。缓慢推注枸橼酸舒芬太尼注射液(江苏恩华药业股份有限公司,国药准字H20203650,规格:1 mL∶50 μg)0.1 μg/kg,随后静脉注射序贯法对应剂量的注射用甲苯磺酸瑞马唑仑(江苏恒瑞医药股份有限公司生产,国药准字H20190034,规格:36 mg/支),60 s 内推注完毕,2 min 后开始手术。若麻醉期间收缩压(SBP)≤80 mm Hg 或低于基础值20%,静脉注射麻黄碱6 mg;若心率(HR)≤50 次/min,静脉注射阿托品0.5 mg;当SpO2≤90%或呼吸频率(RR)≤10 次/min,则予辅助通气。
1.4 观察指标
观察和记录所有患者入室时(T0)、麻醉诱导后2 min(T1)、扩张宫颈结束时(T2)及手术结束时(T3)各时间点的平均血压(MAP)、HR、SpO2等血流动力学指标及Ramsay 镇静评分。记录所有患者静脉注射痛、术中知晓、恶心呕吐等不良反应发生情况。
1.5 序贯方法
采用改良Dixon 序贯法,根据预实验及一系列研究结果[5-7]选择瑞马唑仑的起始剂量为0.2 mg/kg,按0.05 mg/kg 梯度等差值增减,扩张宫颈时出现体动反应则为阳性反应则下一例患者的瑞马唑仑剂量增加1 个梯度,若出现阴性反应则下一例减少1 个梯度。阳性反应标准:患者有任意肢体运动,皱眉或Ramsay 评分<5 级。Ramsay 镇静评分标准。1 级:清醒,焦虑、不安或烦躁;2 级:清醒,患者合作、定向力良好或安静;3 级:清醒,患者仅对命令有反应;4 级:睡眠,患者对叩眉或强烈刺激快速反应;5 级:睡眠,患者对叩眉或者强烈刺激反应迟钝;6 级:睡眠,患者对叩眉或者强烈刺激无反应[8]。若手术过程中出现影响操作的体动反应,酌量给予丙泊酚乳状注射液(阿斯利康制药有限公司生产,批 号X20014A,规格:20 mL∶200 mg)25~50 mg镇静补救,直至满足手术需求,当出现8 个拐点时,研究终止。
1.6 统计学方法
采用SPSS 17.0 统计学软件进行数据分析。计量资料以表示。组间比较采用独立样本t检验,组内比较采用重复测量方差分析。采用概率单位Probit 回归分析法计算ED50及95%CI,用GraphPad Prism 5 软件制作序贯试验图。P<0.05 为差异有统计学意义。
2 研究结果
2.1 不同时间点患者血流动力学变化及镇静评分的比较
同一组内有体动反应患者与无体动反应患者相比较,T1 时刻Ramsay 镇静评分均明显要低,差异有统计学意义(P<0.01);与T0 比较:N2 组中有体动反应患者T1、T2 时刻MAP 均明显降低(P<0.05),T3 时HR 明显下降(P<0.05),但下降幅度均在安全范围内;N1 组中有体动反应患者T2 时SpO2明显降低(P<0.05),但无需干预;所有患者T1、T2、T3 时刻Ramsay 镇静评分明显升高(P<0.01),差异有统计学意义。见表2。
表2 血流动力学及镇静评分在不同时间点的变化情况()
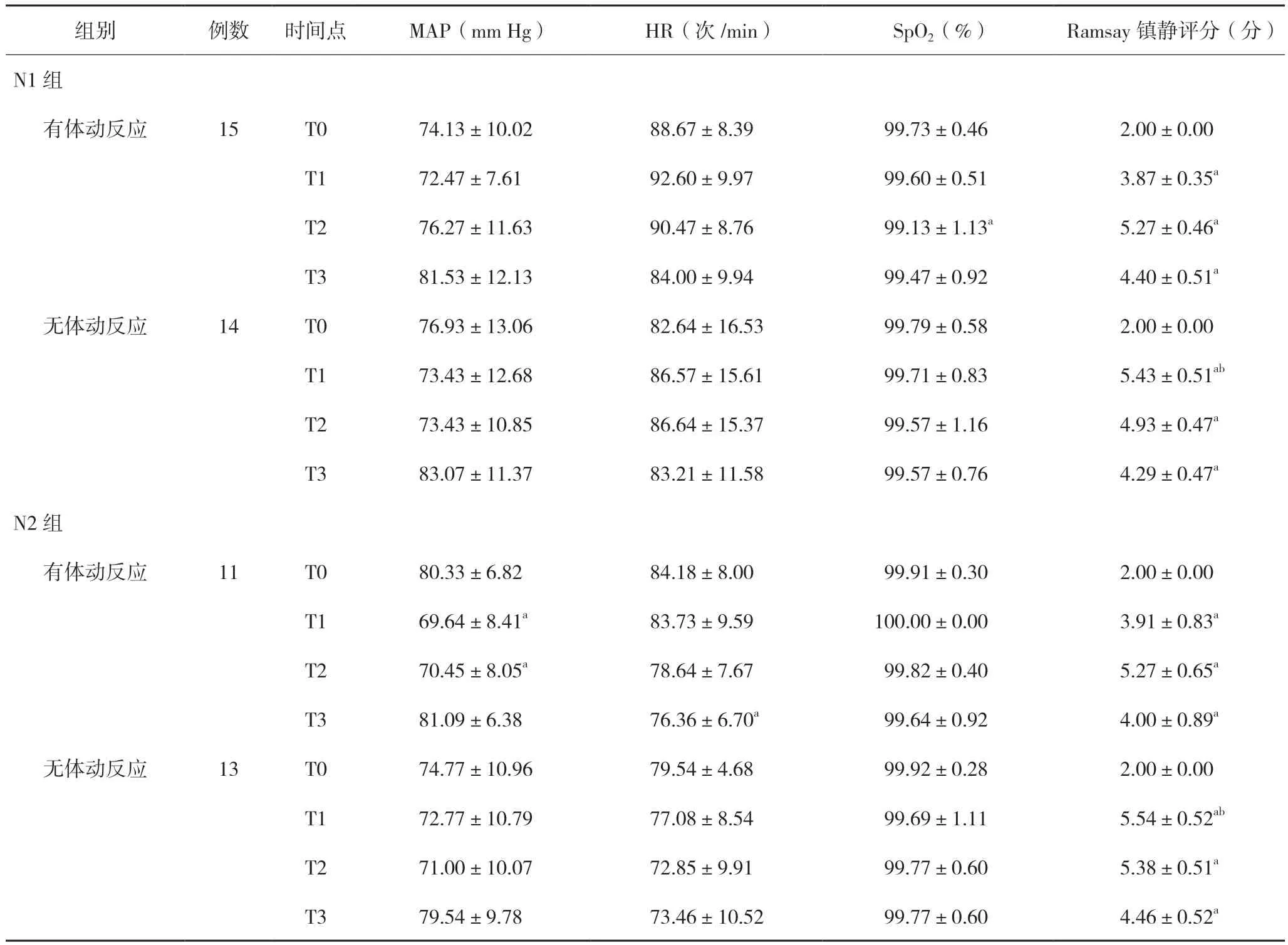
表2 血流动力学及镇静评分在不同时间点的变化情况()
注:组内各时间点与T0比较,aP<0.05;同组有体动反应患者与无体动反应患者比较,bP<0.05。
2.2 不良反应记录
所有患者未见明显注射痛、胸壁强直、术中知晓、头晕头痛等不良反应;与术前基础值T0 比较,N1 组给药后有1 例血压下降超过基础值20%;1例有呃逆;1 例有呕吐反应。N2 组有1 例患者术中SpO2降至93%,自行恢复至正常水平;2 例出现呃逆;1 例出现呕吐反应。
2.3 瑞马唑仑联合舒芬太尼抑制无痛人工流产术扩张宫颈体动反应的ED50、95% CI
本研究N1 组完成8 个折返时,阳性反应患者15 例,阴性反应患者14 例。瑞马唑仑抑制无分娩史患者行无痛人工流产术扩张宫颈体动的ED50为0.21 mg/kg,95%CI0.17~0.25 mg/kg(见图1)。
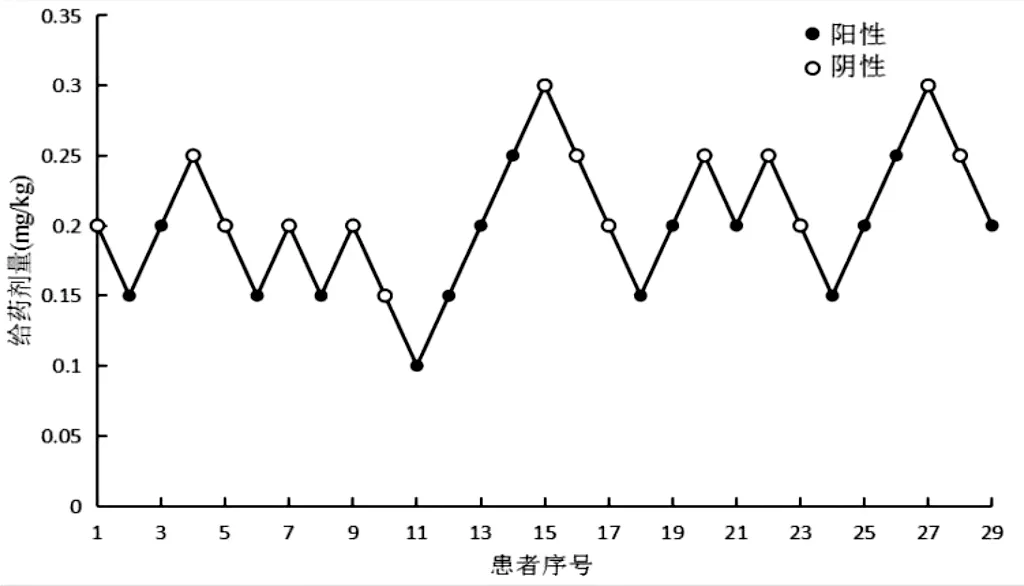
图1 无分娩史29例改良序贯试验图
N2 组完成8 个折返时,阳性反应患者11 例,阴性反应患者13 例。瑞马唑仑抑制有分娩史患者行无痛人工流产术扩张宫颈体动的ED50为0.14 mg/kg(95%CI0.11~0.17 mg/kg)(见图2)。

图2 有分娩史24例改良序贯试验图
3 讨论
无痛人工流产术常用于意外妊娠的补救,也用于因疾病不宜继续妊娠、预防先天性畸形或遗传性疾病而需终止妊娠者。手术时间较短,但术中部分手术操作可引起机体强烈不适感,甚至导致严重并发症[9]。其中,扩张宫颈通过刺激宫颈体旁神经丛而引起患者剧烈疼痛和不适,患者疼痛敏感性和患者宫颈松弛度密切相关,而宫颈的松弛程度又和患者既往是否有自然分娩史紧密相连。所以,本研究将患者分为无分娩史组和有自然分娩史组进行研究,以提高研究结果的精确度。从手术开始至进行扩张宫颈操作的时间间隔约为60 s,该过程中往往不需额外追加药物。因此,可以根据扩张宫颈时患者是否有体动来反映麻醉药物用量是否足够[10]。
瑞马唑仑是一种新型超短效苯二氮类药物,它作用于中枢γ-氨基丁酸(GABAa)受体的GABA位点,使氯离子通道开放,氯离子通透性和内流增加,引起神经细胞膜超极化从而产生镇静催眠作用[11]。瑞马唑仑可通过体内的非特异性血浆酯酶迅速水解为唑仑丙酸(CNS7054),而瑞马唑仑对GABAa 受体的亲和力是唑仑丙酸的320~410 倍,所以瑞马唑仑的代谢产物几乎不具有药理活性[12-14],因此,瑞马唑仑具有起效快,代谢迅速,长时间输注无蓄积作用,不依赖肝肾代谢,能被氟马西尼特异性拮抗等药理特性,尤其适用于快节奏的手术室外无痛诊疗麻醉[15]。目前已有研究证实,瑞马唑仑用于无痛人工流产术麻醉安全性较高,相较于丙泊酚具有无注射痛、血流动力学稳定、苏醒质量佳、不良反应发生率低等优势[5-6]。因此,本研究拟探讨瑞马唑仑联合舒芬太尼应用于无痛人工流产术麻醉,并测定抑制扩张宫颈时体动的瑞马唑仑的ED50。
改良序贯法是临床研究药物ED50最常用的经典方法之一[16-17]。本研究结合预试验研究结果和相关研究报道[5-7],选定瑞马唑仑起始剂量为0.2 mg/kg,相邻患者按剂量梯度为0.05 mg/kg 等差值增减,两组均直至出现8 个折返则终止研究。
预实验研究发现,单纯使用瑞马唑仑虽镇静良好,但术中体动明显,麻醉深度不能满足手术需求,考虑原因在于瑞马唑仑具有镇静而无镇痛作用,尚不能抑制扩张宫颈、宫内操作等刺激引起的疼痛不适,所以临床上常复合镇痛药应用于无痛人工流产术,因此,本研究采用瑞马唑仑联合舒芬太尼麻醉方案,根据两者协同作用,可减弱手术应激反应,提高患者的耐受性。研究结果发现,既往有分娩史患者瑞马唑仑的ED50明显小于无分娩史患者,原因在于有分娩史患者宫颈口和宫颈管直径相比于无分娩史患者均较宽,吸具可顺利通过宫颈管,减少扩张宫颈的需要,故有分娩史患者使用药物剂量低于未生育患者。另一原因也在于无分娩史患者对疼痛较敏感,术中出现疼痛视觉模拟评分(VAS)>5 分的风险较有分娩史患者高出25%,所以无分娩史患者需较深的麻醉深度以抑制疼痛应激反应,所需的瑞马唑仑剂量相应增大,这与本研究结果也相一致。研究还发现瑞马唑仑联合舒芬太尼麻醉方案镇静效果良好,患者血流动力学稳定,53 例患者中仅1 例患者血压下降幅度超过20%,1 例患者SpO2下降到93%,自行恢复到正常水平,临床安全性较高,这与临床前期研究结果相一致。
综上所述,瑞马唑仑联合0.1 μg/kg 舒芬太尼用于无痛人工流产术麻醉时安全有效,无分娩史患者和有分娩史患者抑制扩张宫颈体动的瑞马唑仑ED50分别为0.21 mg/kg(95%CI0.17~0.25 mg/kg)和0.14 mg/kg(95%CI0.11~0.17 mg/kg),且有分娩史患者ED50 明显小于无分娩史患者,所以无痛人工流产术麻醉诱导时应根据患者既往生育史酌情用药,为临床合理用药提供参考。

