番茄SlSL1重组蛋白的表达、纯化及体外泛素化活性检测
徐焕焕, 张芳毓, 刘 茜, 栾能能, 王颖格, 牛向丽
(合肥工业大学 食品与生物工程学院,安徽 合肥 230601)
泛素(Ubiqutin,Ub)是一种广泛存在于真核细胞中、包含有76个氨基酸的高度保守的小分子蛋白[1-2]。泛素化修饰是泛素分子在一系列酶的作用下与靶标蛋白上的一个或多个赖氨酸残基共价结合,形成的蛋白质翻译后修饰。由于泛素蛋白自身也具有赖氨酸残基,它们之间可以通过这些位点互相连接,形成多泛素链修饰的蛋白质。多泛素化修饰介导蛋白质的26S蛋白酶体降解,在基因转录[3]、激素信号传导[4-5]、细胞周期[6-7]、植物抗病抗逆[8-9]以及生长发育[10]等所有生命活动过程中均发挥着重要作用。
蛋白质的泛素化由E1泛素激活酶、E2泛素结合酶和E3泛素连接酶通过级联反应共同完成[11-12]。E1利用ATP与泛素分子形成高能硫酯键,并将活化后的泛素转移到E2,然后结合有E2的泛素分子被E3转移到靶蛋白上进行标记[13-14]。其中,E3泛素连接酶是一个种类繁多的大家族,主要功能是对靶标蛋白进行特异性识别,并对其进行泛素化修饰,然后在26S蛋白酶体催化下使泛素化的靶蛋白发生降解。目前在拟南芥中已鉴定超过1 400个E3泛素连接酶[15-16],水稻中E3泛素连接酶基因也有1 300多个[17-18]。由于E3泛素连接酶被认为是泛素化途径中最重要的组成部分[19-20],也是目前泛素化研究中的热点,因此对E3泛素连接酶展开深入研究具有重要意义。
多数E3泛素连接酶具有的典型反应特征就是能够与E2泛素结合酶协作,催化自身的泛素化。体外泛素化实验,即通过体外添加泛素化反应中的必需成分(E1、E2、E3、Ub等),利用实验体系模拟生物体内的泛素化反应过程,可以通过该实验方法发现可能的E3连接酶、验证靶蛋白的泛素化。本研究通过克隆推测具有E3泛素连接酶功能的番茄SlSL1基因编码序列、构建原核表达载体、体外诱导标签重组蛋白表达、分离纯化,获得SlSL1重组蛋白,并利用体外泛素化实验体系,对SlSL1的泛素连接酶活性进行检测,为后续进一步探讨SlSL1利用泛素化途径在番茄中的调控作用提供依据。
1 材料与方法
1.1 实验材料
1.1.1 菌株与质粒
大肠杆菌(Escheriachiacoli)菌株Rosetta、原核表达载体pMAL-C2,均保存于本实验室。
1.1.2 主要试剂
DNA产物纯化试剂盒、琼脂糖凝胶DNA回收试剂盒、质粒提取试剂盒,均购于北京天根生化科技有限公司;高保真 DNA 聚合酶、Easy Taq酶、dNTP、DNA marker,均购于北京全式金生物技术有限公司;限制性内切酶(EcoRⅠ、SaIⅠ)、淀粉树脂购于NEB公司;maltose、异丙基硫代半乳糖苷(IPTG)、FLAG标签小鼠单克隆抗体,均购于Sigma公司;Flag-Ub、重组蛋白E1、E2,均购于Boston Biochem公司;Bacterial Protease inhibitor购于上海生工生物工程技术服务有限公司;ECL化学发光试剂购于Thermo Fisher Scientific公司;引物设计采用Primmer Premmier 5.0软件,由上海生工生物工程技术服务有限公司合成;其他试剂均为国外原装或国产分析纯。
1.2 实验方法
1.2.1SlSL1原核表达载体的构建
根据番茄SlSL1基因序列(Solyc03g042550)设计引物,引物序列为:
SL1F:5’-CCGGAATTCATGGCGAGATTTTCAGTTG-3’;
SL1R: 5’-GCGTCGACTCATTCCTTCTCTTCTATGAGAACATC-3’。
引入EcoRⅠ、SaIⅠ酶切位点,根据所设计引物对SlSL1基因全长编码序列进行聚合酶链式反应(polymerase chain reaction,PCR)高保真扩增。扩增程序为:98 ℃热启动2 min、98 ℃变性20 s、54 ℃退火20 s、72 ℃延伸30 s,共 30 个循环,最后一个循环后72 ℃延伸5 min。
扩增后的PCR产物经琼脂糖凝胶电泳检测、纯化后,以EcoRⅠ、SaIⅠ进行双酶切。酶切片段进行胶回收,然后与同样酶切回收的pMAL-C2载体片段进行连接、转化Rosetta菌株感受态细胞。挑选单克隆,对其进行菌落PCR鉴定、质粒抽提,并将经双酶切鉴定后质粒进行测序,完成重组蛋白表达质粒pMAL-SlSL1的构建。
1.2.2 SlSL1重组蛋白的诱导纯化
挑取阳性重组菌株单克隆于2 mL含有50 mg/mL氨苄青霉素的LB培养基中,37 ℃摇床中过夜培养。再将培养菌液以1∶100比例转接于50 mL 含有氨苄青霉素的LB液体培养基中,培养2~3 h 至OD600为0.5~0.6。吸取0.5 mL菌液,12 000 r/min离心2 min,弃上清,液氮速冻,保存于-80 ℃冰箱,用于制备诱导前的蛋白样品。剩余菌液加入20 μL 0.5 mol/L IPTG于28 ℃、200 r/min摇床中进行诱导培养6~8 h(IPTG诱导条件一般为28 ℃、6 h,促进重组蛋白在大肠杆菌中的高效可溶性表达),3 000 r/min离心6 min收集菌体。用5 mL蛋白提取缓冲液(20 mmol/L Tris-HCl、200 mmol/L NaCl、1 mmol/L EDTA、1×Bacterial protease inhibitor)重悬菌体,冰上放置,超声破碎10 s,间歇20 s,共重复10次。随后12 000 r/min、4 ℃离心10 min,保留上清液(粗提取液)。将5 mL粗提液与0.5 mL淀粉树脂于4 ℃缓慢旋转孵育4~6 h后,4 ℃离心机3 000 r/min 离心5 min,弃上清,加入提取缓冲液对树脂进行清洗,离心弃上清,重复洗涤3次。用含有10 mmol/L maltose的洗脱缓冲液洗脱带有MBP(maltose binding protein)标签的SlSL1蛋白2~4 h后,离心并收集上清,获得SlSL1纯化蛋白溶液。在IPTG诱导前、后菌液所制备的蛋白样品和纯化SlSL1蛋白样品中加入上样缓冲液,混匀后于95 ℃加热5 min,进行SDS-PAGE凝胶电泳。电泳结束后以考马斯亮蓝对蛋白凝胶染色3 h,然后进行脱色直至出现较为清晰干净的蛋白条带,拍照记录。
1.2.3 体外泛素化反应及蛋白免疫印迹分析
首先进行泛素化反应,总反应体系体积为30 μL,包括超纯水14.5 μL、20×buffer(1 mol/L Tris (pH值 7.5)、40 mmol/L ATP、100 mmol/L MgCl2、600 mmol/L creatine phosphate、1 mg/mL creatine phosphokinase)1.5 μL、E1 1 μL、E2 1 μL、SlSL1纯化蛋白10 μL、Flag-ub 2 μL,于28 ℃反应2 h,然后在样品中加入5×SDS-PAGE上样缓冲液,于95 ℃加热5 min,得到反应样品。
然后进行蛋白免疫印迹分析。将上述所得反应产物以7.5% SDS-PAGE进行电泳,电泳结束后转膜,将蛋白转移至硝酸纤维素膜上。转膜结束后在室温下用5% 脱脂牛奶封闭1 h,然后室温孵育anti-Flag 标签抗体1 h,以1×TBST缓冲液(20 mmol/L Tris(pH 值7.4)、150 mmol/L NaCl、20 % Tween-20)洗膜,每次10 min,重复3次。加入ECL化学发光试剂(V(A液)∶V(B液)=1∶1),将其置于化学发光仪(美国GE Healthcare凝胶成像系统ImageQuant LAS 4000mini)进行检测。
2 结果与分析
2.1 原核表达载体pMAL-SlSL1的构建分析
利用特异引物SL1F/R对SlSL1基因编码序列进行PCR全长扩增,琼脂糖凝胶电泳结果如图1所示,获得预期大小(1 083 bp)条带。图1中, M代表DNA Marker,下同。
将PCR扩增产物纯化后,以EcoRⅠ和SalⅠ限制性酶进行双酶切。将酶切片段进行胶回收后与同样酶切的原核表达载体pMAL-C2片段进行连接、转化大肠杆菌Rosetta,并进行菌落PCR鉴定,结果如图2所示。由图2可知,表明获得了连入SlSL1基因的阳性克隆。图2中,P为正对照,SlSL1基因PCR扩增产物;N为负对照,pMAL-C2空载体扩增产物;1~6为转化单克隆扩增产物。

图1 SlSL1基因PCR扩增产物
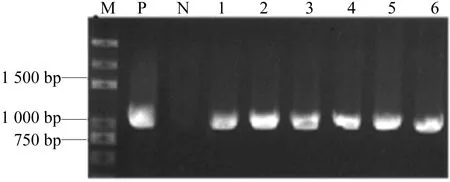
图2 pMAL-SlSL1大肠杆菌落PCR鉴定
选取2号克隆进行质粒抽提及酶切鉴定,结果如图3所示。酶切后获得预期大小的SlSL1片段,将酶切鉴定阳性重组质粒送测序。序列经GenBank比对一致,未出现突变和移位,表明pMAL-SlSL1重组蛋白表达质粒构建完成。图3中:1为以EcoRⅠ和SalⅠ酶切的重组质粒;2为未酶切pMAL-SlSL1质粒。

图3 pMAL-SlSL1阳性质粒酶切鉴定
2.2 SlSL1重组蛋白的纯化与检测分析
将上述含有pMAL-SlSL1重组蛋白表达质粒的Rosetta阳性克隆进行培养、IPTG诱导,然后利用重组蛋白所带有的MBP标签序列,通过淀粉树脂对SlSL1蛋白进行纯化。SDS-PAGE电泳和考马斯亮蓝染色结果如图4所示。图4中:1为诱导前菌体总蛋白;2为IPTG诱导6 h菌体总蛋白;3为纯化的SlSL1蛋白。
从图4可以看出,IPTG诱导后SlSL1蛋白的表达升高,经淀粉树脂特异亲和吸附后获得了条带较为单一的预期大小SlSL1蛋白。但仍有一些杂蛋白条带,可能是淀粉树脂的非特异吸附造成的。当加入maltose洗脱缓冲液再次洗脱可使SlSL1蛋白纯度进一步提高。

图4 SlSL1重组蛋白的诱导与纯化
2.3 体外泛素化反应及蛋白免疫印迹分析结果
按照上述体外泛素化反应体系加入各组分,以未连接目标基因的MBP标签蛋白设置对照样品,28 ℃反应2 h,然后进行蛋白免疫印迹分析,结果如图5所示,图5中:1为SlSL1纯化蛋白的体外泛素化反应;2为未连接目标基因的MBP标签蛋白对照反应体系。

图5 SlSL1蛋白的体外泛素化
从图5可以看出,当以anti-Flag抗体孵育结合时,SlSL1蛋白因连接上了带有Flag标签的多个泛素分子Flag-Ub,显示出分子量逐渐增加的弥散状的多泛素化条带;而加入MBP的对照样品反应体系则无相应泛素化条带。表明SlSL1蛋白可进行自身泛素化,具有E3连接酶活性,因此可能通过番茄泛素化修饰发挥调控功能。
3 讨 论
E3泛素连接酶能够特异识别底物蛋白,并促进泛素向底物蛋白转移,是泛素化反应过程的关键酶。根据其结构域的不同及与底物的结合方式可将E3泛素连接酶分为HECT型(homologous to e6-associated protein C-terminus)、U-box型、RING型(really interesting new gene)及CRLs型4大类。其中HECT、RING和U-box型E3泛素连接酶为单亚基E3连接酶,而CRLs型是由cullin、RING-box以及靶标蛋白识别蛋白共同组成的一个复合体。目前对植物泛素化系统的研究表明,这些不同类别的E3连接酶家族成员均可参与植物防御反应[21-24]、生殖发育、胞吞作用、DNA修复、细胞凋亡、亚细胞定位等生命活动过程[25-26]。
本研究通过原核表达载体构建和标签重组蛋白体外诱导及分离纯化,并利用体外泛素化实验体系初步验证了SlSL1的E3泛素连接酶活性。实验结果表明SlSL1不需形成E3复合体,即可发挥泛素化连接酶活性,但其作用靶蛋白、作用机制等尚未明确。因此,本实验为进一步探讨番茄SlSL1基因利用泛素化途径对生长发育、环境应答等方面的可能调控功能提供了研究基础和线索。

