副溶血弧菌耐热直接溶血素DAS-ELISA检测方法的建立
白雪欣,胡宸艺,金志颖,万 伟,李 月,王 菁,李岩伟,高 姗,王景林
副溶血弧菌(Vibrioparahaemolyticus,Vp)是一种革兰阴性嗜盐细菌,主要分布在河口沿岸和海水环境中[1]。1950年在日本大阪,Vp作为致病菌被首次分离,此后世界多地都有病例报道。我国第一次分离出该菌株略晚于日本,是于1958年在上海的一起因Vp感染而引发的食物中毒事件中分离得到的[2]。Vp是一种常见的人兽共患病致病菌,可导致贝类、鱼类、虾类等水生动物发病,多流行于夏季[3]。其中,Vp引起的红体病普遍流行于我国虾类养殖地区,如辽宁、海南等地[4]。该病致病性强,辽宁省盘锦市有报道水生动物死亡率高达80%以上,给当地渔民带来极大损失[5]。此外,也有报道Vp感染网箱养殖的大黄鱼以及养殖的蟹、贝类,对水产养殖业危害极大[6-7]。更为严重的是,被Vp感染的水生动物会作为主要传播载体感染人类,临床有腹痛腹泻、呕吐发热等典型肠胃炎症状,感染严重者可能引起败血症,甚至死亡,严重危害人类身体健康[8]。
目前,我国针对Vp检测的主要方法仍然是国标方法,包括分离培养、生化鉴定等,该法操作复杂,整个检测周期长达6~7 d,且灵敏度有限[9]。而常用于Vp检测的PCR、LAMP等分子生物学方法[10]通过选取Vp的特异性靶标对其完成鉴定,此类方法灵敏度高、特异性强,但是只能检测相应的基因序列。Vp作为一种条件致病菌,并非所有菌株均可致病,所以即便检测靶标选取的是毒力基因序列,也无法判断其确有产毒引发疾病,因此只进行分子生物学检测易出现假阳性,在致病性副溶血弧菌的检测方面具有局限性。除此之外,该方法对实验操作环境要求较高,需要专业的检测人员和较为昂贵的检测仪器,不利于在乡镇诊所、基层医院等收治患者的一线中推广应用。
Vp产生的多种溶血毒素是主要的致病因子,包括耐热直接溶血素(thermostable direct hemolysin,TDH)、耐热相关溶血素(TDH related hemolysin,TRH)以及不耐热直接溶血素(thermolabile hemolysin,TLH)[11]。现有研究证明,TDH在Vp致病性方面的作用强于TRH,而TLH的致病机制尚不清楚[12]。TDH被189个氨基酸编码,蛋白分子量大小在21 kDa左右,其中前24个氨基酸为信号肽,后165个氨基酸为功能区[13],等电点(PI)在4~5之间[14]。研究发现TDH具有强烈的细胞毒性、肝脏毒性、肠毒性以及溶血活性等[15],被认为是Vp最主要的毒力因子。产生TDH毒素的菌株可在Wagatsuma琼脂培养基上产生一种β溶血现象,被称为神奈川现象(Kanagawa phenomenon,KP)[16]。流行病学研究表明,临床分离株95%以上为KP阳性株,99%的环境分离株为KP阴性株,因此,KP现象被认为是判定Vp是否具有致病力的依据。然而常规的KP实验容易出现假阳性的结果,所以目前TDH检测替代了KP实验,成为判定副溶血弧菌致病力新的依据[13]。
综上,TDH作为Vp最主要的毒力因子,针对其建立快速有效的检测手段可以对Vp的致病株和非致病株进行准确区分。双抗体夹心ELISA(DAS-ELISA)方法具有操作简单、仪器设备要求低、灵敏度高、抗干扰能力强等优点[17]。本研究通过对副溶血弧菌tdh基因进行原核表达,对表达得到的重组蛋白进行纯化后进行新西兰白兔的免疫,制备多克隆抗体并用于DAS-ELISA方法的建立,为研制快速检测副溶血性弧菌TDH的DAS-ELISA试剂盒打下基础。
1 材料与方法
1.1 材料与试剂 副溶血弧菌由本实验室分离保存;产气荚膜梭菌α毒素(CPA)、产气荚膜梭菌ε毒素(ETX)、创伤弧菌溶细胞毒素(VVH)均由本实验室制备和保存;载体pET-28a、DNA Marker(merck公司);E.coliDH5α感受态细胞(Takara公司);E.coliRosetta感受态细胞,蛋白质相对分子质量Marker(全式金公司);BamH I和EcoR I限制性内切酶、T4 DNA连接酶(自赛默飞世尔科技(中国)有限公司);蛋白胨、酵母提取物、哥伦比亚血平板(北京东方赛睿生物技术有限公司);通用DNA纯化回收试剂盒(DP214,天根生化科技有限公司),普通琼脂糖凝胶DNA回收试剂盒(DP209,天根生化科技有限公司)和质粒小提试剂盒(DP103, 天根生化科技有限公司),Biotin Labeling Kit(E-LK-B002,Elabscience)。
1.2 方 法1.2.1 重组蛋白的制备
1.2.1.1 引物的设计与合成 从GenBank上获得副溶血弧菌tdh基因的DNA序列(GenBank accession no.M10069),应用Premier5.0软件设计了一对引物如下:R1:5′-GCGGATCCATGAAACACCAATATTTTGC-3′(含BamH I酶切位点)R2:5′-CGGAATTCTTATTTTTATTGTTGATGT-3′(含EcoR I酶切位点)。引物由生工生物工程(上海)股份有限公司合成。
1.2.1.2 目的基因的扩增及重组表达载体的构建 增菌培养副溶血弧菌,对其DNA进行提取,以提取的细菌DNA为模板,通过PCR扩增tdh基因片段。反应体系如下:2×KOD PCR Mix 2 μL,上下游引物各1 μL,细菌基因组DNA 1 μL,ddH2O 22 μL,95 ℃预变性5 min;95 ℃变性30 s,65 ℃退火30 s,72 ℃延伸30 s,共20个循环后;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,共13个循环;72 ℃延伸10 min。产物用2%琼脂糖凝胶电泳进行检测,并用DNA回收试剂盒(DP214,天根生化科技有限公司)回收目的基因。将载体pET-28a与目的片段分别用限制性内切酶(BamH I和EcoR I)进行酶切,琼脂糖凝胶电泳后回收酶切产物。用T4-DNA连接酶将载体pET-28a与目的片段连接,构建表达载体pET-28a-TDH,将连接产物转化至大肠杆菌DH5α感受态细胞中,用LB琼脂平板(含kanamycin 1 μg/mL)培养筛选目的菌落。挑取单菌落进行液体培养,菌液送生工生物工程(上海)股份有限公司测序鉴定。
1.2.1.3 重组蛋白诱导表达 对测序成功的重组菌用质粒小提试剂盒提取质粒,将构建的重组表达质粒pET-28a-TDH转化表达大肠杆菌感受态细胞Rosetta(DE3)中,吸取100 μL菌液接种于5 mL LB液体培养基(含 kanamycin 100 μg/mL)中,37 ℃、180 r/min摇床培养8 h,将上述菌液转移至500 mL LB液体培养基(含 kanamycin 100 μg/mL)中,37 ℃、180 r/min摇床培养至A600为0.4~0.6后,加入IPTG(终浓度为 2 mmol/L)诱导6 h。4 ℃、8 000 r/min离心20 min,弃上清,收集菌体。取少量菌体加入5 mL PBS重悬菌体,超声破碎,分别收集上清液和沉淀,用聚丙烯酰胺凝胶电泳(SDS-PAGE)进行分析。
1.2.1.4 包涵体蛋白的纯化 将收集到的菌体冻存至-40 ℃,24 h后用50 mL 8 mol/L尿素重悬菌体,置于4 ℃过夜。将菌体置于冰上进行超声破碎,防止细胞裂解过程中产热。超声破碎后的产物于4 ℃、8 000 r/min、离心20 min,取上清并利用0.45 μm的微孔滤膜过滤,使用HISTRAP HP亲和柱进行蛋白纯化,收集A280紫外有明显吸收的峰样品后进行SDS-PAGE电泳分析,对纯度较高的蛋白进行透析复性。
1.2.2 抗体的制备 选取2.0 kg左右的新西兰白兔,免疫之前耳静脉取阴性血清。首次免疫取纯化后的副溶血弧菌耐热直接溶血素400 μg,补充生理盐水到500 μL,再加入等体积弗氏佐剂充分混匀,背部皮下多点注射免疫新西兰白兔。每隔14 d进行一次加强免疫,共进行3次。加强免疫的剂量为200 μg的副溶血弧菌耐热直接溶血素,方法同上。免疫结束后进行颈动脉取血,血液进行两次离心后取血清。采用Protein A亲和层析进行抗体纯化,用ELISA方法检测抗体效价,用Octet分子互作仪检测抗体亲和力。
1.2.3 DAS-ELISA方法的建立
1.2.3.1 生物素标记多抗 使用Biotin Labeling Kit(E-LK-B002,Elabscience)对TDH兔多克隆抗体进行标记。
1.2.3.2 试验最佳条件的筛选 采用棋盘法,检测同一阳性样本和阴性样本,分别对包被抗体、捕获抗体以及酶标抗体进行梯度稀释,优化捕获抗体和检测抗体的稀释浓度;确定酶标二抗的最优稀释倍数,确定封闭液的种类和最佳浓度;选择P/N值最大且阳性样本值接近1.0,阴性样本值接近0.1为最佳条件。
1.2.3.3 灵敏度试验 采用最佳反应条件,按照DAS-ELISA常规操作,检测梯度稀释的TDH并进行线性回归分析,以P/N≥2.1作为阳性判定标准,确定DAS-ELISA对TDH的最低检测限。
1.2.3.4 特异性试验 选取同样在临床中常见的引起人畜共患疾病且致病机制与TDH相似的毒素作为特异性检测的对照毒素进行测定,包括创伤弧菌溶细胞毒素(Vibriovulnificushemolysin,VVH)、产气荚膜梭菌α毒素(Clostridiumperfringensα toxin,CPA)以及产气荚膜梭菌ε毒素(epsilon toxin,ETX),以检测本方法的特异性。
1.2.3.5 模拟样本试验 以无菌操作称取25 g海鲜样本(扇贝、花蛤、魁蚶),分别加入225 mL的3%氯化钠碱性蛋白胨水,使用均质仪处理成匀浆,制成1∶10样品稀释液,10 000 r/min离心10 min取上清。在其中加入梯度稀释的TDH并进行线性回归分析,验证复杂基质是否会对本方法产生影响。除此之外,将TDH+菌株置于碱性蛋白胨水中,37 ℃摇床培养24 h,菌液于10 000 r/min离心20 min,依次将产毒完成的菌液上清与3种模拟样本进行均匀混合,并进行梯度稀释,与菌液上清作对比,采用已确定的最佳反应条件进行检测,验证本方法是否具备检测天然毒素的能力。
2 结 果
2.1 TDH基因的PCR扩增与克隆 以实验室保存的副溶血弧菌的基因组DNA为模板,经PCR扩增得到预期大小为576 bp的目的片段,阴性对照组无特异性扩增条带(图1A)。将tdh基因定向克隆至表达载体pET-28a中,重组质粒经BamH I和EcoR I双酶切得到约576 bp和5 000 bp左右的片段(图1B),表明重组质粒构建成功,将重组表达质粒命名为pET-28a-TDH。
2.2 目的基因在大肠杆菌中的表达、纯化和鉴定 诱导后的菌液沉淀在20 kDa与30 kDa之间出现一蛋白条带,而诱导前未出现相应条带,该条带位置与预期蛋白大小相符。由此初步推断,目的蛋白诱导成功,且以包涵体形式表达。包涵体经8 mol/L尿素变性后超声破碎,上清经HISTRAP HP亲和柱得到纯化后的蛋白,如图2所示。
2.3 多克隆抗体纯化以及评价 新西兰白兔经4次免疫后进行颈动脉取血,2次离心后收集血清。采用Protein A亲和层析进行抗体纯化,纯化过程如图3A所示,纯化图中标有抗体峰的位置即为目的蛋白峰。SDS-PAGE变性和非变性电泳结果如图3B所示,纯化后的蛋白只有1条带,大小约为150 kDa,变性后分为50 kDa、25 kDa,这与IgG抗体的结构一致。将纯化后的抗体使用Octet分子互作仪检测抗体亲和力,结果如图3C所示,亲和力常数为10-8,亲和力良好。用ELISA方法检测抗体效价,用酶标仪测定A450值,结果见表1,效价可达1∶102 400。

表1 副溶血弧菌耐热直接溶血素多克隆抗体效价的ELISA检测结果Tab.1 ELISA results of polyclonal antibody titer against heat-resistant hemolysin of Vibrio parahaemolyticus
2.4 DAS-ELISA方法最佳条件的确认 通过棋盘试验,选择P/N值最大且强阳性样本值接近1.0,阴性样本值接近0.1为最佳条件,得到 DAS-ELISA 方法最佳优化结果,见表2。

表2 DAS-ELISA 方法最佳优化结果Tab.2 Optimized conditions of the DAS-ELISA
2.5 标准曲线的绘制及体系灵敏度的确定 将TDH从10 μg/mL开始进行连续倍比稀释,应用建立好的DAS-ELISA方法,以浓度为自变量,以测得A450为因变量,绘制标准曲线。结果如图4,分析得标准曲线的方程为y=0.002 2x+0.094 2,R2>0.99,检测最佳范围为:78~312 ng/mL,最低检出值为78 ng/mL。
2.6 特异性实验 以建立好的DAS-ELISA方法对VVH、ETX以及CPA进行检测,结果见表3,3种毒素的P/N值明显低于2.1,呈现阴性,表明本方法与其他抗原无交叉反应,特异性强。
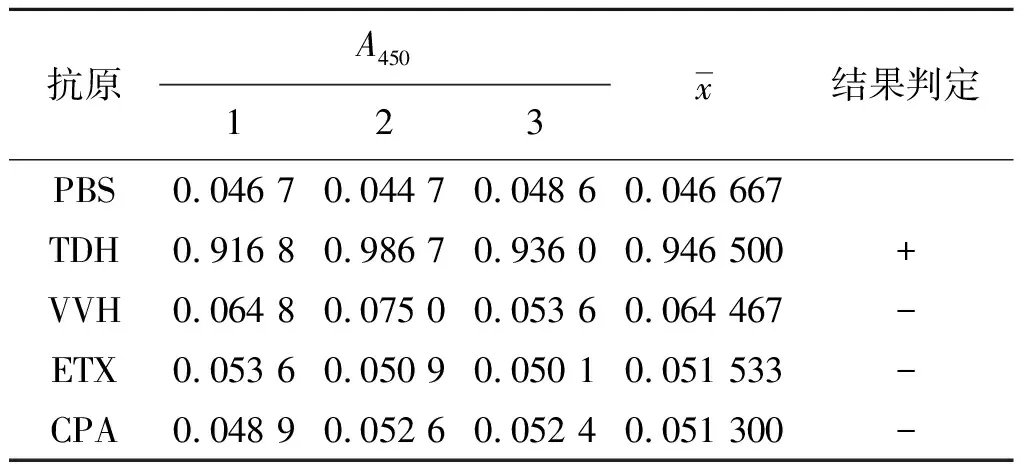
表3 特异性检测结果Tab.3 Specificity test of the DAS-ELISA
2.7 模拟样本的检测 本实验用扇贝、花蛤和魁蚶模拟实际应用中海鲜样本,在海鲜中加入TDH重组蛋白,采用建立好的DAS-ELISA方法进行检测,结果显示灵敏度并不会受到海鲜样本中复杂基质的影响,3种模拟样本的最低检测限均保持在78 ng/mL,标准曲线的检测最佳范围为:78~312 ng/mL,R2均在0.99以上,线性关系良好(图5)。在海鲜中加入菌液上清模拟天然毒素检测时,模拟样本检出率为100%,浓度测定结果与菌液上清做对比,误差(E)为5.13%~13.25%(表4)。以上结果表明本方法具有良好的检测复杂基质的能力且适用于天然毒素的检测,具备检测市场上海鲜样本的能力。
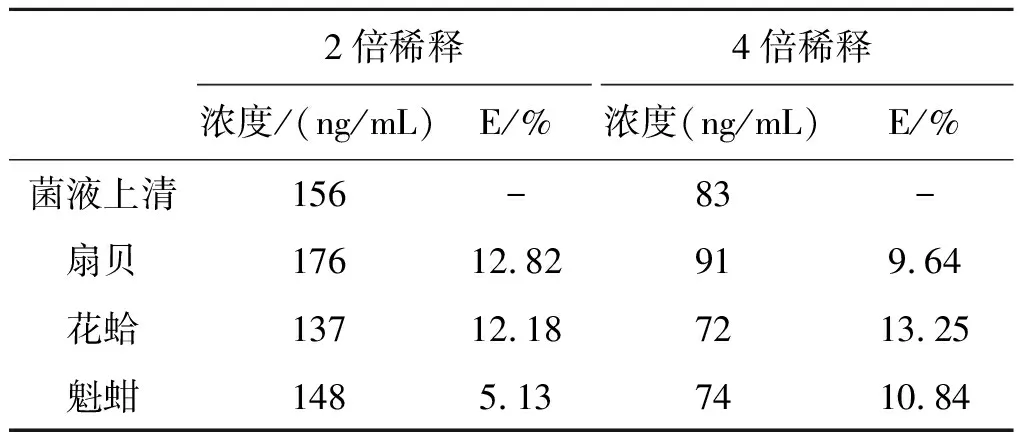
表4 模拟样本检测结果Tab.4 Detection of TDH in simulated samples
3 讨 论
近年来食品安全问题频繁发生,世界卫生组织已将其视为世界性挑战难题,而食源性致病菌产生的毒素是引起食品安全问题的主要原因之一。根据我国疾病监测系统最新数据显示[18],生物性因素是引起食源性疾病的最主要因素,其中Vp是微生物性因素中所致的发病人数比例最高的致病菌,目前副溶血弧菌中毒已取代沙门氏菌成为我国沿海地区引发人类肠胃炎的首要原因[18],也是水产品养殖内引发甲壳类动物红腿病、鱼类败血症的主要致病菌。目前,Vp的致病机制尚不明确,不同学者所持观点各不相同,有研究表明TDH具有剂量和时间依赖性的肝毒性和非常迅速的致死效应[19],TDH仍是公认的Vp产生的最主要的致病因子。目前针对TDH的检测主要集中在分子生物学领域[20],但此类方法在毒性检测方面具有局限性。为了更好地检测TDH对人类的致病作用,研究人员开始聚焦于蛋白水平的检测,如窦勇等[21]利用甲醛灭活的Vp菌体作为抗原制备兔多克隆抗体做检测抗体[22]及TDH 毒素鼠单克隆抗体做捕获抗体,建立的ELISA检测方法灵敏度为6 000 ng/mL,该方法利用鼠单抗做捕获抗体,提高了检测特异性,但是由于捕获抗体的制备使用的是菌体而非纯化的蛋白,所以灵敏度略低。王艳等[23]以实验室自制多克隆抗体[24]建立了检测TDH毒素的Dot-ELISA方法,其自制的抗体效价为1∶25 600,该方法的灵敏度为25 000 ng/mL,虽然操作简单,但是该方法在结果判定上过于主观,且无法进行定量检测。由于该方法制备的抗体效价较本方法低一个数量级,所以可能导致灵敏度低于本方法。T. Honda等[17]利用天然菌液进行产毒培养制备了单克隆抗体,构建了用于TDH检测的ELISA方法,其灵敏度可达1 ng/mL,但是天然菌液产毒率过低而且单克隆抗体仅能识别毒素的特定表位,在拥有较高灵敏度的同时也存在一定程度的漏检率。
本研究通过构建表达TDH重组蛋白,完成了多克隆抗体的制备,抗体效价可达1∶102 400,优于既往研究;此外,抗体亲和力常数为10-8,具备很好的亲和力。通过利用制备的多克隆抗体建立了DAS-ELISA检测方法,灵敏度可达78 ng/mL,优于国内现有的TDH毒素ELISA检测方法,且特异性良好。在海鲜模拟样本的检测中,灵敏度并不会受到复杂基质的影响,3种模拟样本的最低检测限均为78 ng/mL;与菌液上清进行混合后验证其检测天然毒素能力时,检出率为100%,表明初步具备检测天然毒素的能力。目前,国内仅有用于tdh基因的检测试剂盒,针对TDH检测的试剂盒市场仍为空白,本研究构建的DAS-ELISA检测方法有望开发成为副溶血弧菌TDH快速诊断试剂盒,为副溶血弧菌TDH毒素基层检测提供新的思路。
利益冲突:无
引用本文格式:白雪欣,胡宸艺,金志颖,等. 副溶血弧菌耐热直接溶血素DAS-ELISA检测方法的建立[J]. 中国人兽共患病学报,2022,38(8):666-672. DOI:10.3969/j.issn.1002-2694.2022.00.106

