人MAPK3基因克隆及其在肝细胞癌细胞中的作用
倪 佳,徐莹莹,邓婉玲,宋苗苗,石 静,孙达权
(1.贵阳市妇幼保健院·贵阳市儿童医院,贵州 贵阳 550001;2.宁波市第一医院 疝肝胆肛肠外科,浙江 宁波 315000;3.贵州医科大学 基础医学院,贵州 贵阳 550025)
丝裂原活化蛋白激酶3(Mitogen-activated protein kinase 3,MAPK3)是由MAPK3 基因编码的一种分子量44 kDa的丝氨酸/苏氨酸蛋白激酶,又名细胞外信号调节激酶1(Extracellular signal-regulatedkinase 1,ERK1),是MAPK家族的重要成员之一,它通常与分子量42 kDa的丝裂原活化蛋白激酶1(Mitogen- activated protein kinase 1,MAPK1)共同组成MAPK1/3,是Ras(Rat sarcoma proto-oncoprotein)-MAPK信号通路的重要成员[1-3]。大量研究表明,MAPK1/3不仅参与细胞的多种生理功能,如细胞的生长增殖、迁移、分化、稳态调节和凋亡等,也与多种细胞病变有关,许多癌基因编码的蛋白可通过持续激活MAPK1/3,诱发肿瘤的发生发展和肿瘤血管生成等[4-7]。到目前为止,虽然有许多文献描述了MAPK1/3的生物学功能,但单独研究MAPK3对肝细胞癌影响作用的文献较少。本研究通过克隆人MAPK3基因和构建MAPK3基因稳转克隆肝细胞癌细胞株,研究MAPK3基因对肝细胞癌细胞生长增殖、迁移和侵袭的影响。
1 材料与方法
1.1 细胞 人永生化肝上皮细胞THLE-3(C4144)和人肝细胞癌细胞Hep 3B(SCSP-5045)分别购自上海冠导生物工程有限公司和中科院上海细胞库,均有STR鉴定结果。THLE-3细胞用含有10 %胎牛血清的RPMI-1640培养,Hep 3B细胞用含有10 %胎牛血清的MEM(minimum Eagle’s medium)培养,培养条件为37 ℃、5 % CO2。
1.2 主要试剂 PrimeScriptTMIV 1st strand cDNA Synthesis Mix(6215A)、PrimeSTAR®Max DNA Polymerase(R045A)、TaKaRa MiniBEST Agarose Gel DNA Extraction Kit Ver.4.0(9762)、DL10,000 DNA Marker(3584A)、pMDTM18-T Vector Cloning Kit(6011)、EcoR I(1040A)、XhoI(1094A)、T4 DNA Ligase(2011A)(TaKaRa,日本),质粒小提试剂盒(DP103)、DH5a 感受态细胞(CB101)、无内毒素质粒小提中量试剂盒(DP118)(天根生物,中国),MEM(含GlutaMAXTM添加剂,41090036)、RPMI 1640 培养基(31870082)、PierceTMBCA 蛋白定量试剂盒(23225)、TRIzolTM试剂(15596026)、LipofectamineTM2000 Transfection Reagent(11668019)、GeneticinTM选择性抗生素(11811023)(ThermoFisher Scientific,美国),优级胎牛血清(11011-8611)(天杭生物,中国),PCR引物和DNA测序(博迈德,中国),真核表达载体pEYFP-N1长期保存于本实验室,可用于检测YFP的GFP-tag (3A10) monoclonal antibody(AP0675M)、ERK1/2 (L352) polyclonal antibody(BS1112)、GAPDH polyclonal antibody(AP0063)、Stat3 (S727) polyclonal antibody(AP0366)、Stat3 (phospho-S727) polyclonal antibody(BS4180)、MMP-2 (L638) polyclonal antibody(BS1236)、HRP标记的二抗(BS13278、BS12478)(巴傲得,中国),E-Cadherin(WL01482)、N-Cadherin(WL01047)、Vementin(WL01960)、c-Myc(WL01781)(万类生物,中国),基底胶Matrigel(356234)(索莱宝,中国)。
1.3 方法
1.3.1 基因克隆与测序 根据NCBI中人MAPK3的基因序列(NM_002746)和真核表达载体pEYFP-N1的多克隆位点设计并合成一对聚合酶链式反应(Polymerase chain reaction,PCR)引物(见表1),在上游引物的5′端引入XhoI酶切位点,下游引物的5′端加入EcoR I酶切位点,小写部分为XhoI酶切位点,最前端的两个碱基为保护性碱基;小写部分为EcoR I酶切位点,最前端的两个碱基为保护性碱基。

表1 人MAPK3的PCR引物
用6 cm小皿培养人肝上皮细胞THLE-3,当细胞生长融合至80%时,弃去培养基,用磷酸盐缓冲液清洗细胞3次后,加入1 mL TRIzol试剂,充分吹打和裂解细胞,按说明书程序提取细胞总RNA,并将RNA溶液定容至1 μg/μL。按cDNA反转录试剂盒说明书流程合成cDNA第一链。以合成的cDNA模板,用人MAPK3 PCR引物根据高保真DNA聚合酶说明书操作流程体外扩增获得人MAPK3基因蛋白编码区。
用1%琼脂糖凝胶电泳分离和纯化PCR扩增获得的人MAPK3基因蛋白编码区,通过3′末端加“A”试剂盒给纯化的PCR产物加“A”,然后克隆入pMD18-T载体中。经转化、筛选培养和酶切鉴定后,对可能含有MAPK3基因的重组载体进行DNA测序,测序结果用BioXM 2.6进行比对,测序正确的质粒命名为pMD18T-MAPK3。
1.3.2 构建重组真核表达质粒 用XhoI/EcoR I双酶切真核表达载体pEYFP-N1和含有目的基因的pMD18T-MAPK3,用1%琼脂糖凝胶分离和纯化骨架载体和目的基因,并用T4连接酶将两者连接起来。经转化、抗生素筛选培养、质粒抽提和双酶切鉴定后,对可能重组正确的质粒进行DNA测序,测序正确的重组真核表达载体命名为pEYFP-MAPK3。
1.3.3 构建稳转克隆肝细胞癌细胞株 用无内毒素质粒小提中量试剂盒提取质粒pEYFP-MAPK3,并将DNA浓度定容为1 μg/μL。 在6孔板中按最大细胞数的50%铺板人肝细胞癌细胞Hep 3B,细胞贴壁后更换为无血清的MEM细胞培养液,按LipofectamineTM2000 Transfection Reagent说明书对细胞稳定转染pEYFP-MAPK3,转染后6 h更换为含10%胎牛血清的MEM培养液继续培养,转染后48h在倒置荧光显微镜下观察细胞荧光。将转染的细胞消化并传至10 cm细胞培养皿中继续培养,转移后72 h后在培养液中加入600 μg/mL的G418,筛选培养5d后更换为含300 μg/mL Geneticin的细胞培养液。待细胞长成单克隆后,在倒置荧光显微镜下挑取带黄色荧光的单克隆细胞株,转移到96孔板中继续培养,经扩大培养后进行验证和后续实验。该实验方法是根据文献[8]和具体实验改编而成。
1.3.4 蛋白免疫印迹实验 细胞生长融合至70%时,胰酶消化并收集细胞,抽提细胞蛋白并用BCA 蛋白定量试剂盒对蛋白溶液进行定量,制备蛋白样品后进行十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(Sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)。电泳结束后对蛋白进行湿法转膜,用TBST清洗对PVDF膜3次,用5%脱脂奶粉在37℃封闭30 min,TBST清洗3次,一抗4℃孵育过夜,TBST清洗3次,二抗室温孵育2 h,TBST清洗3次,ECL发光成像。用Image J获取目的条带的灰度值。
1.3.5 细胞生长增殖实验 取1 000个细胞铺于E-Plate L16中,每孔用含10%胎牛血清的MEM定容至终体积200 μL,室温下放置30 min,将E-Plate L16放到iCelligence分析仪上进行实时检测。在系统自动扫描“Scan Plate”后,开始绘制出相应的细胞增殖曲线。细胞指数值与细胞数量成正相关,即细胞指数越大,孔内细胞数目越多,细胞增殖能力越强。
1.3.6 划痕愈合实验 将细胞按100%的融合率接种于12孔板中,每组设置3个复孔。待细胞贴壁后用10 μL的枪头紧贴着消毒过的直尺在孔中间按“|”轻轻划痕,PBS洗去漂浮的细胞,加入1 mL新鲜的不含血清的MEM培养液培养,并在0、48 h时分别在显微镜下记录细胞的愈合情况。
1.3.7 细胞侵袭实验 将基底胶用MEM细胞培养液按1∶10稀释(冰浴操作),取稀释后的基底胶100 μL加入到Transwell小室中,细胞培养箱中放置5 h,倒掉小室中的液体,用磷酸盐缓冲液清洗1次。将消化并用磷酸盐缓冲液清洗后的细胞用无血清的MEM细胞培养液稀释混匀,按100%的融合率接种至Transwell小室中,并用MEM定容至200 μL;在24孔板的孔中加入600 μL含10%胎牛血清的MEM细胞培养液,将铺了细胞的Transwell小室移入24孔板中,培养24 h后取出Transwell小室,4%多聚甲醛室温固定30 min后用结晶紫染色,自来水清洗脱色,用棉签拭去小室内侧的细胞。每孔随机选取3个视野拍照记录,每组设置3个复孔。
1.4 统计学分析 用软件SPSS 21.0对实验数据进行分析。两组组间分析采用独立样本t检验分析,P< 0.05表示差异具有统计学意义。
2 结果
2.1 获得人MAPK3基因蛋白编码区和重组真核表达质粒pEYFP-MAPK3 如图1A所示,以人肝上皮细胞cDNAs为模板,通过RT-PCR获得长度约1.1 kb的人MAPK3基因的蛋白编码区。TA克隆后,DNA测序结果显示RT-PCR产物正是人MAPK3基因的蛋白编码区,且无任何形式的突变。将人MAPK3基因蛋白编码区通过XhoI/EcoR I酶切位点插入到真核表达载体pEYFP-N1中,构建pEYFP-MAPK3(见图1B),DNA测序结果显示MAPK3准确插入到pEYFP-N1的预定碱基中,其质粒图谱如图1C所示。

A:RT-PCR扩增人MAPK3基因蛋白编码;B:Xho I/ EcoR I双酶切鉴定重组真核表达质粒pEYFP-MAPK3;C:质粒pEYFP-MAPK3图谱。
2.2 建立MAPK3基因稳转克隆肝癌细胞株 用脂质体法将重组质粒pEYFP-MAPK3导入肝细胞癌细胞Hep 3B后,经药物筛选培养和克隆集落扩大培养,选取荧光显微镜下呈黄色荧光的细胞集落(见图2A),分别用可以检测YFP蛋白的GFP标签抗体和检测MAPK3蛋白的MAPK3/2抗体对细胞内表达的目的蛋白进行验证,结果如图2B所示,筛选获得的单克隆肝细胞癌细胞株内过表达带有YFP的MAPK3融合蛋白MAPK3-YFP,证明MAPK3基因稳转克隆肝细胞癌细胞株构建成功。
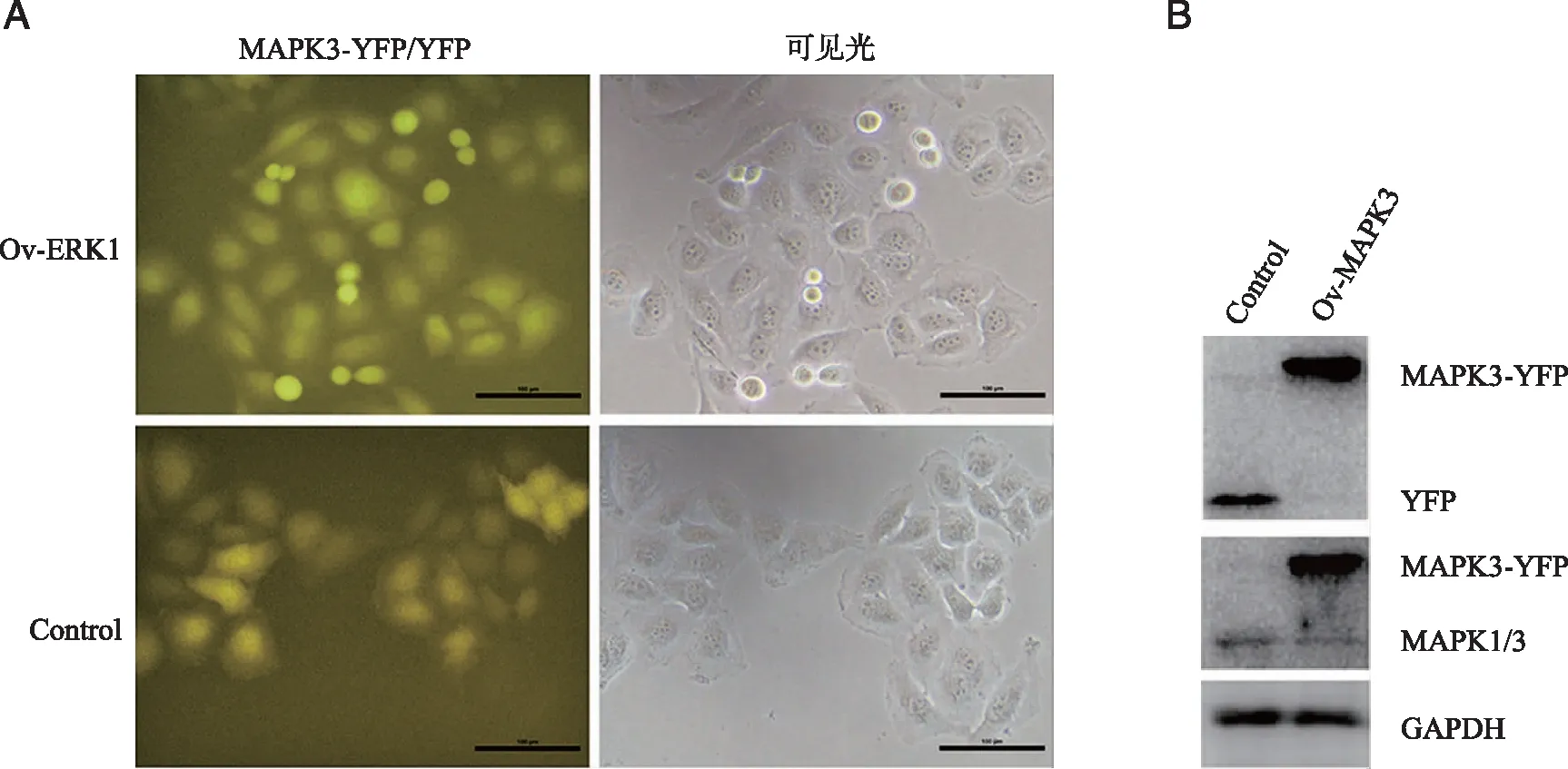
A:外源MAPK3基因融合蛋白(MAPK3-YFP)在荧光显微镜下使肝细胞癌细胞Hep 3B呈黄色;B:外源MAPK3-YFP在肝细胞癌细胞Hep 3B(Ov-MAPK3)中表达。
2.3MAPK3基因促进肝细胞癌细胞生长增殖、迁移和侵袭 为分析MAPK3基因对肝细胞癌细胞表型的影响,本组以表达外源YFP蛋白的Hep 3B为对照细胞,通过实时无标记细胞分析技术发现表达MAPK3融合蛋白的肝细胞癌细胞的生长和增殖速率明显提高(P=0.017,见图3A);同时,细胞损伤-愈合实验结果显示MAPK3能够显著提高癌细胞的迁移能力(P=0.022,见图3B);另外,细胞侵袭实验结果显示肝癌细胞表达外源MAPK3后,侵袭的癌细胞数增加(见图3C)。以上结果显示,在肝细胞癌细胞中过表达外源MAPK3基因后,可以促进癌细胞的生长和增殖速度、迁移能力和侵袭能力。
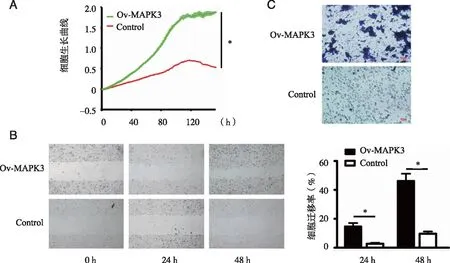
A:MAPK3基因促进肝癌细胞Hep 3B生长增殖;B:MAPK3基因促进肝癌细胞Hep 3B迁移;C:MAPK3基因促进肝癌细胞Hep 3B侵袭;*:与对照组比较, P<0.05。
2.4MAPK3基因影响肝癌细胞内相关的基因表达 为分析MAPK3基因是如何影响肝细胞癌细胞表型的,本组先对MAPK3下游分子信号传导子及转录激活子(Signal transducer and activator of transcription,Stat3)进行分析,发现过表达MAPK3在不影响Stat3蛋白整体水平,但可以显著提高p-Stats727的表达水平(P=0.046),并促进Stat3的靶基因蛋白c-Myc(P=0.031)和基质金属蛋白酶-2(Matrix metalloproteinase-2,MMP-2)(P=0.043)的表达水平(见图4)。此外,过表达的MAPK3还可以明显促进肝细胞癌细胞中N-Cadherin的表达(P=0.025)并抑制E-Cadherin(P=0.017)的表达,但Vimentin的表达基本不受MAPK3过表达的受影响(见图4)。这些蛋白表达变化可能就是引起肝细胞癌细胞表型变化的分子基础。
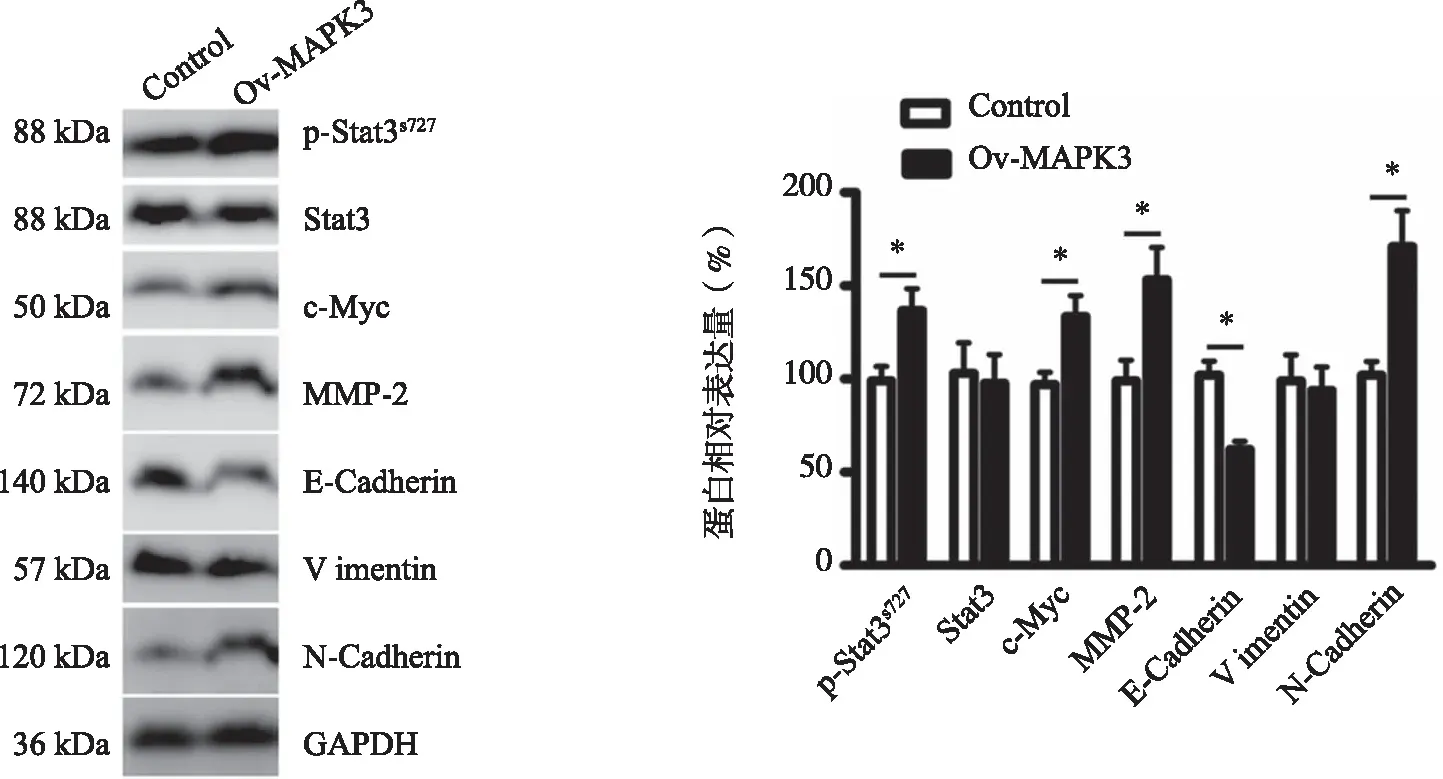
*:与对照组比较, P<0.05。
3 讨论
肝细胞癌具有复杂的肿瘤分子发病途径,MAPK途径是其重要的途径之一[9]。MAPKs是信号从细胞表面传导到细胞核内部的重要传递者,MAPK1/3是ERK家族的重要成员,主要通过修饰转录因子而影响靶基因的转录与表达,参与细胞代谢和生理活动[10-11]。研究表明,MAPK1/3异常表达及其信号通路活化与多种肿瘤发生发展有密切的关系[1,3,7,9,11]。但是,MAPK1/3并非是一个蛋白,也不是同一个基因的表达产物;实际上它们是一对由高度同源的基因,即MAPK1基因和MAPK3基因,各自编码的不同蛋白质,两者在蛋白质的一级结构上具有85%的相似性。由于这两个蛋白的分子量相近且的免疫原相似,且具有诸多类似的生物学功能而被书写成MAPK1/3。事实上,两种蛋白质的一级结构上还是存在些许差异的。首先,MAPK3蛋白在N-末端比MAPK1多出一段氨基酸残基序列:GGEPRRTEGVGPGVPGE,这可能可以赋予MAPK3新的蛋白特性和对应的生物学功能。研究发现,由于MAPK3 N-末端的这段特殊序列存在,导致其在胞质中磷酸化活化后的入核速度显著低于MAPK1,使细胞核内MAPK3总体磷酸化水平降低,最终导致MAPK3的促细胞增殖能力显著降低[12-13]。但MAPK3仍具有调节细胞生长增殖的能力,如在大鼠PC12细胞中,用microRNA-15b-5p结合MAPK3 3′UTR RNA,抑制ERK1表达后可减缓细胞的生长增殖速度[14]。还有研究发现,MAPK3可以促进白血病细胞HL-60的生长增殖速率,这一促进作用可以被与MAPK3 3′UTR RNA 结合的miR-143所阻断[15]。此外,MAPK3还在其他多个方面展现其独特的生物学作用,包括特异性调控脂肪细胞分化[16]、诱发实验性哮喘[17]、诱导破骨细胞形成[18]、抑制视网膜损伤[19]、自身免疫性脑脊髓炎[20-21]以及诱导肝纤维化进程[22]等。这些研究均表明,除与MAPK1相似的生物学功能外,MAPK3还具有不同于MAPK1的特殊生物学功能。因此,有必要单独展开MAPK3和MAPK1的生物学功能研究以及两者之间的关联性和差异性。
为分析MAPK3在肝细胞癌细胞中的作用,本研究首先以人肝上皮细胞来源的mRNA为模板,利用RT-PCR反转录扩增获得人MAPK3基因的蛋白编码区,并构建了真核表达载体pEYFP-MAPK3;通过脂质体转染、geneticin药物筛选、克隆选取培养与蛋白免疫印迹鉴定,成功获得过表达MAPK3基因的肝细胞癌细胞克隆株。然后,利用实时无标记细胞分析技术、细胞损伤-愈合实验和细胞侵袭实验分别证明过表达ERK1基因可以加速肝细胞癌细胞的生长增殖速率、提高肝细胞癌细胞的迁移能力和侵袭能力。有趣的是在另一个研究中,我们发现当用RNAi单独敲低肝细胞癌细胞内源性MAPK3后,细胞的生长增殖能力并未受到显著影响(数据未列出),这可能与肝细胞中MAPK1的表达量显著多于MAPK3有关,并且在四肢类生物中MAPK3基因和MAPK1基因呈现功能冗余[23]。由此我们认为,要完全了解MAPK3在肝细胞癌细胞中的作用,不仅要结合MAPK3基因敲除的结果,还要与MAPK1基因过表达与敲除的肝细胞癌细胞表型相结合,才有可能能得出全面并精准的实验结论,准确掌握MAPK3在肝细胞癌细胞中的生物学功能。
此外,我们还对过表达MAPK3后导致肝细胞癌细胞表型恶化的分子基础进行了初步探索,发现肝细胞癌细胞过表达MAPK3后,细胞内MAPK3的下游靶蛋白Stat3的磷酸化水平上升。Stat3是一种功能复杂的核转录因子和癌蛋白,广泛高表达和超活化于多种癌细胞和肿瘤生态系统中的非癌细胞中,研究指出人类有超过50%的肿瘤组织中Stat3高度表达并具有成百上千个转录靶基因[24-25]。我们对其中两个具有促进细胞生长作用的c-Myc和可引起细胞外基质降解的MMP-2的靶基因蛋白进行分析验证,发现细胞内的c-Myc和MMP-2表达同时升高。另外,研究还发现过表达MAPK3可以促进N-Cadherin并抑制E-Cadherin的表达。这些基因的表达变化可能与MAPK3诱导肝细胞癌细胞的增殖、迁移和侵袭有关。但是,我们相信MAPK3增强肝细胞癌细胞的癌性不仅仅与上述基因的表达变化有关,应该还有更多基因受MAPK3的表达而受到影响,而这些基因需要进一步去探索和挖掘。

