miR-92a靶向PTEN促进宫颈癌细胞增殖*
蒋佩佩,蔡徐山,2△,张春利,宦 宇,齐结华,吴守乐,乐江漫
1.上海市嘉定区妇幼保健院检验科,上海 201821;2.同济大学生命科学与技术学院,上海 200092
宫颈癌是最常见的妇科恶性肿瘤之一,其发病率仅次于乳腺癌、结直肠癌和肺癌[1]。据世界卫生组织不完全统计,全球每年新增宫颈癌病例50多万例,发病率逐年上升,并呈年轻化趋势,宫颈癌每年造成约30万人死亡,其中85%发生在发展中国家,已严重影响女性的生存质量[2]。因此,研究宫颈癌的发病机制,寻找潜在的预后和靶向治疗指标对提高宫颈癌患者的生存率具有重要意义。
微小RNA(miRNA)是在真核细胞及病毒体内发现的一类内源性染色体上的非编码小分子单链RNA,长度为14~22个核苷酸[3]。miRNA通过与靶mRNA分子的3′-非翻译区(3′-UTR)互补序列结合诱导mRNA 降解或抑制翻译[4],调控基因表达。有研究表明,miRNA广泛参与细胞发育、物质与能量代谢、免疫及炎性反应等各种生命代谢活动[5-8]。miR-92a属于miR-17-92基因簇,据报道,miR-92a参与胃癌、骨肉瘤、鼻咽癌、肺癌、前列腺癌、结直肠癌和肝癌等多种肿瘤的发生和发展[9-13]。有研究表明,在宫颈癌组织、患者血清及细胞系中miR-92a均高表达[14-15]。ZHOU等[15]研究显示,miR-92a可通过靶向抑癌基因FBXW7调控宫颈癌细胞周期,促进细胞增殖,增强细胞侵袭力。动物实验证实,miR-92a可通过丝裂原活化蛋白激酶(MAPK)/细胞外信号调节激酶(ERK)途径降低小鼠免疫力,增强宫颈成瘤能力[16]。
据生物信息学预测和功能分析,磷脂酰肌醇3激酶(PI3K)/蛋白激酶B(AKT)途径的负调节因子第10号染色体同源丢失性磷酸酶张力蛋白基因(PTEN)是miR-92a的可能靶标[12]。然而,在宫颈癌中miR-92a经该通路靶向PTEN的调节作用鲜见报道。本研究通过体外干预宫颈癌细胞系miR-92a水平,初步探索其在PTEN/PI3K/AKT通路中对宫颈癌细胞的影响,并探讨相关分子机制。
1 材料与方法
1.1材料 宫颈癌细胞HeLa和SiHa(上海攸碧艾细胞库);DMEM-高糖培养基、胎牛血清(FBS)和胰蛋白酶(美国Gibco公司);逆转录试剂盒和PCR定量试剂盒(TaKaRa公司);抗磷酸化蛋白激酶B(p-AKT)、AKT、PTEN、GAPDH抗体(美国CST);LipofectamineTM2000(Lip2000,美国Invitrogen公司)。miR-92a-3p inhibitor及其阴性对照、PTEN、内参U6和GAPDH引物由上海生工生物工程有限公司合成。
1.2细胞培养 从液氮中取出HeLa与SiHa细胞,快速复苏后立即重悬于含有10%FBS和1%双抗(青霉素与链霉素各100 U/mL)的DMEM-高糖培养基中。于37 ℃、5% CO2恒温培养箱中进行细胞培养。细胞隔天更换一次培养基,细胞长至密度80%~90%时进行细胞传代。
1.3细胞分组与转染 将细胞接种于培养板并用不含血清与双抗的培养基培养,待细胞密度约60%时采用Lip2000进行RNA序列转染,分别转染miR-92a-3p inhibitor(inhibitor组)及其阴性对照(NC组),以未处理的宫颈癌细胞为空白对照组。转染后将培养板置于37 ℃、5% CO2恒温培养箱中培养,6 h后弃除含转染液的培养基,更换为完全培养基,继续培养。
1.4实时荧光定量PCR(RT-qPCR) 转染48 h后提取总RNA。用磷酸盐缓冲液(PBS)清洗细胞,加入Trizol 试剂,冰上裂解10 min,用移液枪吹打数次,充分裂解细胞后转移至离心管中,加入氯仿,涡旋振荡后4 ℃离心,取上层水相于离心管中,加入异丙醇后4 ℃离心,弃上清,收集RNA沉淀。沉淀用预冷75%乙醇洗涤后离心,弃上清,沉淀于冰上晾干,加入DEPC水充分溶解RNA。测定RNA浓度和纯度。根据逆转录试剂盒逆转录miRNA(条件:42 ℃ 15 min,85 ℃ 5 s)和mRNA(条件:37 ℃ 15 min,85 ℃ 5 s),得到cDNA,然后以cDNA 为模板进行PCR反应。反应条件:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火延伸34 s,共40个循环。按照2-ΔΔCt公式,分别以GAPDH和U6为内参计算PTEN mRNA和miR-92a的相对表达量。基因及其引物序列见表1。

表1 引物序列
1.5细胞活率 采用CCK-8试剂盒检测细胞活率。将细胞接种到96孔板中,待细胞过夜贴壁后进行转染,分别于转染24、48、72 h向每孔中加10 μL CCK-8试剂,每个时间段设3个复孔,放置培养箱内孵育1 h,用酶标仪测定450 nm处各组细胞的吸光度(A)。
1.6细胞凋亡率 采用Annexin V-FITC/PI双染法联合流式细胞仪检测凋亡率。将每组细胞以2×105个/孔接种于六孔板,细胞培养24 h后行转染,转染后继续培养。于培养36~48 h收集细胞,1×Binding Buffer洗涤3次,重悬细胞后加入5 μL Annexin V-FITC,室温孵育15 min,上机前5 min加入5 μL PI。实验重复3次。
1.7Western blotting检测PTEN和磷酸化-AKT(p-AKT)蛋白表达 收集转染48 h的各组细胞,加入PIPA裂解液冰上反应10 min,以低温12 000 r/min离心10 min,提取上清蛋白裂解液。采用BCA法测定裂解液中蛋白浓度,调平蛋白浓度后加入上样缓冲液,煮沸蛋白。行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白,湿转法将蛋白转至聚偏氟乙烯膜(PVDF膜)。2%牛血清清蛋白(BSA)封闭1 h,TBST洗膜3次。加入一抗(PTEN、p-AKT和GAPDH抗体的稀释度均为1∶1 000),于4 ℃孵育过夜,加入荧光标记二抗室温孵育1 h,TBST洗膜后置于红外激光成像仪显影。

2 结 果
2.1RT-qPCR验证转染效率 HeLa 细胞中,inhibitor组miR-92a相对表达量(0.030±0.001)较NC组(0.980±0.007)明显下降(P<0.01);SiHa细胞中,inhibitor组miR-92a相对表达量(0.010±0.001)较NC组(0.990±0.006)明显下降(P<0.01),说明HeLa 细胞、SiHa细胞中miR-92a-3p inhibitor均转染成功,可用于后续实验。见图1。

注:ns表示与空白对照组比较,差异无统计学意义(P>0.01);与NC组比较,aP<0.01。
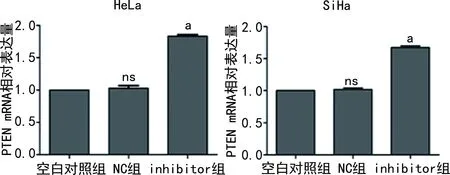
2.2PTEN mRNA相对表达量 HeLa细胞中,inhibitor组PTEN mRNA相对表达量(1.830±0.050)较NC组(1.090±0.050)升高(P<0.01)。SiHa 细胞中,inhibitor组PTEN mRNA的相对表达量(1.670±0.040)较NC组(1.040±0.030)升高(P<0.01)。见图2。
2.3抑制miR-92a表达对宫颈癌细胞活率的影响 CCK-8试验结果显示,与空白对照组相比,inhibitor组在转染48、72 h细胞活率均降低(P<0.05),而NC组和空白对照组间差异无统计学意义(P>0.05)。见图3。
注:ns表示与空白对照组比较,差异无统计学意义(P>0.01);与NC组比较,aP<0.01。

注:与NC组转染48 h时比较,aP<0.05;与NC组转染72 h时比较,aP<0.01。
2.4抑制miR-92a表达对宫颈癌细胞凋亡的影响 HeLa 细胞中,inhibitor组的细胞凋亡率[(16.54±0.78)%]高于空白对照组[(4.56±0.64)%]和NC组[(5.97±0.34)%],差异均有统计学意义(P<0.01),NC组和空白对照组比较,差异无统计学意义(P>0.05)。SiHa细胞中,inhibitor组的细胞凋亡率[(15.69±0.64)%]高于空白对照组[(4.37±0.74)%]和NC组[(5.32±0.41)%],差异均有统计学意义(P<0.01),NC组和空白对照组比较,差异无统计学意义(P>0.05)。见图4。

图4 抑制miR-92a表达后SiHa和HeLa 细胞凋亡检测结果
2.5抑制miR-92a表达对宫颈癌细胞PTEN、p-AKT表达的影响 Western blotting检测结果显示,相比空白对照组,inhibitor组 PTEN蛋白表达升高,p-AKT的表达下降,NC组蛋白表达无明显变化。见图5。

图5 抑制miR-92a表达后SiHa和HeLa细胞PTEN和p-AKT蛋白表达情况
3 讨 论
miRNA是一类调控基因表达的非编码RNA,仅占蛋白编码基因的1%,而调节约1/3基因的表达[17]。生物信息学分析表明,一个miRNA有数百个靶基因,同时涉及多个信号通路,miRNA可能参与几乎所有生命代谢活动[18]。有研究表明,位于肿瘤相关基因组区域的miRNA可以发挥癌基因或抑癌基因作用。
宫颈癌的发生、发展是多因素参与、多阶段的过程,人乳头瘤病毒(HPV)感染是其最重要的发病因素,miRNA在此过程中也发挥了重要作用。HPV-DNA整合到宿主染色体引起染色体结构不稳定及病毒致瘤蛋白的作用可能使miRNA的表达模式发生改变。miRNA的基因多态性和甲基化修饰也可增加癌症的易感性[19]。此外,任何参与miRNA 加工的蛋白质的改变都可能干扰前体miRNA的有效成熟和(或)影响miRNA变体(isomiR)的生物发生,并可能彻底改变miRNA的功能。miRNA加工蛋白的失调已在HPV诱导的早期癌症中被观察到,如Drosha、AGO2和TENT2等[20],这表明miRNA可能参与了早期宫颈癌的发展。
有研究证实,miRNA在宫颈癌中表达失调,一些miRNA可促进宫颈癌的发生、发展,如miR-17、miR-21、miR-135、miR-150、miR-155、miR-196、miR-378、miR-425[21]。作为miR-17-92基因簇家族中的一员,miR-92a在多种肿瘤细胞的增殖、侵袭和转移能力上扮演了不可或缺的角色。宫颈癌的体外实验和动物实验表明,miR-92a可经由相关信号通路和靶向基因促进细胞增殖,增强侵袭力,发挥致癌作用[15-16],但相关机制报道甚少。
为探讨miR-92a在宫颈癌细胞中的作用,本研究向宫颈腺癌HeLa和鳞癌SiHa细胞转染miR-92a inhibitor,RT-qPCR结果表明,miR-92a受到有效抑制。本研究中,CCK-8试验和流式细胞术检测结果显示,抑制miR-92a表达后,宫颈癌细胞的活率下降,凋亡率升高,提示miR-92a对宫颈癌发生、发展具有潜在的促进作用。SU等[22]研究进一步说明,miR-92a可通过抑制p21的表达和促进细胞周期进程来促进宫颈癌细胞的增殖,突出了miR-92a在宫颈癌中的临床意义。
PI3K/AKT通路是重要的细胞增殖信号通路,PTEN蛋白可使PI3K的产物三磷酸磷脂酰肌醇(PIP3)脱磷酸,从而下调该通路来维持生物体内细胞增殖与凋亡的动态平衡。PTEN/PI3K/AKT通路的失调已被证实参与多种肿瘤的发生、发展[9-13]。生物信息学预测PTEN是miR-92a的可能靶标,为了进一步探讨miR-92a是否通过PTEN/PI3K/AKT通路对宫颈癌细胞增殖与凋亡发挥作用,本研究通过抑制miR-92a表达后观察PTEN mRNA的表达情况,结果发现PTEN mRNA相对表达量升高,此结果与LI等[16]研究宫颈荷瘤小鼠的癌细胞转染实验结果一致。另外,本研究通过Western blotting实验发现,抑制miR-92a表达后PTEN蛋白表达量增加,p-AKT蛋白表达量降低。本研究结果表明,miR-92a可能靶向PTEN调控PI3K/AKT信号通路,miR-92a在宫颈癌中有类似癌基因的作用。随后,本课题组尝试在宫颈癌细胞中过表达miR-92a以期进一步验证其作用,但由于miR-92a过表达效果不理想,尚未得出有效的研究结果。
综上所述,抑制miR-92a的表达可抑制宫颈癌细胞的增殖,促进其凋亡。miR-92a可能通过负向调控PTEN/PI3K/AKT信号通路实现类似癌基因的作用。miR-92a有可能成为宫颈癌治疗的潜在靶点。

