超声辅助提取紫苏粕迷迭香酸工艺优化及其抗氧化能力
贾凯慧,李占君,姚远,杨逢建*
(1.森林植物生态学教育部重点实验室(东北林业大学),哈尔滨 150040; 2.黑龙江省林业科学院伊春分院,黑龙江 伊春 153000)
0 引言
紫苏(Perillafrutescens),别名白苏、荏子和赤苏等,为唇形科(Ladiatae)紫苏属(Perilla)1年生草本植物,原产于我国,主要分布在中国、不丹、印度、印度尼西亚、日本和朝鲜等,我国各地广泛栽培[1]。紫苏适应性强,对土壤要求不高,在排水较好的砂质壤土、壤土、黏土上均能良好生长,且较耐高温。茎绿色或紫色,钝四棱形,具四槽,密被长柔毛;叶对生,宽卵形或圆卵形,边缘有粗圆齿,两面呈紫色或背面一面紫色以及两面全绿色[2]。籽近球形或扁球形,种皮灰褐色,具特殊草木香味[3-4]。紫苏可供药用和香料用,入药部分以茎叶和籽实为主,叶有镇痛、镇静、解毒作用,梗有平气安胎之功,籽能镇咳、祛痰、平喘、发散精神之沉闷;叶又供食用,与肉类煮熟可增加肉类的香味[5]。
紫苏籽油是世界上α-亚麻酸含量最高的植物油之一,具有抗氧化、抗癌症和降低心血管疾病等功效,被誉为“陆地上的深海鱼油”[6]。当前,对紫苏籽油提取已有大量研究,但紫苏籽油加工过程中产生的副产物——紫苏粕常作为废物、农业肥料或动物饲料[7-8],对其研究较少。紫苏粕含有丰富的蛋白质、纤维和酚酸类等物质[9 -10],其中酚酸类物质中的迷迭香酸(Rosmarinic Acid,RosA)是有一定生理活性的天然化合物,且含量较高[11-13],具有抗氧化、清除自由基、消炎、抗血栓和抗血小板凝集等作用[14-16],抗氧化活性强于绿原酸、咖啡酸、叶酸和维生素 E等[17],因此,从紫苏粕中提取RosA具有重要意义。
超声辅助提取是在溶剂萃取法基础上发展的一种新兴萃取工艺,其利用超声波的空化效应,使分子在液体界面扩散加剧,促进细胞破碎及油脂渗出,相比水蒸气法、索氏提取法和有机溶剂萃取法等传统方法操作简单,提取高效[18]。本研究是以紫苏粕为原料,采用超声波辅助提取法从紫苏粕中提取RosA,对乙醇体积分数、料液比、超声功率、超声时间进行单因素试验,根据试验结果设计Box-Benhnken响应面优化RosA提取工艺,应用高效液相色谱法测定RosA含量,采用DPPH和ABTS+清除自由基法评价超声RosA、索氏RosA、维生素C(Vc)和水溶性维生素E(VE)体外抗氧化清除自由基能力,以期探究紫苏粕中RosA最佳提取工艺及其抗氧化能力,为紫苏粕RosA资源开发提供理论基础和参考依据。
1 材料与仪器
1.1 材料与试剂
紫苏粕,东北林业大学森林植物生态学教育部重点实验室自制;RosA标准品,HPLC级,纯度大于等于98%,上海源叶生物科技有限公司;Vc,天津市东丽区天大化学试剂厂;甲醇(湖北弗顿生化科技有限公司)和乙腈(SK生物医药科技上海有限公司)为色谱级;无水乙醇(天津富宇精细化工有限公司)、乙酸乙酯(天津富宇精细化工有限公司)等均为分析纯。
1.2 仪器
电子分析天平,型号UH620H,日本 SHIMADZU 岛津;数控超声清洗机,型号JP-100ST,深圳市洁盟清洗设备有限公司;高效液相色谱仪,型号1260,美国安捷伦公司;医用离心机,型号H1650,长沙市高新技术产业开发区湘仪离心机器有限公司。
2 试验方法
2.1 原料处理
去杂后的紫苏籽60 ℃下烘干至恒重,粉碎再次60 ℃烘干(含水量小于等于5%),采用超声辅助法提取紫苏籽油,剩余残渣即为紫苏粕,过60目筛,置于4 ℃冰箱避光保存。
2.2 供试品RosA溶液的制备及测定
2.2.1 超声辅助提取法
精准称取1.00 g紫苏粕粉末于50 mL锥形瓶中,加入50 mL 体积分数为50%的乙醇溶液,在超声功率150 W下提取35 min,随后10 000 r/min离心5 min,取2 mL上清液过0.45 μm有机滤膜,即为供试品溶液[19]。剩余供试品溶液4 ℃避光保存,作为超声RosA抗氧化性能力测定分离纯化的原料。
2.2.2 索氏提取法
精准称取1.00 g紫苏粕粉末于滤纸包中,置于提取器内,烧瓶内加入一定量体积分数为50%的乙醇溶液,加热烧瓶至溶剂沸腾,回流抽提5 h,旋蒸浓缩提取液[20],取5 mL甲醇复溶过0.45 μm有机滤膜,即为供试品溶液。剩余供试品溶液4 ℃避光保存,作为索氏RosA抗氧化性能力测定分离纯化的原料。
2.2.3 HPLC测定RosA色谱条件
Diamonsil-C18色谱柱(4.6 mm×2 590 mm×5 μm);检测波长330 nm;柱温30 ℃;流动相乙腈和0.1%磷酸水溶液体积比为2.5∶7.5;流速1.0 mL/min[21]。
2.2.4 标准曲线绘制
精称RosA标准品3.00 mg溶于1 mL甲醇中即得3 mg/mL标准母液,将母液稀释成0.5、1.0、1.5、2.0、2.5 mg/mL标准溶液。应用高效液相色谱法测定,以峰面积为y轴、质量浓度大小为x轴绘制标准曲线,并进行回归分析。最终得到RosA回归方程为y= 11.906x-103.13(R2=0.999 3),线性范围0.5~2.5 mg/mL。供试品高效液相色谱如图1所示。

图1 供试品高效液相色谱Fig.1 HPLC chromatograms of sample
2.2.5 供试品RosA得率测定
HPLC测定RosA供试品,测得峰面积代入标准曲线,由得出的RosA质量浓度计算得率,公式如下
m1=n×v;
(1)
(2)
式中:n为RosA质量浓度,mg/mL;v为样品液体总体积,mL;y为总RosA得率(%);m1为样品RosA的质量, g;m2为紫苏粕质量, g。
2.3 数据统计与处理
采用 OriginPro 2018和 Design Expert 8软件进行数据统计与处理。
2.4 RosA单因素试验
60目紫苏粕粉末1.00 g,料液比1∶50(g/mL),超声时间35 min,超声功率150 W,研究乙醇体积分数40%、50%、60%、70%、80%对RosA得率的影响。60目紫苏粕粉末1.00 g,乙醇体积分数50%,超声时间35 min,超声功率150 W,研究料液比1∶20、1∶30、1∶40、1∶50、1∶60(g/mL)对RosA得率的影响。60目紫苏粕粉末1.00 g,乙醇体积分数50%,料液比1∶50(g/mL),超声时间35 min,研究超声功率50、100、150、200、250 W 对RosA得率的影响。60目紫苏粕粉末1.00 g,乙醇体积分数50%,料液比1∶50(g/mL),超声功率150 W,研究超声时间15、25、35、45、55 min 对RosA得率的影响。
根据单因素试验结果,选择料液比(A)、超声功率(B)、超声时间(C)3个自变量,设计三因素三水平Box-Behnken Design优化试验,以RosA得率为响应值,响应面因素水平见表1。
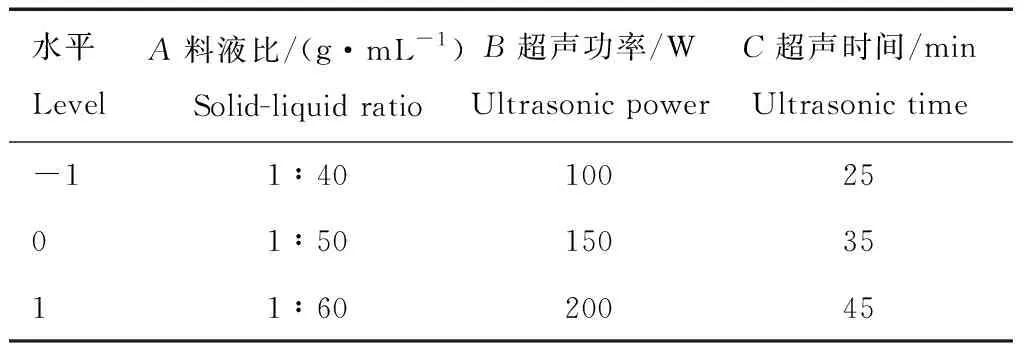
表1 响应面因素水平Tab.1 The factors and levels of response surface
2.5 RosA抗氧化能力测定
2.5.1 RosA的分离纯化
参考张春艳[22]研究方法超声RosA提取液和索氏RosA提取液,以每小时2个柱体积的速度通过大孔树脂吸附柱,吸附饱和后用蒸馏水洗脱除去杂质,接着以体积分数80%乙醇为洗脱剂解吸得到洗脱液,最后将洗脱液真空浓缩、冷冻干燥获得纯度较高的超声RosA和索氏RosA产品。纯化后4 ℃冰箱避光保存,用于DPPH和ABTS+清除能力测定。
2.5.2 RosA的DPPH清除能力测定
参考訾玉祥等[23]研究方法并稍加修改,采用无水乙醇准确配制1 mmol/L的DHHP溶液,4 ℃冰箱黑暗保存。分别配制5组不同质量浓度的超声RosA、索氏RosA、Vc和VE溶液。取1 mL测试样品和1 mL DPPH溶液置于同一试管中,室温下暗反应30 min后,在518 nm波长处测定吸光度(A),按照相同条件,测定1 mL样品溶液和1 mL无水乙醇溶液混合的吸光度(A1),以及1 mL DPPH溶液和1 mL无水乙醇溶液混合的吸光度(A2)。试验重复3次,取平均值。DPPH自由基清除率计算公式为
(3)
2.5.3 RosA的ABTS+清除能力测定
参考刘红文等[24]研究方法并稍加调整,配制7.4 mmol/mL ABTS+自由基溶液和2.6 mmol/mL过硫酸钾溶液,按体积比1∶1混合后黑暗环境反应12 h。用PBS缓冲液稀释30~60倍,在734 nm波长处测定吸光度为0.7±0.02,该溶液为ABTS+工作液。分别配制5组不同质量浓度的超声RosA、索氏RosA、Vc和VE溶液。取 0.3 mL测试样品和2.7 mL ABTS+工作液置于同一试管中,室温下暗反应30 min后,在734 nm波长处测定吸光度(A),按照相同条件,测定2.7 mL ABTS+工作液和0.3 mL 95%乙醇溶液混合的吸光度(A2)。试验重复3次,取平均值。ABTS+自由基清除率计算公式为

(4)
3 结果与分析
3.1 单因素试验结果分析
3.1.1 乙醇体积分数对RosA得率的影响
由图2可知,随着乙醇体积分数不断增加,RosA得率呈先增大后降低的趋势,当乙醇体积分数为40%~50%时RosA得率增长较快,50%时得率最大为7.91%±0.162%,这是因为RosA化合物与50%乙醇的极性相似,有利于RosA化合物溶出,当乙醇体积分数超过50%,溶液体系渗透压增大,RosA得率反而降低;此外,易与有机溶剂结合的其他化合物如脂类或醇类等物质溶出,也导致RosA分子相对含量降低。因此,选择体积分数50%乙醇作为提取溶剂[25-26]。

图2 不同乙醇体积分数对RosA得率的影响Fig.2 Effect of different ethanol volume fraction on RosA yield
3.1.2 料液比对RosA得率的影响
由图3可知,随着料液比不断增加,RosA得率呈先升高后降低的趋势,当液料比为1∶20~1∶50(g/mL)时RosA得率逐步上升,最大值为7.87%±0.103%,这是因为随着溶剂量增加,紫苏粕粉末与溶剂接触更充分,增大RosA分子的扩散速度;但料液比超过1∶50(g/mL)后,由于RosA分子与溶剂融合度已达到峰值,易溶于乙醇溶液的其他化合物溶出量不断增加,导致RosA得率相对减少。考虑到RosA得率工业造价,选择料液比1∶40~1∶60(g/mL)这一区间进行优化[25]。

图3 不同料液比对RosA得率的影响Fig.3 Effect of different solid-liquid ratio on RosA yield
3.1.3 超声功率对RosA得率的影响
由图4可知,随着超声功率不断增大,RosA得率呈先增大后平缓的趋势,当超声功率为50~100 W时RosA得率显著升高,其原因是功率增大,紫苏粕粉末吸收的超声波能增加,细胞内传质阻力减小,使得 RosA更容易溢出;当超声功率为150~250 W时RosA得率趋于稳定,其原因是功率过大,溶剂温度上升,紫苏粕内部结构固化,进而影响RosA得率。综合考虑,选择超声功率100~200 W这一区间进行优化。

图4 不同超声功率对RosA得率的影响Fig.4 Effect of different ultrasonic power on RosA yield
3.1.4 超声时间对RosA得率的影响
由图5可知,随着超声时间不断增加,RosA得率呈先升高后下降最终平稳的趋势,当超声时间为15~35 min时RosA得率逐渐升高,其原因是随着超声时间增加,超声波破坏细胞壁及内部结构更加充分,RosA化合物能够最大限度从细胞中渗透出来;但超声时间超过35 min 后,由于长时间的机械振动和空化作用会破坏RosA化合物结构使其他非RosA类物质溶出,RosA得率下降。综合考虑,选择超声时间25~45 min这一区间进行优化。

图5 不同超声时间对RosA得率的影响Fig.5 Effect of different ultrasonic time on RosA yield
3.2 响应面优化提取工艺
3.2.1 模型建立与显著性检验
根据单因素试验结果设计Box-Benhnken响应面优化RosA提取工艺,对表 2 试验数据进行多元回归拟合,可得回归方程为
Y=7.48+0.048A+0.15B+0.11C+0.11AB+0.23AC+0.050BC-0.38A2-0.23B2-0.39C2。

表 2 中心组合优化试验
对回归方程进行方差分析,由表3可知,模型F=53.23,P<0.01,说明模型差异极显著,具有统计学意义,失拟项F=5.05,P=0.075 8>0.05,表明差异不显著,无失拟因素存在,模型拟合度良好,可通过该模型确定最佳提取工艺。单因素料液比(A)P=0.087 3>0.05,说明料液比对RosA得率无显著性影响,超声功率(B)P=0.000 4<0.01和超声时间(C)P=0.002 1<0.01,说明超声功率和超声时间对RosA得率具有极显著性影响,且由F大小可知B>C,说明超声时间对RosA得率影响更大。在组合因素中,AB和AC的P均小于0.05且AB的P小于0.01,说明AB和AC交互作用较强,这2个组合因素对RosA得率影响显著,只有BC的P大于0.05,说明该组合因素对RosA得率影响不显著。二次项A2、B2、C2三者P均小于0.01,说明其对RosA得率均具有极显著性影响。

表3 响应面拟合回归方程的方差分析结果Tab.3 Response surface fitting regression equation results of variance analysis

续表3
由表4可知,拟合优化模型的预测复相关系数(Pred.R2= 0.985 6>0.8)和调整系数(Adj.R2=0.967 1>0.8)几乎是一致,且综合决定系数(Com.R2)为 0.813 0,表明该模型拟合度较高,模型准确度与变异系数(Coefficient of Variation,CV)有关,CV越小准确度越高,说明本研究设计方案对紫苏粕RosA进行优化可行。

表4 回归方程的可信度分析Tab.4 Reliability analysis of regression equation
3.2.2 因素交互影响及等高线分析
响应面可反映2个因素之间的交互作用,响应面底部的等高线图和3D图可直观反映交互作用的显著性,3D图坡度越陡,表明交互作用越明显。由图6和图7可知,底部投影近圆形,表明料液比与超声功率以及料液比与超声时间之间交互作用较显著,随着超声功率、料液比和超声时间增加,RosA得率呈先增大后减小的趋势,在料液比约1∶50(g/mL)、超声时间约35 min和超声功率约 150 W时RosA得率最大,之后RosA得率逐步降低。由图8可知,底部投影呈椭圆形,表明超声功率与超声时间之间交互作用较弱;超声时间30~45 min时RosA得率逐渐上升,表明此时间段在超声功率作用下对RosA得率影响较大;45 min之后坡度变缓,表明此时间段在超声功率作用下对RosA得率影响较小。

图6 料液比与超声功率的交互性影响Fig.6 Interactive effect of solid - liquid ratio and ultrasonic power

图7 料液比与超声时间的交互性影响Fig.7 Interactive effect of solid- liquid ratio and ultrasonic time
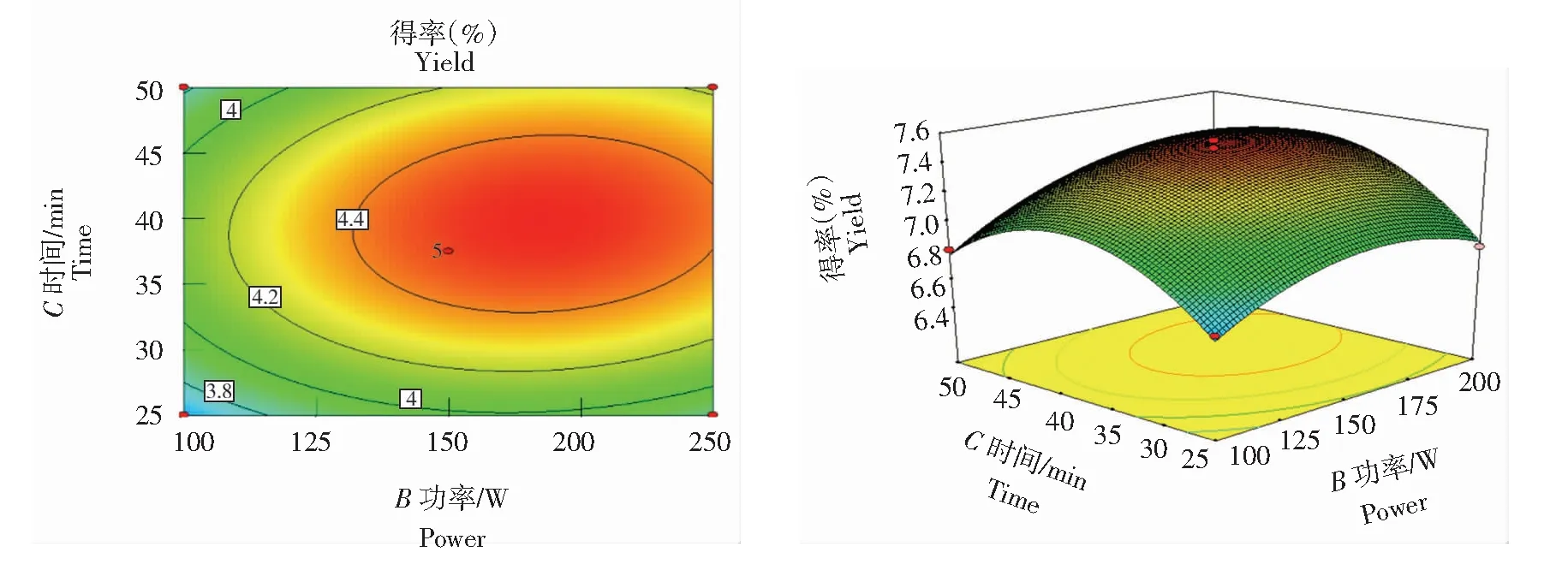
图8 超声功率与超声时间的交互性影响Fig.8 Interactive effect of ultrasonic power and ultrasonic time
3.2.3 优化提取参数和验证试验
通过回归模型分析可知,最佳提取工艺参数为乙醇体积分数50%、料液比1∶51.94(g/mL)、超声功率170 W、超声时间38.97 min,该条件下理论RosA得率为7.53%。考虑到实际操作,确定RosA最佳提取工艺为乙醇体积分数50%、料液比1∶50(g/mL)、超声功率150 W、超声时间35 min。取1.00 g紫苏粕粉末按最佳提取工艺进行3次验证试验,平均RosA得率为7.41%±0.09%,与理论推测值7.53%无显著差异。
3.2.4 工艺对比
对比表5中2组数据可知,超声辅助提取的RosA得率略高于索氏提取,超声辅助提取耗时短、效率高,相比索氏提取更具有优势。

表5 超声辅助与索氏提取对比Tab.5 Comparison of ultrasonic assisted and Soxhlet extraction
3.3 RosA抗氧化能力
3.3.1 RosA的DPPH自由基清除能力
由图9可知,随着溶液质量浓度增加,清除DPPH自由基能力也随之增加,呈现出良好的线性关系。同一质量浓度下,超声RosA、索氏RosA、Vc和VE清除DPPH自由基能力由强到弱顺序为:Vc、超声RosA、索氏RosA、VE。质量浓度为0~40 μg/mL四者清除率变化较大,之后随着溶液质量浓度增加,清除率增加缓慢。质量浓度100 μg/mL时,超声RosA、索氏RosA、Vc和VE的清除率分别为76.5%、68.6%、80.1%和67.2%。

图9 RosA的DPPH自由基清除率Fig.9 Clearance rate of DPPH radical by RosA
3.3.2 RosA的ABTS+自由基清除能力
由图10可知,随着溶液质量浓度增加,Vc、超声RosA和索氏RosA的清除能力呈先升高后稳定的趋势,VE的清除能力持续升高。同一质量浓度下,清除ABTS+自由基能力由强到弱顺序为:Vc、超声RosA、索氏RosA、VE。质量浓度为0~60 μg/mL四者清除率均呈增加趋势,其中Vc、超声RosA和索氏RosA清除率增加较快,清除效果较好。质量浓度为40~100 μg/mL,超声RosA和Vc清除ABTS+自由基能力趋于稳定,索氏RosA和VE的清除能力依然呈上升趋势。质量浓度100 μg/mL时,超声RosA、Vc、VE和索氏RosA的清除率分别为88.58%、90.13%、79.55%和86.92%。
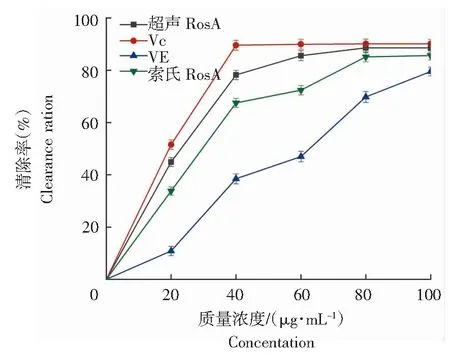
图10 RosA的ABTS+自由基清除率Fig.10 Clearance rate of ABTS+ radical by RosA
4 结论与讨论
为探究紫苏粕中迷迭香酸RosA的最佳提取工艺及其抗氧化能力,为紫苏粕RosA资源开发提供理论基础和参考依据,本研究采用超声辅助提取法提取RosA,对乙醇体积分数、料液比、超声功率、超声时间进行单因素试验,根据试验结果设计Box-Benhnken响应面优化RosA提取工艺,应用高效液相色谱法测定RosA含量,采用DPPH和ABTS+清除自由基法评价超声RosA、索氏RosA、维生素C(Vc)和水溶性维生素E(VE)体外抗氧化清除自由基能力。结果发现,响应面法在RosA提取优化方面具有较好可行性和预见性。RosA最佳提取工艺为乙醇体积分数50%、料液比1∶50(g/mL)、超声功率150 W、超声时间35 min,该条件下进行3次验证试验,平均RosA得率为7.41%±0.09%,与理论推测值7.53%相差较小,表明试验结果吻合,与梅喜刚等[27]提取紫苏粕RosA得率为(0.542±0.02) mg/g结果相似。以清除DPPH自由基和ABTS+自由基为评价体系,比较Vc、超声RosA、索氏RosA和VE的抗氧化性发现其由高到低顺序为:Vc、超声RosA、索氏RosA、VE,索氏高温提取对RosA结构造成损害,抗氧化作用下降。RosA可作为天然抗氧化剂使用,在食品、化妆品和医疗抗氧化方面具有一定应用价值。

