松嫩平原植被演替对土壤微生物的影响
李琳,杜倩,刘铁男,王琪瑶,梁素钰,田松岩,柳参奎
(1.黑龙江省生态研究所森林生态与林业生态工程重点实验室,哈尔滨 150081;2.浙江农林大学亚热带森林重点实验室,杭州 311300)
0 引言
土壤是地球系统的重要组成部分,土壤微生物是土壤中最活跃的组分,其多样性和活性是土壤生态系统健康稳定的基础。土壤微生物不仅受地表植被影响,而且还通过自身变化对植被做出反应,形成与植被相互作用的反馈系统[1-3]。黄河三角洲地区盐生植被演替过程中,土壤微生物代谢活性、功能多样性以及土壤环境显著优化[4-5],微生物群落结构同样对植被演替有一定响应[6-7]。同时,土壤微生物也反作用于植物,如石油污染盐碱地土壤分离的克雷伯氏菌属(Klebsiellasp.)菌株能够促进高羊茅(Festucaelata)植被生长[8]。由此可见,盐碱地植被演替过程中土壤微生物可能发挥了一定作用,研究盐碱地土壤微生物群落功能多样性对盐碱地退化生态系统恢复具有科学意义。
松嫩平原盐碱地是世界三大苏打盐碱地分布区域之一[9],是我国次生盐渍化最严重的地区[10],土壤阴离子以碳酸根、碳酸氢根为主,土壤pH较高,在严重盐碱地分布中碱性斑块(pH>10)伸展较长且不间断[11-12]。柳参奎等[13]利用微客土技术对安达地区盐碱地进行恢复,15 a从碱斑逐步恢复到羊草(Aneurolepidiumchinense)顶级群落,并伴生蒙古柳(Salixlinearistipularis)、直穗粉花地榆(Sanguisorbagrandiflora)等灌木,为研究松嫩平原苏打盐碱地土壤微生物多样性与植被演替关系提供了很好的研究基础。本研究采用Biolog Eco微平板法,对松嫩平原盐碱地自然演替序列和人工恢复后不同植被土壤微生物群落代谢水平(Community-Level Physiological Profiles,CLPP)及微生物功能多样性指数进行分析,并结合土壤理化性状进行相关性研究,探寻松嫩平原苏打盐碱地土壤微生物功能多样性随植被演替的变化规律,以期为盐碱地植被演替研究提供重要参考依据,为松嫩平原生态恢复和利用提供理论基础和技术支持。
1 研究区概况与材料、方法
1.1 研究区概况
研究区位于安达实验基地(46°27′N,125°22′E)和肇东实验林场(46°20′N,125°36′E),地处松嫩平原腹地,以温带大陆性季风气候为主,年均气温4.2 ℃,年均降水量400~650 mm,其中80%~90%发生在生长期(5—9月)。土壤为典型的富含碳酸盐和碳酸氢盐的钙黑土,pH较高。自然状态下,植被演替过程为碱斑(Alkaline Patches)→碱蓬(Suaedakomarovii)+星星草(Puccinelliatenuiflora)→碱蓬+星星草+伴生种→羊草+伴生种→羊草,如图1所示。

Ap,碱斑; Sk,碱蓬; Pt,星星草; Ac,羊草。
1.2 土壤样品采集与保存
依据《森林生态系统长期研究观测方法》(GB/T 33027—2016)采集土壤样品,样地植被信息见表1。碱斑及人工林样地内“S”形选取9点,土钻采集0~20 cm土壤,去除植物根系和大块杂质,每3个取样点样品混合为1个土壤样品。草本植物群落样地内随机选取9个20 cm×20 cm样方,样方内全部植被连根挖出,抖落大块疏松土壤,将附着于根部的土壤用毛刷收集到无菌自封袋内,每3个样方土壤混合为1个土壤样品。土壤样品置于冰盒中带回实验室过2 mm筛除根系、石块等杂质,均分为2份,一份于4 ℃冰箱内保存,1周内进行微生物群落代谢水平测定;一份于通风处阴干,用于土壤理化性质测定。

表1 样地植被信息
1.3 土壤理化性质测定

1.4 土壤微生物群落代谢水平测定
采用Biolog Eco微平板(Biolog,美国)对不同植被土壤微生物群落代谢水平进行分析。称取相当于10 g烘干土质量的新鲜土壤样品,加入90 mL无菌磷酸盐缓冲液(10 mmol/L,pH7.0)于三角瓶内,250 r/min震荡30 min,吸取上清液,按10倍稀释法稀释至10-3,吸取150 μL接种到Biolog Eco微平板上,28 ℃培养10 d,每24 h用酶标仪(Molecular Devices,美国)测定590 nm和750 nm波长下的吸光度。
每孔平均吸光度(Average Well Color Development,AWCD,公式中用AWCD表示)代表微生物群落代谢水平,可反映利用不同碳源的土壤微生物总体情况[14],计算公式为
AWCD=∑(Ci-R)/n。
(1)
式中:Ci为第i孔吸光度差值(OD590—OD750);R为对照孔吸光度;n为碳源数(31)。
基于吸光度数据计算Shannon多样性指数(H)、Shannon 丰富度指数(E)、Simpson优势度指数(D) 和 McIntosh 指数(U),其可代表微生物群落功能多样性[15-16],计算公式为
H=-∑Pi/lnPi;
(2)
E=H/Hmax=H/lnS;
(3)
D=1-∑P2i;
(4)
(5)
式中:Pi为第i孔相对吸光度与整个平板相对吸光度的比值;S为每孔中相对吸光度大于0.2的孔数;ni为第i孔的相对吸光度。
1.5 数据分析
选取96 h Biolog Eco微平板获取的数据进行多样性指数、碳源代谢水平及相关性分析,这一微生物代谢最活跃的时期为对数生长期[17]。AWCD、多样性指数采用基于Microsoft Excel VBA的自动化程序A-BEP-DSAS计算[18]。碳源代谢水平使用R软件pheatmap包进行。为分析不同环境因子与碳源代谢水平的相关性,采用CANOCO 4.5进行冗余分析(Leps and Smilauer 2003)。应用单因素(ANOVA) 和Tukey's法进行方差分析和多重比较,利用Pearson相关系数对土壤理化性质与土壤微生物群落功能多样性进行相关分析。运用Excel 2010软件作图,图表中数据为平均值±标准差。
2 结果与分析
2.1 土壤理化性质分析
盐碱地不同演替阶段土壤理化性质见表2。碱斑-强耐盐碱植物(碱蓬、星星草)-轻耐盐碱植物(羊草)自然演替序列下(N1→N5),土壤密度、总含盐量和pH呈下降趋势,土壤肥力指标和土壤碳特性呈升高趋势。人工恢复后,土壤密度、总含盐量、pH由大到小顺序为:草本植物群落(RV1、RV2)、灌草植物群落(RV3—RV7)、人工林植物群落(RV8—RV12),土壤肥力指标和土壤碳特性由大到小顺序为:灌草植物群落(RV3—RV7)、人工林植物群落(RV8—RV12)、草本植物群落(RV1、RV2)。

表2 不同植物群落土壤理化性质Tab.2 Soil physical and chemical properties of different phytocoenosium (mean±SD)
2.2 土壤微生物群落碳源利用特征
Biolog Eco微孔板每孔平均吸光度(AWCD)可表明自然演替阶段和不同恢复阶段土壤微生物群落碳源利用情况。由图2可知,各样品每孔平均吸光度曲线在240 h内呈“S”形增长,24~96 h样品微生物呈快速增长趋势,草本及灌草群落在96 h后增长趋势逐步趋于平缓,乔木群落在168 h后增长趋势趋于平缓。自然演替过程中图2(a),碱斑(N1)土壤微生物碳源利用几乎无增长,高耐盐植物群落(N2、N3)土壤微生物碳源利用显著(P<0.05)低于低耐盐植物群落(N5、N6)。客土技术恢复后植物群落AWCD曲线图2(b)显示,草本群落(RV1、RV2)与自然演替序列高耐盐植物(N2、N3、N4)土壤微生物群落碳源利用趋势相同,显著(P<0.05)低于灌草群落(RV3—RV7)土壤微生物群落,客土恢复后灌草群落土壤微生物群落碳源利用趋势与自然演替下羊草群落(N5、N6)相似。人工林群落图2(c)土壤微生物AWCD曲线对数增长期较长,从24 h持续到168 h。
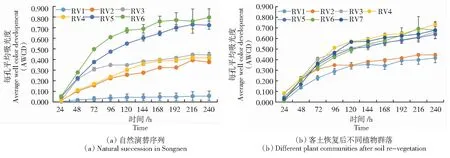
(c) 人工林恢复后不同林型
进一步分析不同演替阶段土壤微生物对6类碳源的利用情况,由图3可知,各样品中微生物群落分布明显不同。自然演替序列下,碱斑土壤样品中利用氨基酸类碳源微生物的活性显著高于其他类型碳源,利用羧酸类、胺类和酚类碳源微生物的活性极低。客土恢复及人工林种植后,土壤微生物群落利用碳源根据植物群落不同具有各自特性。

图3 不同演替阶段土壤微生物群落对6种碳源的相对利用率Fig.3 Relative utilization rate of soil microbial community to six types of carbon sources under different re-vegetation stages
2.3 土壤微生物群落功能多样性指数分析
根据96 h AWCD计算土壤微生物Shannon物种丰富度指数、Simpson优势度指数和McIntosh物种均匀度指数,反映样品土壤微生物群落功能多样性,由表3和表4可知,不同演替阶段土壤微生物功能多样性指标存在差异。Shannon指数表明碳源利用数量,自然演替序列下表现为轻度耐盐碱植被高于重度耐盐碱植被、高于碱斑土壤,植被恢复后也表现相同趋势,由大到小为:乔木群落、灌木-草本群落、草本群落,但乔木与灌草群落之间差异不显著(P>0.05)。不同演替阶段及恢复后的Simpson优势度指数表明部分优势菌生长随植被演替进行而增加,但差异不显著(P>0.05)。McIntosh指数则表明土壤微生物在碳源数量和利用程度上的差异,由大到小顺序为:灌木-草本群落、草本群落、乔木群落。

表3 土壤微生物群落功能多样性指数Tab.3 Functional diversity indices of soil microbial communities

表4 平均吸光度值、土壤微生物多样性指数与土壤理化性质相关性相关系数Tab.4 Correlation coefficients between AWCD, soil microbial diversity indices and physicochemical properties
相关分析结果(表4)表明,AWCD 与全氮、全磷、有机质、总有机碳、微生物生物量碳和含水率呈极显著正相关(P<0.01),与土壤密度、pH和土壤盐度呈极显著负相关(P<0.01)。土壤密度、pH和土壤盐度与3种多样性指数呈极显著负相关(P<0.01),而与有机质、全氮和有机碳含量呈极显著正相关(P<0.01)。
2.4 不同演替阶段土壤微生物功能多样性冗余分析(RDA)
采用冗余分析(RDA)探讨环境因素对土壤微生物碳源利用的影响,由图4可知,第一轴和第二轴分别占方差的 45.6%和 6.2%。环境因子即土壤理化性质用箭头表示,箭头之间的夹角代表相关性,夹角越小,相关性越高。土壤肥力指标及土壤碳特征之间呈正相关,与土壤密度、土壤含盐量和土壤pH呈负相关。土壤肥力指标及土壤碳特征与微生物碳源代谢呈正相关,其中对土壤氨基酸类、多聚物类、酚类及胺类碳源利用影响相对较大。样方之间的距离代表样方之间的相异程度,样方点到环境因子的投影点,可以表示该环境因子的值在样方内的情况。自然演替序列与客土恢复后草本(RV1、RV2)与其他植物群落碳源利用上存在一定差异,而客土恢复后蒙古柳(RV7)群落具有其特异的碳源利用方式。
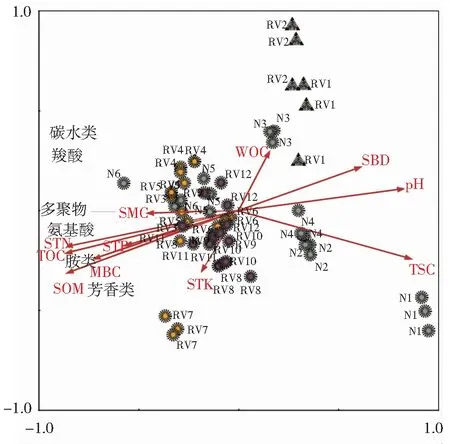
SBD,密度; TSC,土壤总含盐量; pH,土壤pH; SMC,土壤含水率; SOM,土壤有机质含量;STN,土壤总氮含量; STP,土壤总磷含量; STK,土壤总钾含量;TOC,土壤总有机碳含量; WOC,土壤水溶性有机碳含量; MBC,土壤微生物生物量碳含量。
3 结论与讨论
土壤微生物是土壤有机质以及养分转化和循环的动力,参与到土壤生态系统的各个环节,不仅直接影响土壤理化性质,也间接影响植物生长[19-20]。杜滢鑫等[21]对石油污染盐碱地9种不同植物根际土壤微生物结构和功能的多样性进行分析,结果表明不同植物根际土壤细菌群落对底物碳源的代谢特征存在着一定差异。杨赛等[22]对东北苏打盐碱土植被演替下的土壤微生物进行高通量测序,获得377属细菌、169属真菌。裴振等[23]探讨了黄河三角洲地区土壤微生物碳源代谢水平与盐生植被演替的关系。本研究利用Biolog Eco微平板技术对松嫩平原盐渍土壤植被演替与土壤微生物功能多样性的关系进行探讨,为松嫩平原盐碱地植被演替下的土壤微生物群落研究提供了更加丰富的数据。
松嫩平原盐渍土壤自然演替序列下,随着植被从碱斑土壤向顶级羊草群落演替,微生物利用碳源种类有所增加。碱斑土壤对各种碳源的利用极低,强耐碱植被碱蓬为典型1年生聚盐植物,植被死亡后储存在植物内的盐分归还于土壤,导致其根际土壤pH有时会高于碱斑土壤(表2),因此土壤微生物群落碳源利用与同是强耐碱植被星星草存在很大差异,其中星星草土壤微生物对肝糖(Glycogen,C5)的利用显著高于碱蓬。羊草群落利用酚类(丙酮酸甲脂、D-甘露醇、N-乙酰基-D-葡萄胺)及多聚物类(吐温40、吐温80)碳源的能力高于碱蓬群落,尤其是肝糖的利用随着植被演替呈现出增强趋势。由客土恢复及人工林种植后不同植物群落对碳源的利用情况可知,植被从草本演替到灌草群落,微生物利用碳源能力有所增加,而向木本植物演替过程中,微生物利用碳源能力降低,微生物多样性并没有显著增加,而微生物的均匀度也有所下降(表3)。造成这一现象的原因可能是木本植物生长受土壤理化性质的影响更大,盐渍土壤上种植树木虽然能够存活,但是生长缓慢,凋落物及细根周转受限,从而影响土壤有机质、土壤全氮、全磷含量,因此木本植物群落的微生物群落多样性及碳源利用能力要低于灌草群落。这一结果说明,土壤有机质、全氮、pH是引起微生物碳源代谢发生分异的重要因素[24-26]。
植物群落与土壤微生物多样性之间存在相互作用。裴振等[23]研究表明土壤微生物群落多样性指数随着盐生植被演替显著增加,土壤微生物群落趋于更加稳定的系统,许多研究也发现不同植物群落下土壤微生物种类的差异性[27-28]。不同植被根际向土壤中释放的分泌物及凋落物组成不同,对偏好性微生物进行富集,导致了微生物群落差异性,从而影响微生物对碳源的利用。自然演替序列下,碱斑土壤微生物主要利用多聚物、氨基酸及糖类碳源,对酚类、胺类及羧酸类碳源利用极低,随着演替进行,微生物利用碳源种类更加丰富,利用碳源数量增多,但不同植物群落对碳源的利用存在一定偏好性。
综上,随着演替进行,土壤微生物AWCD显著增加(P<0.05),微生物利用碳源种类有所增加,客土技术恢复后草本及灌草植物群落土壤微生物利用碳源数量最多,而人工林植物群落利用碳源数量反而降低。不同植物群落下土壤微生物AWCD、Shannon指数、Simpson指数和McIntosh指数与土壤有机质、全氮呈极显著正相关(P<0.01),与土壤密度、pH和总盐含量呈极显著负相关(P<0.01)。

