耐寒美国红枫‘秋火焰’离体培养技术研究
杨一鹏,刘芳,杨凤军,张文博,于红,李佶憓,杨春辉,杨菲红
(黑龙江八一农垦大学 园艺园林学院,黑龙江 大庆 163319)
0 引言
美国红枫(AcerrubrumL.)属槭树科槭树属多年生落叶乔木[1]。其树体高大,适应性广[2],生长速度快,抗寒、耐旱、防潮,在2000年后被引入中国,目前已发展成为最普遍的绿化树种之一。当前,对美国红枫的研究主要集中在群落中重要度[3]及其在自然界中的生长和死亡率[4],关于红枫扦插从头根再生(DNRR)机制[5]、开花、结果、坐果特性[6]以及用不同方法进行栽培品种的鉴定[7]等方面也有深入研究。
美国红枫在组织培养时外植体的类型选择多种多样。杨林星[8]以自由人槭‘秋焰’(Acer×freemanii‘Autumn Blaze’)当年生枝茎段和休眠芽为外植体;闫洋洋[9]以美国红枫‘十月辉煌’(Acerrubrum‘October Glory’)的嫩枝茎段和叶片为外植体;李源等[10]以美国红枫‘白兰地’(Acerrubrum‘Brandywine’)带腋芽茎段为外植体。取材时间以3—6月为宜。在培养基选择方面,目前美国红枫组织培养中常用的基本培养基以WPM、MS、1/2 MS为主。在继代增殖方面,激素多采用2,4-D(2,4-dichlorophenoxyacetic acid,二氯苯氧乙酸)、TDZ(thidiazuron,噻苯隆)和GA3(gibberellic acid,赤霉素);在生根培养方面,一般采用IBA(3-indolebutyric acid,吲哚丁酸)、IAA(indole-3-acetic acid,吲哚乙酸)和NAA(α-naphthalene acetic acid,α-萘乙酸)均可获得较好的生根效果,例如,美国红枫‘十月辉煌’采用0.3 mg/L IBA进行生根,‘中国红’红枫采用0.25 mg/L IBA进行生根。在培养环境方面,碳源、光照和pH等环境因素也是影响美国红枫组织培养的重要变量。大多数美国红枫组培中以蔗糖作为碳源,选择质量浓度为3%~3.5%。光照强度与光照时间是限制离体快繁的关键因素之一,如美国红枫‘白兰地’在光照强度为1 600~2 000 lx的条件下培养生长更好。大多数美国红枫组培中选择pH为5.6~5.8[11]。
近年来,彩叶树种市场需求扩大,而耐寒的彩叶树种品种较少,为了培育适合东北地区的彩色叶树种,该研究以耐寒美国红枫‘秋火焰’(Acerrubrum‘Autumn Blaze’)为研究对象,以腋芽茎段为外植体,调配出最佳消毒方式,并研究了美国红枫培养基配方的最优组合,旨在建立比较完整的耐寒美国红枫组织培养与快繁技术体系,以期为美国红枫组培种苗工厂化生产提供技术支持,并为园林绿化提供大量优质彩色叶苗木,以提升园林景观设计质量,也为美国红枫组织培养的进一步研究提供理论依据。
1 材料与方法
1.1 试验材料及外植体预处理
材料选用黑龙江大庆市油田乐园2016年引种驯化的美国红枫‘秋火焰’,采集其新生枝条的带芽茎段。先用软毛刷蘸洗洁精刷洗5 min,再用流水冲洗30 min;将冲洗完毕的茎段放入无菌瓶中并移至超净工作台备用。
1.2 初代培养
材料预处理后,在超净工作台上用消毒剂对外植体消毒。试验采用3种消毒剂进行消毒并在培养基中添加抑菌剂:5% NaClO(5、8、10 min)、0.1% HgCl2(0、3、6 min)和75%酒精(30 s),共设计9种组合。以改良MS+6-BA 1.0 mg/L+IBA 0.2 mg/L+20 mg/L益培灵为培养基,处理后的茎段外植体竖直插入培养基中进行初代培养。每个处理接种 30 瓶,每瓶1个外植体,重复3次。接种后,观察30 d内外植体的污染情况和存活情况。
1.3 继代增殖培养
取生长健壮、长势均等的初代培养组培苗进行继代增殖培养,剪取带顶芽的茎段,每个茎段约3个节间,高3 cm,将处理后的茎段外植体竖直插于继代增殖培养基中。以改良MS为基本培养基,添加不同质量浓度的CPPU(forchior fennron,氯吡苯脲)(0.2、0.4、0.6 mg/L)、6-BA(6-benzylaminopurine,6-咔氨基嘌呤)(0.05、0.1、0.2 mg/L)、IBA(0.1、0.5、1.0 mg/L)3种植物生长调节剂,设计9种处理组合,采用L9(34)正交表安排试验。每个处理接种10瓶,每瓶3个外植体,重复3次,40 d后统计增殖系数及生长情况。
1.4 壮苗培养
将多次继代的美国红枫组培苗接种在上述改良MS培养基中,分别添加不同质量浓度的ZT(zeatin,玉米素)(0.5、1.0、1.5 mg/L)和IBA(0.1、0.3、0.5 mg/L)。共设计9种组合。培养40 d观察植株生长情况。
1.5 生根培养
以1/2MS为基本培养基,分别添加不同质量浓度的GA3(0、1 mg/L)和NAA(0.1、0.2、0.5 mg/L)。共设计6种组合。培养40 d观察植株生根情况。
1.6 数据分析
试验结果的基础数据用Microsoft Office Excel 2019统计汇总后,利用SPSS 26.0统计分析软件对数据进行多重对比和方差分析。
2 结果与分析
2.1 不同消毒处理对外植体的影响
培养基中添加20 mg/L益培灵,不同消毒处理对外植体存活率的影响见表1。由表1可见,HgCl2和 NaClO处理时间不同时,不同处理间外植体的死亡率、污染率和存活率有显著差异。随着NaClO消毒时间的延长,污染率逐渐降低,存活率先上升后下降,且消毒8 min时存活率最高;随着HgCl2消毒时间延长,污染率降低,存活率上升。因此,由表1可直观得出最佳的处理组合为:5% NaClO(8 min)+0.1% HgCl2(6 min),消毒效果最明显,平均污染率为33.15%,平均存活率为60.98%,死亡率为5.87%。因此。处理6最适合美国红枫带芽茎段生长。
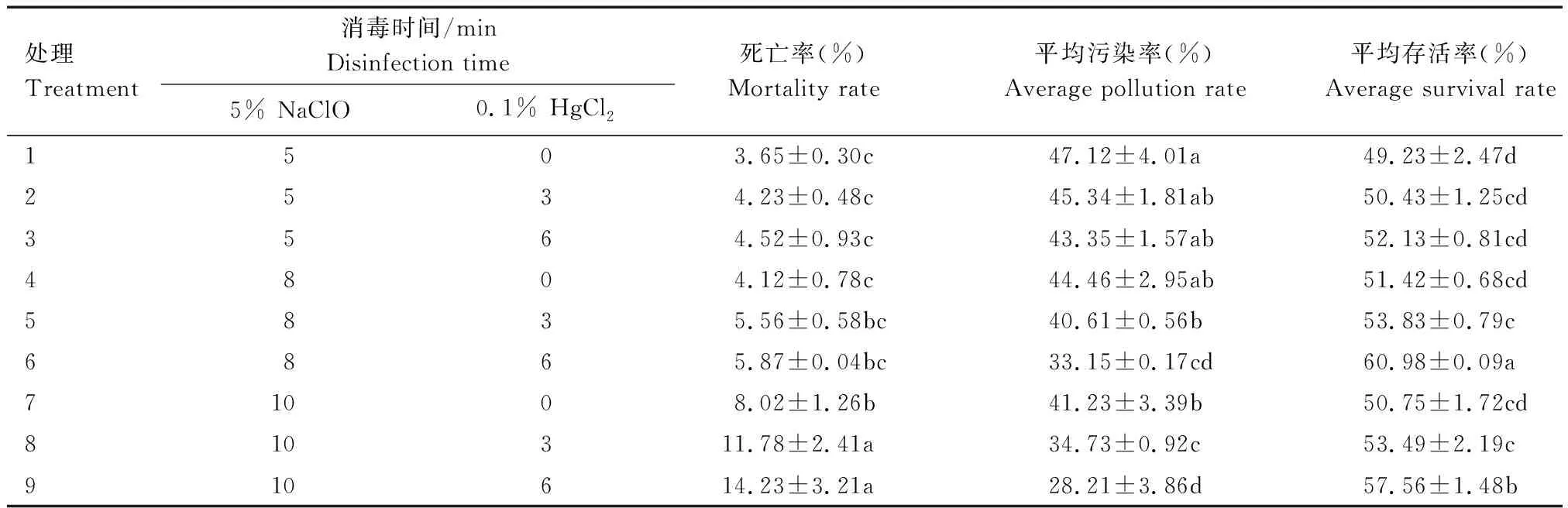
表1 不同消毒时间对外植体污染率及存活率的影响
由表2可见,除了5% NaClO和0.1% HgCl2消毒对平均成活率有显著影响,5%NaClO和0.1%HgCl2消毒处理的交互作用也有显著影响(P<0.05,下同)。处理6与单独采用5% NaClO和单独采用升汞消毒处理相比,平均存活率分别升高了23.69%和18.59%,平均污染率分别降低了29.64%和25.43%。但当5% NaClO消毒时间继续增加时,平均存活率有下降的趋势。双因素方差分析结果表明,5% NaClO、0.1% HgCl2以及5% NaClO和0.1% HgCl2消毒处理的交互作用对平均存活率有显著影响,因此,最佳消毒处理组合:5% NaClO(8 min)+0.1% HgCl2处理(6 min)时平均存活率最高,适合红枫组培苗生长。

表2 不同消毒处理双因素方差分析结果
2.2 不同植物生长调节剂对红枫组培苗继代增殖的影响
以改良MS为基本培养基,添加不同质量浓度的CPPU、6-BA、IBA植物生长调节剂,正交试验结果见表3。

表3 不同植物生长调节剂对组培苗继代增殖的影响Tab.3 Effects of different plant growth regulators on subculture proliferation of tissue culture seedlings
由表4可见,因素A(CPPU)中,K2>K3>K1;因素B(IBA)中,K2>K3>K1;因素C(6-BA)中,K1>K2>K3。表3中CPPU、IBA、6-BA 3种激素的R分别为3.28、0.33、0.61,由此可以看出,在本次实验中,CPPU的影响最大,6-BA的影响次之,而影响因素最小的是IBA。
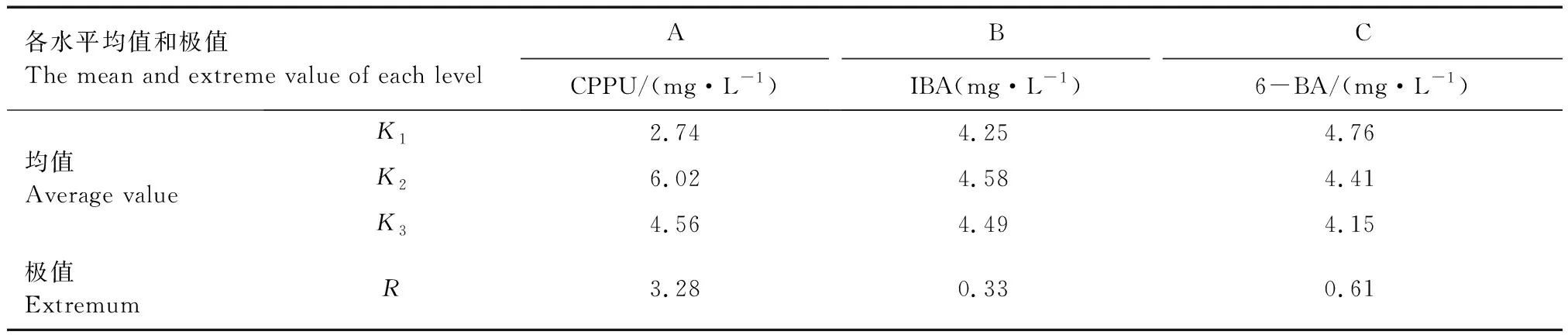
表4 不同植物生长调节剂各水平均值及极差分析表Tab.4 The average and range analysis table of each level of different plant growth regulators
对不同植物生长调节剂红枫组培苗继代增殖系数进行方差分析,结果见表5。
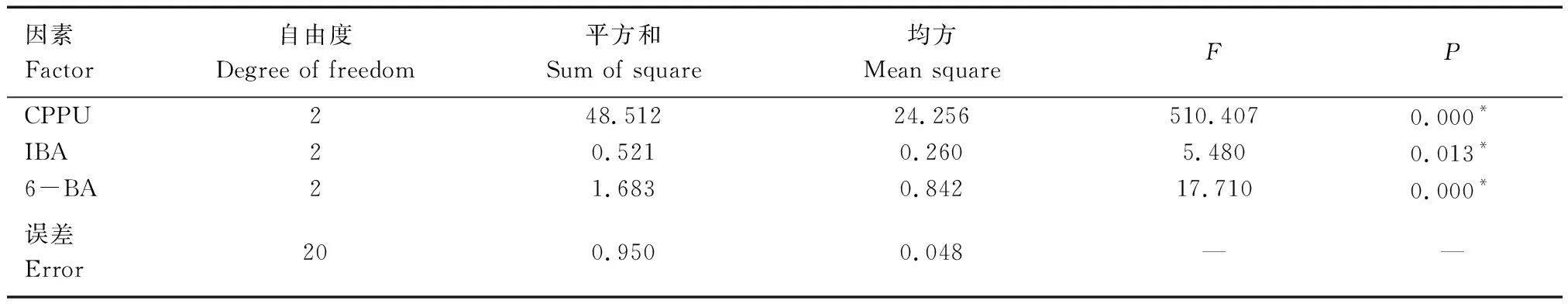
表5 增殖系数方差分析
实验选取的3个因素中,CPPU的质量浓度对增殖系数的影响最大,其次是6-BA,最小的是IBA,且三者都达到了显著水平。说明3种植物生长调节剂对红枫增殖系数均有显著影响,结合极差分析结果,红枫组培苗增殖最优植物生长调节剂组合为:CPPU(0.4 mg/L)+IBA(0.1 mg/L)+6-BA(1.0 mg/L),增殖系数达6.45。结合图1的继代增殖表型可知,3种植物生长调节剂配合使用植株生长旺盛、叶片翠绿、长势良好。
2.3 不同植物生长调节剂处理对红枫组培苗壮苗的影响
在预实验进行时发现,没有经过壮苗培养的组培苗,极难移栽成活,因此,组培苗移栽前一定要经过壮苗培养。本试验通过2种植物生长调节剂对红枫组培苗进行壮苗培养,测量并统计形态指标。测量指标见表6,由表6可见,低质量浓度的ZT和IBA有助于植株叶片的生长,低质量浓度的ZT和高质量浓度的IBA有助于植株茎段生长,处理8平均株高为6.15 cm,茎粗为21.41 mm,为最优处理结果,植株生长健壮。

表6 不同植物生长调节剂处理对红枫组培苗茎粗和株高的影响Tab.6 Effects of different plant growth regulator treatments on stem diameter and plant height of red maple tissue culture seedlings
处理8的平均株高和茎粗较低质量浓度的IBA和ZT处理分别增加了19.64%和34.40%。但当IBA质量浓度为0.5 mg/L时,随着ZT质量浓度的升高,茎粗有下降的趋势。双因素方差分析结果表明(表7),除了ZT和IBA的质量浓度对红枫组培苗茎粗的增加有显著影响,不同质量浓度的ZT和IBA的交互作用对茎粗的增加也有显著影响,可得出最佳壮苗的处理组合为:IBA(0.5 mg/L)+ZT(1.0 mg/L)。

表7 茎粗和株高双因素方差分析结果
2.4 不同植物生长调节剂处理对红枫组培苗生根的影响
由表8可知,在1/2 MS培养基中分别添加GA3和NAA新型植物的生长调控剂来进行植物生根培养。低质量浓度GA3和NAA处理生根效果差,相反高质量浓度的GA3和NAA诱导生根效果好。添加0.5 mg/L NAA处理的组培苗,效果最好,最长平均根长可达7.05 cm,平均根数达4.43,平均根质量为0.23 g,生根率为100%。较低质量浓度处理的平均根长、平均根数、平均根质量、生根率分别增加了63.19%、89.31%、43.75%、32.90%。适宜美国红枫组培的生根诱导培养基为1/2 MS +1.0 mg/L GA3+0.5 mg/L NAA。结合图1的表型可观察到,经过生根培养基处理的组培苗其根系极为发达和粗壮,叶片更为繁茂,长势良好。
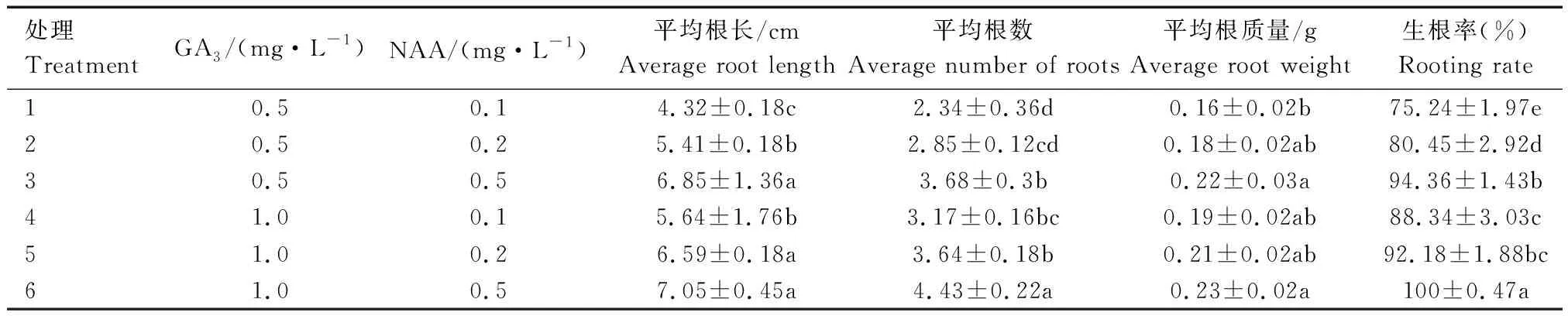
表8 不同植物生长调节剂处理对组培苗生根的影响

图1 美国红枫组织培养生长过程Fig.1 The growth process of American red maple tissue culture
3 讨 论
3.1 外植体的消毒处理
植物离体快繁体系建立的首要条件是获得有活性的无菌材料。本试验材料是从室外采集的美国红枫带芽茎段,茎段的腋芽与茎段间易积累病菌,消毒困难,易出现过度消毒或消毒不完全等情况。单独采用酒精消毒剂很难达到杀菌效果,张佳奇等[12]研究酒精和HgCl2组合对紫花槭带芽茎段的杀菌效果,结果表明, 75%的酒精消毒40 s、0.1% HgCl2消毒8 min 效果较好,酒精消毒少于40 s外植体污染率较高 。王思冉[13]对东陵八仙花进行离体再生研究表明,其茎段最佳消毒方法为:75%酒精消毒30 s+0.1% HgCl2消毒8 min。本试验前期进行预实验时采取次氯酸钠与酒精组合使用,平均存活率为60%,由于外生菌比较顽固,所以后期进行试验时引入了升汞杀灭顽固外生菌以提高存活率。美国红枫的腋芽外包裹了多层鳞片,使其在消毒处理时部分位置没有与消毒剂充分接触,因此导致腋芽的染菌率很高。本试验在实际操作中通过摇晃、震荡的方式使消毒剂与外植体充分接触,以达到充分、全面的消毒效果。本试验为了防止内源菌的滋生,除了使用消毒剂,初代培养基中还增添了抑菌剂——益培灵,抑菌效果显著,极大地提高了组培苗成活率。目前,美国红枫通过叶片等其他外植体未能获得离体幼苗,因此,选用带芽茎段进行离体培养。探索美国红枫嫩枝带芽茎段适宜的消毒方式,为大规模快速繁育优质美国红枫苗木奠定了基础。
3.2 继代增殖培养
植物生长调节剂是在调控植物生长发育过程中具有十分重要且复杂的生理效应。其中,细胞分裂素直接影响丛生芽的增殖系数。但浓度过高反而会抑制腋芽的形成,并且随着多次的继代,在植物体内外源激素会慢慢累积,进而抑制增殖,例如,于传[14]关于美国红枫腋芽增殖培养中,只添加TDZ,增殖系数随着TDZ的质量浓度先增加后下降时,添加0.002 mg/L质量浓度TDZ和0.4 mg/L质量浓度NAA后增殖系数最大。李黎等[15]在研究萱草不定芽增殖时发现,高质量浓度的NAA和6-BA会降低萱草组织培养时的增殖系数。魏晓雪等[16]研究表明高质量浓度的2,4-D会使兴安百里香试管苗的增殖系数显著下降,抑制其增殖。 在本试验中,随着细胞分裂素CPPU质量浓度的增大,增殖系数有明显下降,最高质量浓度的处理较最优处理下降了26.35%,与前人研究趋势一致。
顶端分生组织产生的生长素会使下端分生组织或分生区在顶端分生组织保持休眠状态[16]。而且,决定分枝行为的主要机制是细胞分裂素——生长素平衡。鉴于此,改变这些植物生长调节剂在腋芽分生组织附近的平衡可以促进或抑制新芽的形成[17]。在本试验中,通过提高外源细胞分裂素的质量浓度提高增殖系数,这有可能导致因为外源激素质量浓度的提高使植物体吸收的激素增多进而打破了植物体内激素平衡,使细胞分裂素含量显著高于生长素含量,进而提高了增殖系数。
CPPU是一种苯基脲衍生物,是有效的细胞分裂素降解抑制剂。但在前人的组织培养中更多的是应用6-BA,而CPPU使用较少。因此,本试验添加了CPPU来优化不定芽的增殖培养,试验结果表明,植物生长调节剂选择与调整中选择0.4 mg/L CPPU+0.1 mg/L IBA +1.0 mg/L 6-BA最佳,增殖系数为6.45。本试验中对MS培养基进行了改良,通过改变大量元素的种类和含量进而调整了硝酸盐和氯离子的比例,比MS、WPM等培养基更利于红枫的生长。
3.3 生根和培苗培养
在生根培养中,添加IBA、IAA与NAA均可获得较好的生根效果,对于细胞分裂素的用量,一般使用很少的剂量或者全部去掉。例如,适合美国红枫‘十月辉煌’”(AcerrubrumL.‘October Glory’”)试管苗生根的激素配比为3.0 mg/L NAA+0.6 mg/L TDZ+1.0 mg/L 6-BA[18]。有研究表明,在培养基中添加0.2 mg/L的IBA可使黑枸杞组培苗根系更为粗壮,生根数量更多[19-21]。
本试验中激素的选择为赤霉素和生长素的结合,使生根率极大提高,有研究表明赤霉素能提高植物体内生长素的含量,因此,比单独添加生长素获得了更高的生根率。
此外,在试验过程中发现,植株在继代增殖的前几代生根效果并不理想,而在继代增殖4代后,从5代开始,生根率显著提升,达到100%,说明可能是在继代增殖培养的过程中,植物体会对激素进行积累,积累到一定程度后才会有显著的生根效果。
美国红枫在移栽前株高和根系需要长到一定的高度和长度,组培苗的根系在无菌条件下生成,吸收功能较实生苗差,气孔导度大,易失水,光合作用弱。所以,在炼苗的过程中将组培盖改用孔隙稍大的封口膜进行封口,并放在有温差变化的环境中,给苗木适应的水分和温度变化过程,经过此过程苗木由绿色变成泛微黄色,之后颜色又变为绿色,说明植物已经适应水分变化的过程。因此,对移栽的基质、水分、温湿度和光照等严加控制管理,以提高移栽成活率,达到工厂化育苗的要求。在炼苗移栽时,根据初代培养加入抑菌剂能降低污染率,本试验在移栽过程中加入了益生菌,进而获得了更高的成活率。
4 结论
本试验以美国红枫‘秋火焰’腋芽茎段为外植体离体培养,在无菌体系建立过程中发现,最佳的消毒组合为5% NaClO(8 min)+0.1%HgCl2(6 min),污染率最低,平均污染率为33.15%,平均存活率为60.98%,死亡率为5.87%。在继代增殖时筛选的最佳增殖培养基为改良MS+0.4 mg/L CPPU+0.1 mg/L IBA+1.0 mg/L 6-BA,增殖系数为6.45,说明通过外界细胞分裂素质量浓度的增加,能够显著提高红枫组培苗的增殖系数。在壮苗生根培养过程中,通过生长素浓度梯度的设定,筛选出最佳壮苗培养基为改良MS + 1.0 mg/L ZT + 0.5 mg/L IBA,平均株高为6.15 cm,平均茎粗达到21.41 mm;最佳生根诱导培养基为1/2 MS+0.1 mg/L NAA+0.1 mg/L IBA,生根率达100%。

