两种手术入路对胸腔镜右上肺叶切除术可行性及术后康复的影响
朱军 翁鸢 朱扣军 耿纪群 王福栋
肺癌是世界上最常见和最严重的癌症类型之一。在中国,肺癌的发病率和死亡率在所有肿瘤中均占据第一位[1-2]。NCCN指南指出,对于早、中期非小细胞肺癌(Non-small cell lung cancer, NSCLC),电视胸腔镜手术(Video-assisted thoracoscopic surgery, VATS)肺叶切除术和全身淋巴结切除术是标准的手术程序,并已广泛应用于临床实践[3-5]。在所有原发性肺癌中,右肺上叶癌的发病率最高。由于右肺上叶解剖特征差异较大,不同术者通常采用不同的手术入路[6-8]。不同的手术入路和解剖顺序在VATS右肺上叶切除术(Right upper lobectomy, RUL)中可能对提高手术可行性和促进术后康复起到重要作用。然而,很少有研究探讨分析不同手术入路对VATS RUL手术操作可行性和术后康复的影响[9]。本研究比较了VATS RUL患者AVB入路和aBVA入路的手术方式及术后康复情况,希望为优化手术流程和促进术后康复提供一些理论依据。
资料与方法
一、一般资料
收集2017年1月1日至2019年10月31日在江南大学附属医院就诊的86例患者的临床资料,其中男50例(58%),女36例(42%)。本研究纳入采用VATS RUL治疗的原发性肺癌患者,包括术中中转开胸的病例,其他肺叶肺癌患者、肺癌合并右上叶楔形切除、全肺切除术或任何其他局部/扩大手术除外。确认受试者的隐私权,所有患者均在术前签署知情同意书。该研究通过江南大学附属医院伦理委员会讨论通过(LS2019049)。
二、同质性检验及围手术期特征
根据随机数字表将患者分为两组,由同一外科医生及扶镜手实施VATS RUL。该外科医生及扶镜手已经通过学习曲线,可以熟练地进行胸腔镜下肺叶切除术。为确保两组患者的同质性,本研究分析了两组患者的一般临床特征(包括年龄、性别、吸烟情况、基础疾病、肺功能、蛋白水平、动脉血气状况等)和与手术难度相关的因素(包括肺裂发育、胸腔粘连、肿瘤最大直径、TNM分期、淋巴结清扫个数、淋巴结清扫站数等)。为了评价手术的有效性和安全性,对术中手术时间、术中出血量、中转开胸率、淋巴结清扫、切割闭合器钉仓数量等因素进行分析。比较术后康复情况,分析了诸多术后相关因素,胸腔引流时间、术后住院时间及术后并发症(包括:肺炎、持续漏气>7 d、皮下气肿、乳糜胸、房颤等)。此外,还对住院费用等经济因素进行了分析。
三、外科手术方法
所有患者均行全麻双腔气管插管,取左侧卧位。在第七肋间隙腋中线,做一1厘米切口作为观察孔。第四肋间隙腋前线,做一3~5 cm切口作为操作孔。根据手术解剖顺序将VATS RUL患者分为AVB组和aBVA组。
AVB组解剖顺序:1)显露前纵隔,从右肺上叶静脉下缘至奇静脉弓下缘打开前纵隔胸膜,清扫第10组淋巴结,继续从奇静脉弓下缘至后纵隔解剖胸膜,暴露右肺上叶支气管;2)解剖并离断右肺上叶尖前段动脉,然后解剖离断右肺上叶静脉和右肺上叶支气管;3)沿肺动脉干向远端显露并离断后升支动脉,最后离断肺裂;4)取出标本后,清扫第2、4、7组淋巴结(图1)。
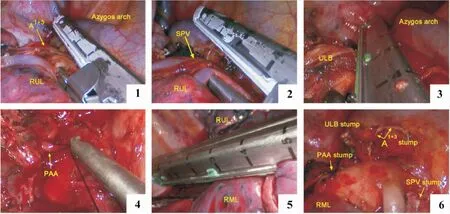
图1 AVB入路的关键步骤
aBVA组解剖顺序:1)显露后纵隔,清扫第7、10组淋巴结,打开奇静脉弓下缘胸膜组织,游离右肺上叶支气管与尖前段动脉之间的间隙;2)打开斜裂,解剖离断后升支动脉和右肺上叶支气管;3)显露前纵隔,游离右肺上叶静脉,“隧道法”离断水平裂;4)将剩余的右肺上叶静脉与尖前段动脉一并离断;5)取出标本并清扫第2、4组淋巴结(图2)。

图2 aVAB入路的关键步骤
四、统计学分析
采用SPSS 17.0软件进行统计学分析:分析比较两组患者临床特征、病理特征、淋巴结清扫情况、手术可行性以及术后恢复情况等方面的差异。连续变量采用独立样本t检验;分类变量采用Pearson χ2检验/Fisher精确检验。P<0.05为差异有统计学意义。
结 果
一、患者的临床特征比较
(见表1)所示,右肺上叶癌患者平均年龄为61.6±8.2岁。AVB组与aBVA组在年龄、性别、肺功能、蛋白水平、动脉血气状况等一般临床特征方面差异无统计学意义(表1)。
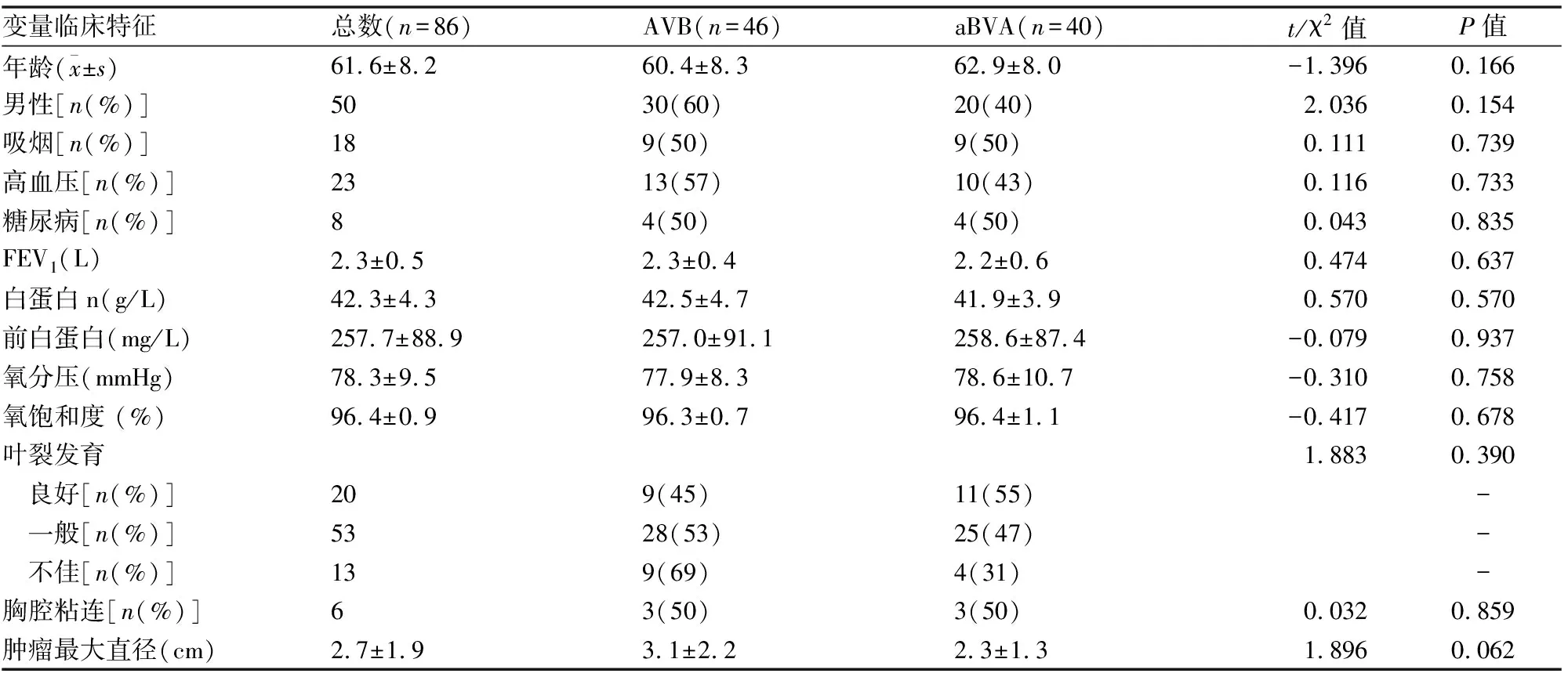
表1 两组患者的临床特征比较
二、术后病理特征比较
本研究以腺癌(87.2%,75/86)为主,鳞状细胞癌次之(11.6%,10/86),大细胞癌1例。除组织学亚型外,两组在分化程度、TNM分期、脉管侵犯、神经侵犯、胸膜侵犯等方面差异均无统计学意义(均P>0.05)(表2)。
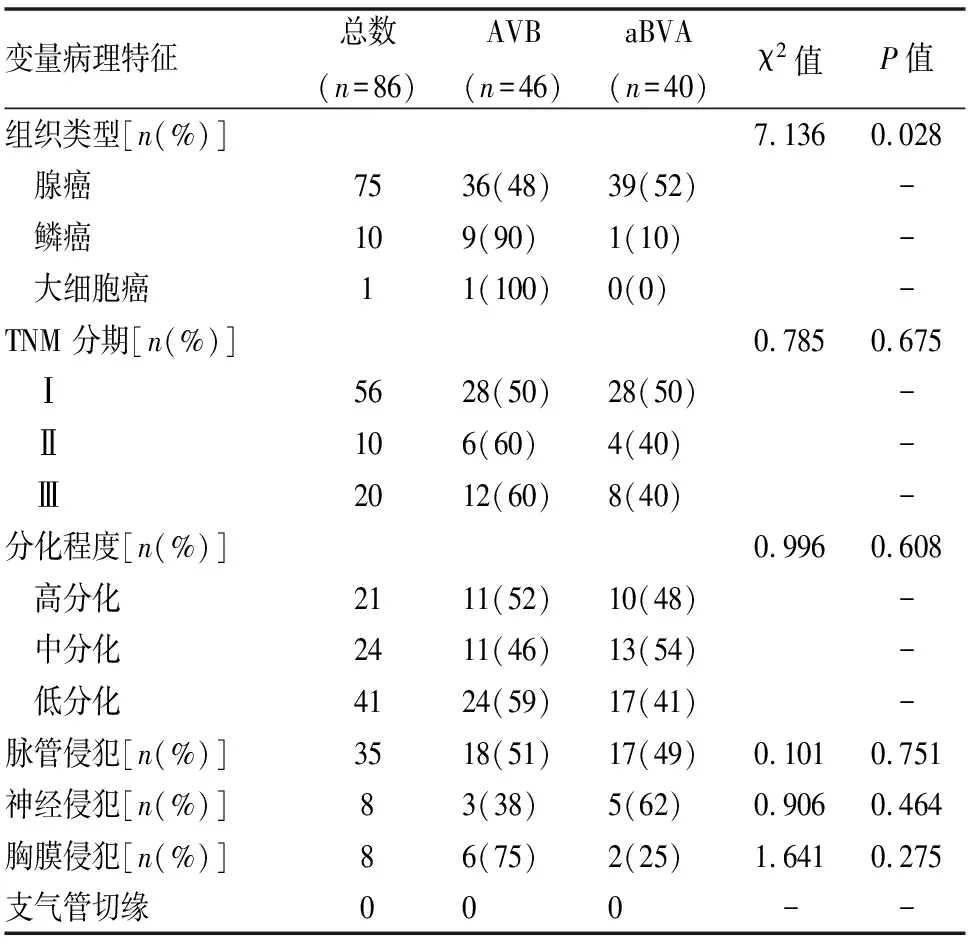
表2 两组患者术后病理特征比较
三、淋巴结清扫情况比较
本研究共清扫1226枚淋巴结,平均每例清扫14.3枚淋巴结。术后病理显示淋巴结转移24例,淋巴结转移率27.9%(24/86)。淋巴结转移程度为6.6%(81/1226)。AVB组与aBVA组在淋巴结清扫数、阳性数、清扫站数方面差异无统计学意义(P=0.564、0.974、0.555)(表3)。
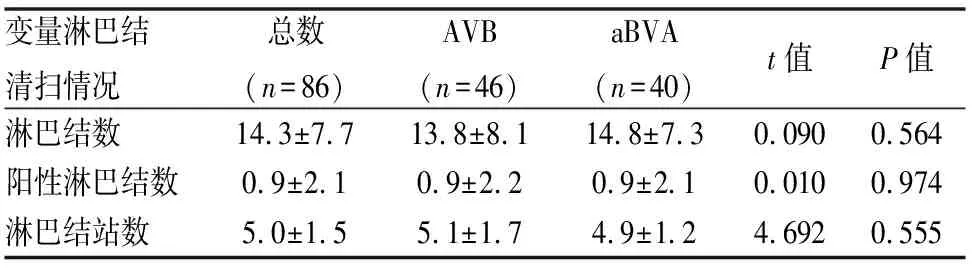
表3 两组患者淋巴结清扫情况比较
四、手术可行性比较
与手术可行性相关的手术特征结果列于(表4)。aBVA组平均手术时间短于AVB组(138.4±38.8vs181.6±47. 6 min,P<0.001),术中出血量少于AVB组(113.0±69.7vs196.5±121.8 mL,P<0.001)。与AVB组相比,aBVA组所需的切割闭合器钉仓数量较少(4.0±0.5vs5.4±0.6,P<0.001)。aBVA组无中转开胸病例,AVB组中有2例患者中转开胸,其中一例为胸腔严重粘连,另一例为术中大出血(P=0.497)(表4)。

表4 两组患者手术可行性及术后康复情况比较
五、术后康复情况比较
在术后康复方面,aBVA组胸腔引流时间及术后住院时间显著短于AVB组(3.6±0.7vs4.8±1.3 d,P<0.001; 6.2±1.3vs7.8±2.6 d,P=0.001)。两组术后并发症发生率相似(P=0.717)(表4)。此外,aBVA组患者的住院费用显著低于AVB组(61000±5000vs69000±15000元,P=0.001)(表4)。
讨 论
由于右肺上叶解剖特征差异较大,临床上不同术者采用的手术入路不同[6-8]。Liu等人报道了一种单向式肺叶切除术入路,该入路由前向后,从右肺上叶静脉、动脉至右肺上叶支气管(VAB入路)[10]。在该入路中,离断肺门结构后将肺裂离断,切除的肺叶从胸部切口取出,从而减少肺泡胸膜漏和血管损伤的风险[11]。Yan总结了一种后入路术式,先解剖离断右肺上叶后升支动脉,方便后肺门暴露,然后解剖离断右肺上叶支气管,最后将右肺上叶剩余的动静脉一并解剖离断[12]。近年来,有文献报道,优先原位解剖离断右肺上叶支气管,然后同时解剖离断右肺上叶血管(Simplified synchronous disconnection of pulmonary arteries and veins, SSDPAV)。他们认为这种方法简单、安全,并且可以带来更好的术后恢复[13-15]。然而,很少有研究探讨分析不同手术入路对VATS RUL手术操作可行性和术后恢复的影响。
我们的研究发现,与AVB组相比,aBVA组具有手术时间短(P<0.001)、术中出血量少(P<0.001)、胸引流时间短(P<0.001)、术后恢复快(P=0.001)、住院费用少(P=0.001)等优点。常规的单向式右肺上叶切除术(静脉-动脉-支气管,VAB)通常按以下顺序进行:右肺上叶静脉→右肺上叶动脉→右肺上叶支气管→叶裂[10]。由于单操作孔VATS下空间角度的影响及术者的操作习惯,优先解剖离断右上叶动脉,相对方便,所以我们通常采用AVB入路。与aBVA入路相比,AVB入路的手术风险相对较低,但手术操作较为复杂,需要反复翻转右肺上叶,可能造成不同程度的肺挫伤;解剖右肺上叶静脉时,容易意外伤及后方的肺动脉干,造成凶险的出血。在我们的研究中,有一例因损伤静脉后方动脉干,而发生严重出血。另外,分开解剖离断右肺上叶动、静脉会消耗更多切割闭合器钉仓,增加患者的经济负担。手术时间延长,可能会增加术后并发症的发生率,如肺炎等,最终延长术后住院时间和住院费用。
由于右肺上叶支气管位置相对固定,解剖变异小。优先离断右肺上叶支气管后,右肺上叶活动性增加,便于切割闭合器钉仓的放置;同时解剖离断右肺上叶动静脉,使得手术流程更加简便[16]。随着操作流程的简化,切割闭合器钉仓使用数量减少,减轻了患者的经济负担,节省了医疗资源。另外,在离断右肺上叶血管之前优先解剖离断右肺上叶支气管,消除了潜在肺静脉淤血引起的支气管黏膜非炎症反应,减少了术后肺炎、肺不张等并发症[17-18]。更重要的是,先解剖右肺上叶支气管,可避免癌细胞通过气道播散(Spread through air spaces, STAS),减少术后肿瘤复发转移风险[19-21]。
aBVA入路在技术上也存在一定的困难和局限性。其中难点包括准确识别后升支动脉、“隧道法”解剖叶裂以及熟悉肺门解剖结构。对于叶裂发育不佳的病例,术前需要充分阅片,必要时结合三维重建,便于术中后升支动脉的解剖辨识。若经叶裂解剖辨识困难,可优先处理后肺门,沿后段支气管下方向远端游离暴露后升支动脉。需要注意的是,因右肺上叶动静脉一并离断,在手术过程中,外科医生需要密切注意避免动静脉瘘。术者应充分松解裸露血管,避免动静脉重叠。如果有淋巴结与肺血管紧密粘附,需要将淋巴结向血管远端游离,保证血管根部完全裸化。
结 论
在VATS RUL中,aBVA入路优先原位解剖右肺上叶支气管,可以提高右肺上叶癌患者的手术安全性,简化手术操作,利于术后恢复,并且能够减轻经济负担,节约医疗资源。

