香烟烟雾提取物对BEAS-2B细胞生长及炎症因子分泌的影响
胡春萌 孙德俊
慢性阻塞性肺病(简称慢阻肺)是一种进行性破坏性肺疾病,其特征是持续、不可逆的气流受限[1-2]。长期香烟烟雾暴露是慢阻肺的主要危险因素,可诱导气道炎症反应和上皮细胞凋亡[3],产生不可逆气流阻塞以及肺气肿、可能导致炎性毛细支气管炎和支气管炎相关的肺功能障碍[4]。气道上皮是呼吸系统第一道防御屏障,也是第一个与烟雾直接作用的组织。香烟烟雾诱导的上皮细胞功能障碍,可能是慢阻肺发生的主要因素和早期事件[5]。本研究以香烟烟雾处理人支气管上皮细胞(BEAS-2B),观察细胞生长、增殖与诱发的炎症反应情况,探讨香烟烟雾暴露对BEAS-2B细胞生长和炎症因子分泌的影响,为后续探讨不同香烟提取物浓度的选择与作用,以及香烟诱导慢阻肺的机制奠定基础。
资料与方法
一、材料
BEAS-2B气道上皮细胞(中国科学院上海细胞库),红梅牌香烟(焦油10mg/支)(红塔烟草有限责任公司),DMEM培养基和胎牛血清(Gibco),CCK-8试剂盒,IL-6、CCL11、MCP-1、IL-13ELISA试剂盒(Elabscience)。
二、方法
1 香烟烟雾提取物制备 制备含3支香烟烟雾的提取物。在串联的两个大包氏管内各加入20 mL DMEM吸收液,管的一端连接去掉滤嘴的香烟,另一端则连接一个50 mL的注射器。香烟点燃后,每支烟抽吸次数控制在15次,匀速抽取烟雾直至香烟燃尽,轻轻摇晃玻璃瓶使烟雾充分溶解。将收集到的液体移入离心管中,过滤后调整其PH为7.4,测OD320 nm~OD540 nm值在0.9~1.2之间,即为100% CSE原液,于4℃保存,备用。实验所需的不同浓度CSE溶液,用相应体积的无血清培养基稀释,配制好不同浓度的CSE须在30 min内用于实验。
2 细胞培养及传代 将BEAS-2B细胞用含10%胎牛血清的DMEM培养基常规培养于37℃、5% CO2细胞培养箱,当细胞生长达80%以上融合状态时进行传代。收集对数期的BEAS-2B细胞,调整细胞悬液浓度,使用血球计数板进行细胞计数,以105个/每孔的密度接种于六孔板中,在培养箱中培养至细胞生长达80%以上时,弃掉培养基,在每六孔板细胞中分别加入3 mL的0.1%,1%,3% 浓度的香烟烟雾提取物的培养基,同时设立对照组。
3 绘制BEAS-2B细胞生长曲线 将不同浓度CSE处理24 h,48 h,72 h后的六孔板细胞以5000细胞数分别接种于96孔板,分组为对照组,0.1%CSE,1%CSE,3%CSE,并设不接种细胞的空白组,每组6个复孔,加入含血清的培养基继续培养,隔天换液。每隔24 h加入10 μL CCK-8溶液培养2 h,随后经酶标仪检测各样本在450 nm处的OD值,连续测7 d。检测不同时间、不同浓度CSE处理后BEAS-2B细胞生长情况,绘制细胞生长曲线。
4 CCK-8法检测细胞增殖活性 取对数生长期细胞以5000细胞数接种于96孔板,将细胞分为对照组,0.1%CSE,1%CSE,3%CSE四组,每组6个复孔,在不同浓度CSE处理后的24 h,48 h,72 h加入CCK-8溶液,检测各样本在450 nm处的OD值,计算细胞存活率。[细胞存活率=(试验组 A 值-空白组 A 值)/(对照组 A 值-空白组 A 值)×100%]。
5 酶联免疫吸附剂检测BEAS-2B细胞中炎症因子表达 收集不同浓度CSE处理24 h、48 h、72 h后的细胞上清液,用ELISA试剂盒测定IL-6、CCL11、MCP-1、IL-13的含量,具体操作方法按照试剂盒说明书进行,每组处理设置3个复孔,各组试验均独立重复三次。
三、统计学方法

结 果
一、不同浓度香烟烟雾对BEAS-2B细胞生长影响
将0.1%CSE、1%CSE、3%CSE处理24 h、48 h、72 h后的BEAS-2B细胞连续检测7 d,绘制细胞生长曲线(图1)。细胞整体呈持续生长的趋势,3%CSE处理24 h和48 h后对细胞生长有明显的抑制作用,随着处理时间增长,细胞抑制减弱;72 h的CSE对细胞生长几乎没有影响。

图1 不同浓度CSE对BEAS-2B细胞生长影响
二、不同浓度香烟烟雾对BEAS-2B细胞活性影响
用0.1%CSE、1%CSE、3%CSE直接处理BEAS-2B细胞24 h、48 h、72 h后,通过CCK8检测细胞增殖能力(图2)。不同浓度CSE处理24 h后与对照组相比细胞活性没有影响;3%CSE处理组48 h与72 h后细胞活性较对照组均显著降低,差异具有统计学意义(48 h:P<0.001,72 h:P<0.01)。
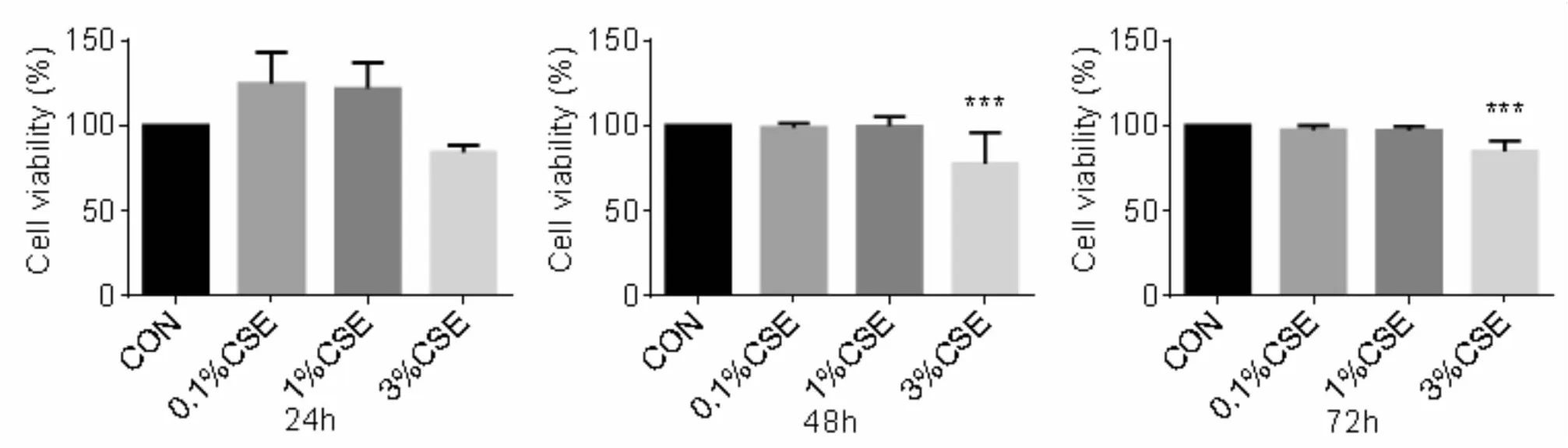
图2 不同浓度CSE对BEAS-2B细胞活性影响
三、不同浓度CSE对BEAS-2B细胞分泌炎症介质水平的影响
(图3)中,在BEAS-2B细胞上清液24 h,48 h 3%CSE处理组中IL-6表达量与对照组相比降低,差异具有统计学意义(24 h:P<0.05,48 h:P<0.01)。分别处理24 h 、48 h和72 h 时,3%CSE处理组中CCL-11表达水平与对照组相比降低,差异具有统计学意义(24 h:P<0.01,48 h:P<0.001,72 h:P<0.001)(图4)。3%CSE处理组持续处理24 h、48 h和72 h 时MCP-1表达量与对照组相比降低,差异具有统计学意义(24 h:P<0.01,48 h:P<0.001,72 h:P<0.001)(图5、6)。BEAS-2B细胞上清中IL-13在各组间的表达无显著差异(图6)。

图3 不同浓度CSE对BEAS-2B细胞分泌IL-6水平的影响

图4 不同浓度CSE对BEAS-2B细胞分泌CCL-11水平的影响

图5 不同浓度CSE对BEAS-2B细胞分泌MCP-1水平的影响

图6 不同浓度CSE对BEAS-2B细胞分泌IL-13水平的影响
讨 论
吸烟是慢阻肺的重要危险因素。香烟烟雾通过口腔进入气道,气道上皮作为机体的重要屏障,持续处于炎症浸润、组织损伤和细胞死亡等状态下,成为慢阻肺致病的主要因素[6]。慢阻肺是重大慢性呼吸系统疾病,其致死亡率在全球死因排行榜中排名第三。慢性支气管炎或近端气道产生过多粘液、肺气肿或周围肺组织破坏和肺泡附着物丧失以及伴随着炎症和气道重塑的小气道功能障碍,是慢阻肺的重要病理特征[7]。持续摄入香烟烟雾引发的气道炎症,即使在戒烟多年后仍会持续出现,而这一现象对于吸烟的慢阻肺患者尤为明显,直接表现为气道炎症反应水平加剧,持续时间延长。上述病理过程涉及机体的先天免疫系统和适应性免疫系统[8]。一项病例-对照研究发现,慢阻肺与吸烟总量之间存在显著的剂量-反应关系[9],患慢阻肺的风险随着吸烟总量的增加而增加,该效应与长期持续摄入香烟烟雾引发的气道炎症、损伤与细胞凋亡等有直接关系。然而,香烟烟雾对于气道的影响与危害是否呈剂量依赖或者时间依赖作用,目前尚无报道。本研究通过设置CSE的不同浓度和处理时间等条件处理BEAS-2B细胞,在体外证明香烟烟雾影响细胞生长与增殖,抑制IL-6、CCL-11和MCP-1炎症介质释放。随着CSE处理时间增长,细胞增殖呈减缓趋势,抑制作用与对照组相比不显著。这可能是因为细胞体外培养时间长,影响其正常生长或建立了耐受,有待于进一步研究。同时,发现BEAS-2B细胞在3%CSE浓度处理48 h与72 h后,细胞活性较对照组均显著降低,此数据为使用香烟烟雾诱导的BEAS-2B细胞炎症模型提供剂量和处理时间等条件的参考。
本研究中,重点关注IL-6、IL-13、CCL11和MCP-1的表达情况。IL-6是一种多功能糖蛋白构成的炎症因子,在多种基质细胞和免疫细胞中产生,与多种系统的炎性疾病密切相关[10]。IL-6分泌增加,能够上调局部免疫反应,并诱导全身释放类似物,但通过体外抑制巨噬细胞释放TNF抑制炎症反应。IL-6是慢阻肺的重要炎症指标,与气流限制和肺气肿病程进展具有强相关[11]。研究表明,气管内直接灌注IL-6可消除脂多糖引起的肺损伤与肺部炎症作用[12]。支气管肺泡巨噬细胞是机体抵御病原体的重要防线。在病原体侵入机体时,巨噬细胞释放的IL-6是肺部防御的早期反应[13]。McCrea等人验证了具有抗炎作用的细胞因子IL-6,在吸烟者肺部的表达减少[14]。这与本实验中香烟烟雾降低IL-6在BEAS-2B细胞中的表达结果一致。Eotaxin-1 (CCL11)具有嗜酸性粒细胞趋化作用,通常与哮喘相关[15],Eotaxin和Eotaxin受体(CCR3)阳性细胞在慢性支气管炎急性加重和哮喘中,表达升高;在50名FORTE试验[16]研究参与者(34名稳定期受试者和16名快速进展期受试者)和11名对照组中,血浆eotaxin-1在快速进展期受试者中低于稳定期慢阻肺患者,稳定期慢阻肺受试者中Eotaxin-1也显著低于正常对照组[17]。但另一项研究发现,慢阻肺患者的Eotaxin高于对照组,转录因子NF-κβ和GCR-α上调该细胞因子的产生[18]。慢阻肺患者的Eotaxin水平表达趋势在不同报道中具有显著差异。本实验通过体外实验,证明CCL11在香烟烟雾诱导的细胞模型中表达水平降低。Eotaxin-1的变化提示肺内T淋巴细胞和嗜酸性粒细胞转运的改变,可能是影响慢阻肺稳定性的重要因素,细胞介导的免疫反应,对慢阻肺的临床状态有重要影响。Eotaxin-1水平可作为评估慢阻肺患者病程的潜在标志物。单核细胞趋化蛋白1(MCP-1)是一种β趋化因子,主要由巨噬细胞产生。可诱导人单核细胞/巨噬细胞、小鼠肥大细胞和人T淋巴细胞亚群的趋化[19]。MCP-1在多种组织中表达,还在巨噬细胞、内皮细胞、支气管上皮细胞和平滑肌细胞中表达[20],是过敏性炎症的关键炎症介质,通过诱导肥大细胞激活和白三烯C4释放,导致气道高反应性[21]。Cevit等人发现MCP-1表达与哮喘患者气道炎症严重程度呈正相关[22]。在吸烟的慢阻肺患者的痰液中,MCP-1水平明显高于非吸烟者和吸烟的健康对照者;在慢阻肺患者血浆中MCP-1水平高于健康对照组[23]。研究发现MCP1表达在BEAS-2B细胞的过敏性炎症反应中明显上调[24],因此,对于过敏性炎症反应,MCP1具有重要作用,其表达模式已明确,而对于非过敏性炎症反应中,其表达特征与模式还有待探讨。本研究通过香烟烟雾诱导体外炎症模型,发现MCP-1表达降低。
香烟烟雾提取物,降低支气管上皮细胞的生长活性,改变炎症因子的表达,可导致慢阻肺的发生发展。在吸烟者中,促炎因子的过度表达和抗炎过程水平的不足,可能导致未抑制的炎症和发展为阻塞性气道疾病的风险。肺部促炎细胞因子和抗炎细胞因子水平的改变可能在持续暴露于香烟烟雾的人的炎症性气道疾病的发展中起重要作用,也更容易受到其影响。进一步的研究评估与阻塞性气道疾病发展相关的产生炎性细胞因子和炎性细胞趋化剂的细胞成分,将有助于更好地理解这些疾病过程。本研究具有一定局限性,香烟烟雾提取物没有可靠的标准品,目前关于香烟烟雾提取物相关研究均来自于实验室通过香烟自制的,虽然本研究将自制的提取物进行质控与定量标记,但是其作用还受到香烟品牌、焦油含量等影响。香烟烟雾提取物的质控与剂量标记,极大影响数据的稳定性与实验结论的可靠性,这也是发表文章中结果不一致的部分原因。希望可以出现一款具有代表性的可靠的香烟烟雾提取物标准品,为建立体外细胞模型提供保障。

