奶牛源鼠李糖乳杆菌的12C6+重离子束诱变选育
蒋 威,沈文祥,2,郑娟善,2,武小虎,杨雅媛,吕亚楠,王胜义,严作廷,
(1.中国农业科学院兰州畜牧与兽药研究所,甘肃兰州 730050;2.西北农林科技大学动物医学院,陕西杨凌 712100)
乳酸菌(Lactic acid bacteria,LAB)是一类能够以碳水化合物为底物,发酵产生具有抑菌活性的有机酸、HO及细菌素等次级代谢物的细菌的统称,此外还能够产生功能性的胞外多糖,其在食品及医药中具有多种益生功能,菌体通常无芽孢,属于革兰氏阳性细菌,广泛存在于健康动物的口腔、胃肠道及生殖道。乳酸菌种类繁多,作用广泛,它们以其潜在的健康和营养益生作用而得名,因此被认为是“具有益生性能的微生物”或“当摄入足够量的活的乳酸菌株,可对宿主健康产生益处”。鼠李糖乳杆菌是乳酸菌中益生性菌株的最重要来源之一,随着人们物质生活水平的提高,人们对其需求也与日俱增,不管是食品发酵,还是以乳酸菌为主要菌种的益生菌制剂都对其生长、产酸及抑菌活性提出了新的要求;此外,利用乳酸菌活菌制剂或其代谢产物来对人类及动物疾病进行预防和治疗,已切实可行。但从动物或自然界分离的乳酸菌株存在代谢物产量低或不稳定的问题。所以,探索提高应用乳酸菌性能的新策略是当前重点研究的方向,而诱变选育无疑是当前的最佳选择之一。
诱变选育是借助各种诱变源或诱变剂的理化因素来处理细胞,加速基因突变,再建立适当的筛选方法以获得所需的高产优良株的现代育种方式之一。诱变选育的理论是基于基因突变。经过多年的实践,诱变选育技术已有了长足的发展,出现了传统辐射诱变(X 射线、射线、紫外线和激光等)、化学诱变(甲基磺酸乙酯、氮芥、亚硝酸和亚硝基胍等)、紫外线-亚硝基弧复合诱变、常压室温等离子体诱变及太空诱变等。重离子束诱变具有能量沉积、动量传递和遗传物质的质子转移和重排、损伤后修复效应小及不易回复突变等突出特点。重离子的能量通常较高,一般每核子在GeV 量级甚至更高,地面上通过加速器获得的重离子,能量可从keV 量级到GeV 量级。相较于常规X、及紫外线等, 重离子束在穿过生物介质时,将大量能量沉积在其移动的径迹上,造成细胞核中DNA 分子的显著损伤,故而表现出更高的诱变效率,所以通过重离子束辐照来改变微生物的生产性能,提高微生物的产出,是一种切实有效的菌种育种方法。
目前利用C重离子束辐照诱变技术在阿维链霉菌、嗜热乳杆菌、谷氨酸棒状杆菌的菌种改良中已经取得了很好的效果,但尚未见重离子束诱变鼠李糖乳杆菌的研究,故本研究利用C重离子束对奶牛源鼠李糖乳杆菌临床分离株进行诱变选育,以期获得体外益生性更强的鼠李糖乳杆菌菌株,为乳酸菌防治奶牛生殖道疾病的基础研究提供标的菌株。
1 材料与方法
1.1 材料与仪器
原始野生菌株鼠李糖乳杆菌临床分离株JF12-1中国农业科学院兰州畜牧与兽药研究所奶牛创新团队保存;大肠杆菌为ATCC29922 广东环凯微生物科技;MRS 肉汤培养基及固体改良培养基 购自广东环凯微生物科技;碳酸钙AR 国药集团化学试剂有限公司;溴甲酚紫99% 天津市永大化学试剂有限公司;葡糖糖AR 天津市大茂化学试剂厂;细菌DNA 提取试剂盒(Bacterial DNA Kit D3350)Omega Bio-Tek 公司;16S rDNA 通用引物 西安擎科生物;1.5%琼脂糖凝胶粉 北京索莱宝生物。
C重离子束 中科院兰州物理研究所提供;LAI-3-T 厌氧培养箱 广州瑞丰实验设备有限公司;WP-UP 超纯水机 赛默飞有限公司;细菌浊度仪北京天安联合科技有限公司;UV-BlueStarPlus 紫外-可见分光光度计 北京莱伯泰科仪器有限公司;PHSJ-F 型pH 计 上海仪电科学仪器股份有限公司;SBA-40D 生物传感分析仪 山东省科学院生物研究所; LDZX-30KB 立式压力蒸汽灭菌器 上海申安医疗器械厂;1108-150 型游标卡尺 中巽云科技有限公司;BSA224S 型十万分之一分析天平 赛多利斯科学仪器(北京)有限公司;DYCP-31DN 琼脂糖核酸电泳仪 北京六一有限公司;Biometra TOne 96G PCR 仪 德国耶拿公司。
1.2 实验方法
1.2.1 培养基的制备 种子及斜面培养基:准确称取MRS 固体改良培养基成品54 g,溶解于1 L 蒸馏水中,用盐酸调节pH 至7.0±0.3,121 ℃,高压灭菌15 min;发酵培养基:称取MRS 成品固体改良培养基54 g,加入10%葡萄糖,灭菌方法同上;溴甲酚紫-碳酸钙固体筛选培养基(简称SMBVC):MRS 固体改良培养基成品中加入0.01%溴甲酚紫和0.25%的碳酸钙,灭菌方法同上。
1.2.2 原始野生菌株JF12-1 特性测定
1.2.2.1 生长曲线绘制 将斜面保存的原始野生菌株JF12-1 用接种环刮下,接种于种子培养基,于37 ℃恒温厌氧培养24 h 以复壮,4 ℃,4000×g 离心15 min,以获得菌体,PBS 洗涤2 次,利用细菌浊度仪重悬调整浓度至1.0×10CFU/mL,获得复壮后初始种子菌悬液。取菌悬液按1%(V/V)的接种量接种于MRS培养基,37 ℃、300 r/min 厌氧振荡培养24 h,每隔2 h 取样,测定菌液的OD,参照DIANA 等报道,以时间为横坐标,对应OD 值为纵坐标,绘制原始野生菌株的生长曲线。
1.2.2.2 生物传感仪测定乳酸含量 SBA-40D 型生物传感仪利用专一性和高效性的固定化酶为分子识别的原件,具有两支生物性的探测电极,并由微电脑控制,可自动进样检测发酵样品中乳酸含量。将1.2.2.1 复壮后初始种子菌悬液按10%的比例接种于发酵培养基(250 mL 锥形瓶装入100 mL 发酵培养基),于37 ℃、300 r/min 振荡厌氧发酵24 h,每隔2 h 取样发酵上清,参照张金露等报道,利用生物传感仪测定各发酵时间点样品的乳酸含量(g/L),以时间值为横坐标,产乳酸量为纵坐标,绘制原始野生菌株的产乳酸曲线。
1.2.2.3 酸斑值测定 取1.2.2.1 复壮后初始种子菌悬液,连续稀释10倍之后取100 μL,利用涂布棒均匀涂布于溴甲酚紫-碳酸钙固体筛选培养基(SMBVC),于37 ℃厌氧培养24 h,由于乳酸菌的产酸特性会在菌落周围产生融钙圈,测定融钙圈和菌落直径,按(1)式计算酸斑值(HC)。

式中,HC 为酸斑值,D为菌落周围产生的融钙圈直径(cm),而D为菌落自身直径(cm)。
1.2.3 鼠李糖乳杆菌的C重离子束辐照 取1.2.2.1 复壮后初始种子菌悬液2 mL 置辐照皿中,设置重离子束C的辐射参数,利用重离子束C,在吸收剂量率为40 Gy/min 的条件下,分别于0、40、80、120、160、200、300、400 Gy 的辐照剂量下对原始野生菌株悬浮液分别进行辐照处理,每个辐照剂量下设置3 个平行。
1.2.4 诱变菌株HC 值与产乳酸关系的建立 参照王雨辰报道的方法,将重离子束辐照诱变后的各辐照梯度菌悬液,分别稀释至10倍之后各取100 μL,均匀涂布于溴甲酚紫-碳酸钙固体筛选培养基(SMBVC),置于37 ℃厌氧培养箱培养24 h,统计各梯度存活菌落数,计算各菌落的HC 值;同时将HC 值不同菌落分别接种于发酵培养基,37 ℃发酵培养18 h,同1.2.2.2 所述方法测定各突变菌株的产乳酸量,得到突变菌株HC 值与其产乳酸量之间的关系,建立利用突变菌株HC 值进行初筛的方法。
1.2.5C重离子束诱变致死率及突变率测定 重离子束辐照结束后,将辐照后的菌悬液进行连续稀释后,吸取0.1 mL 均匀涂布于MRS 固体培养基上(3 个重复),于37 ℃恒温厌氧培养24 h,通过平板菌落计数统计存活菌落数并确定致死率,绘制图得到致死率随辐照剂量变化曲线。同上将突变后的菌悬液均匀涂布于SMBVC 上,形成的单菌落在SMBVC上可以形成透明的溶钙圈,统计溶钙圈直径及菌落直径,计算HC 值,按式(2)计算致死率,按式(3)和式(4)计算正负突变率,绘制致死率和正、负突变率曲线。最后根据致死率及突变率确定最佳辐照诱变剂量。
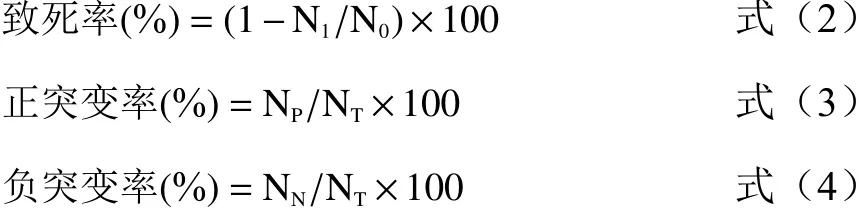
式中,N是辐照后生长的菌落数,N是辐照对照组(0 Gy)生长菌落数。N是HC 值比原始野生菌株提高20%及以上菌落数,N是HC 值比原始野生菌株降低20%及以上菌落数,N是该辐照剂量下的菌落总数。
1.2.6 突变菌株的酸斑法初筛 将最佳辐照剂量下的各突变菌株接种于SMBVC 上,计算各突变菌株的HC 值,筛选出HC 值较原始野生菌株提高25%以上的突变菌株作为初筛后突变菌株。
1.2.7 突变菌株的抑菌圈法复筛 将初筛后的突变菌株在接种于发酵培养基,于37 ℃恒温厌氧培养24 h,以大肠杆菌为致病指示菌,对其体外抑菌活性进行测定,筛选出抑菌圈直径较原始野生菌株提高15%以上的菌株,作为复筛后突变菌株。
1.2.8 突变菌株遗传稳定性测定 将复筛后突变菌株于发酵培养基中连续传代9 次,每隔2 代利用1.2.2.2 所述方法测定其产乳酸量,依据其产乳酸变化检测突变菌株遗传稳定性。
1.2.9 稳定突变株16S rDNA 鉴定 按细菌DNA提取试剂盒操作说明提取原始野生菌株和稳定突变菌株基因组DNA,利用PCR 仪特异性扩增各菌株的16S rDNA 片段,引物序列:27F 5′-GAGCGGATAA CAATTTCACACAGG-3′,1492R 5′-CGCCAGGGTTT TCCCAGTCACGAC-3′,50 μL 的反应体系,PCR 反应条件为:94 ℃ 5 min,94 ℃ 1 min、55 ℃ 1 min、72 ℃ 1.5 min,30 个循环,72 ℃延伸5 min。PCR 产物经电泳检测后进行测序,测序结果经过Seq-man软件拼接后与NCBI 核酸数据库比对,MEGA-X 构建系统发育树。
1.3 数据处理
所有实验均进行三次独立重复实验,试验结果数据除HC 增加值用百分比表示外,其余结果均采用平均值±标准差的形式表示;利用Excel 2019 和SPSS 25.0 统计软件进行数据处理。本试验组间比较选用单因素ANOVA 检验。若假定等方差则用LSD 检验,若不假定等方差则用邓尼特T检验,<0.05,则差异显著,具有统计学意义。
2 结果与分析
2.1 原始野生菌株的生长特性
对原始野生菌株生长情况进行研究,为后期诱变菌株的选育提供依据。鼠李糖乳杆菌JF12-1 菌体随时间生长规律如图1-a,可知0~4 h 阶段,菌体生长缓慢,与培养环境的适应有关;4~12 h,呈指数级增长,为对数生长期,此阶段乳酸菌株代谢最旺盛、活力最好,适合菌株性状研究;12~20 h 阶段为稳定期,其阶段菌株代谢稳定,适合菌株代谢物研究;20 h 之后开始逐渐步入衰亡期,菌体死亡数开始增多。此乳酸菌株的生长曲线与徐颖等研究中报道的鼠李糖乳杆菌Lr-1 和Lr-2 相同,均于12 h 达对数末期;而与罗素贤等关于鼠李糖乳杆菌JX-1 的生长曲线研究结果不同,该菌株于10 h 末便开始进入稳定期,这可能与菌株来源及特异性有关。
发酵生长过程中乳酸产量变化如图1-b,可知,此鼠李糖乳杆菌菌株在2 h 内,代谢缓慢,产乳酸变化不明显,2~10 h 产乳酸量急剧升高,10~16 h 产乳酸量较前一阶段有所放缓,但仍然在升高,16~24 h 产乳酸量基本保持恒定,产乳酸量最高峰值为7.12 g/L。
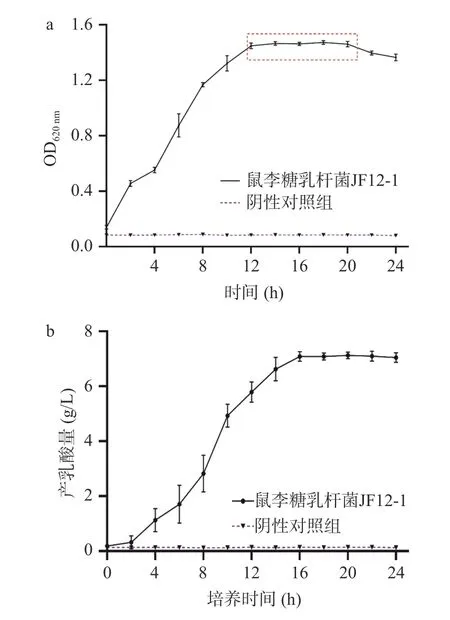
图1 原始野生菌株鼠李糖乳杆菌JF12-1 生长曲线(a)和产乳酸曲线(b)Fig.1 Growth curve (a) and lactic acid production curve (b) of primitive wild strain Lactobacillus rhamnosus JF12-1
乳酸菌在特定的筛选培养基上,菌落会在代谢产生的有机酸作用下于其周围产生黄色的融钙圈,其HC 值已作为与突变株比较的优良株筛选标准之一。本实验中鼠李糖乳杆菌JF12-1 在溴甲酚紫-碳酸钙筛选培养基中产生了明显的融钙圈,如图2。对筛选培养基上同一菌株的5 个不同菌落的HC 值进行统计,作为原始野生菌株的HC 值,作为后续突变株筛选的依据,结果如表1,结果显示原始野生菌株鼠李糖乳杆菌JF12-1 平均HC 值为3.23。
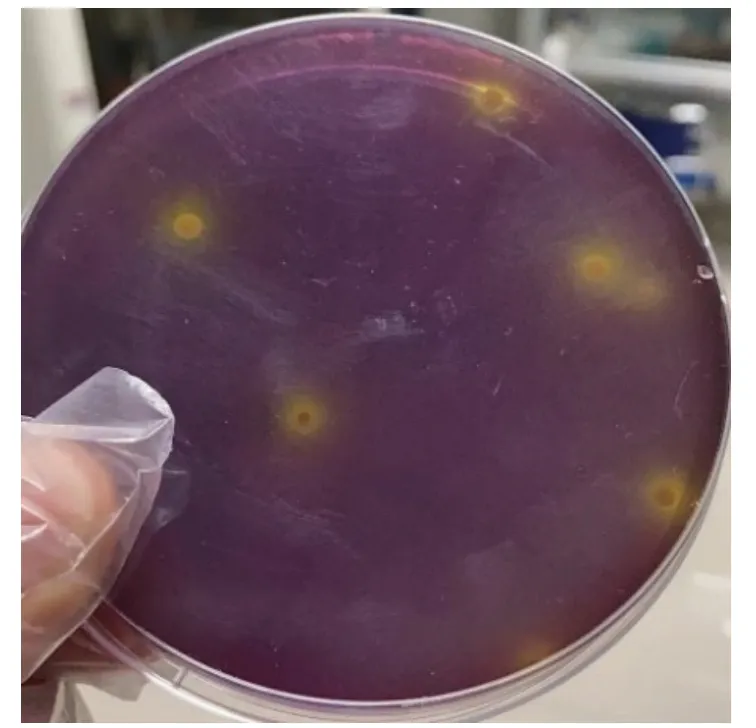
图2 原始野生菌株鼠李糖乳杆菌JF12-1 融钙圈效果图Fig.2 Effect diagram of the original wild strain Lactobacillus rhamnosus JF12-1 melting calcium ring
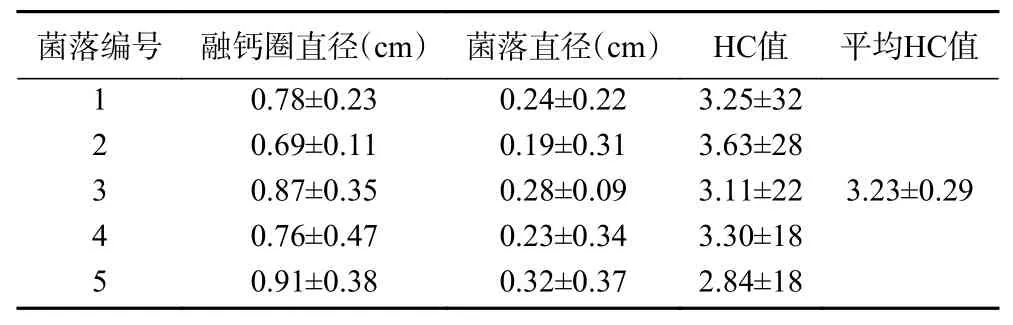
表1 原始野生菌株鼠李糖乳杆菌JF12-1 的菌落HC 值Table 1 HC values of the original wild strain Lactobacillus rhamnosus JF12-1
2.2 诱变后菌株HC 值与其产乳酸关系
将辐照诱变后的所有突变菌株分别接种到溴甲酚紫-碳酸钙固体筛选培养基(SMBVC),测定融钙圈,计算菌株HC 值和其对应产乳酸量,结果发现辐照诱变之后的菌株HC 值与其产乳酸量之间存在显著的正相关性,以300 Gy 辐照梯度下的诱变后10 株菌株的HC-产乳酸关系为例(如图3),由此可见诱变后菌株HC-产乳酸关系能够作为高产乳酸突变菌株的筛选方法。
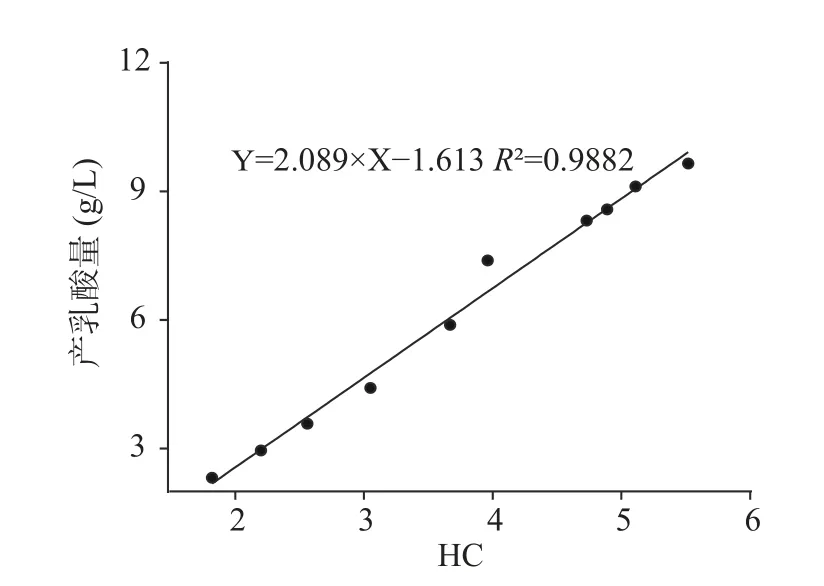
图3 突变菌株HC 值与其产乳酸量之间的相关性Fig.3 Correlation between HC value and lactic acid production of mutant strains
2.3 诱变的最佳辐照剂量
建立致死率曲线和正负突变率曲线,确定最佳诱变吸收剂量。致死率反映了菌落的存活情况,C重离子束诱变鼠李糖乳杆菌JF12-1 后,各辐照剂量下的致死率变化如图4-a。致死率随辐照剂量的增大呈现出先升高后下降,之后又急剧升高的变化规律。当辐照剂量为0~80 Gy 时,致死率随辐照剂量的增加而急剧上升;80~120 Gy 时,致死率随辐照剂量的增加而出现降低;120~400 Gy 时,致死率随辐照剂量的增加而再度急剧升高;菌落半致死辐照剂量约为160 Gy,300 Gy 时致死率79.86%,400 Gy 时致死率接近95.39%。本研究中致死率变化呈马鞍形,与王雨辰等关于植物乳酸菌JTL 在经过不同辐照剂量的C重离子束辐照后的研究结果相一致,其致死率虽然随着辐照吸收剂量的增大而增大,但关系并非呈线性而呈马鞍形。但与都雯玥在重离子辐照选育截短侧耳素高产菌株研究中报道的致死率曲线呈线性的报道相反,这可能与菌株特异性有关。起初在低辐照剂量下,重离子束产生自由基对细胞生物膜和DNA、蛋白质等生物大分子直接造成损伤,使辐照菌株致死率急剧增大;随着重离子累积注入量的增加,细胞表面损伤严重,能量沉积及动量传递继续对菌株产生损伤,使其致死率仍呈上升趋势,这种作用的持续会短暂激活细胞的某种损伤修复机制,使得致死率出现短暂下降;但当辐照累积量增加到一定值时,多种物理效应产生的渐变性损伤累积,势必会对菌株造成不可逆的物化损伤。
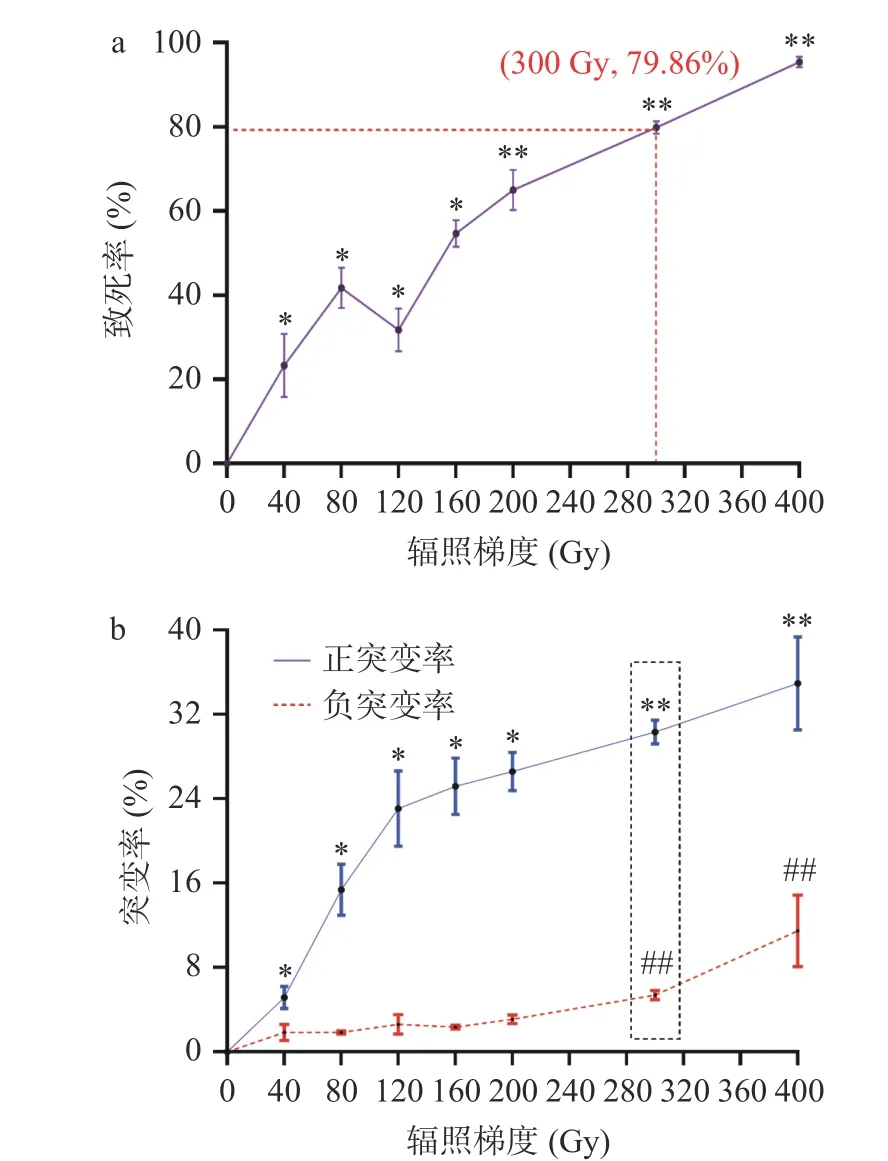
图4 致死率(a)、正负突变率(b)随辐照剂量变化曲线Fig.4 Fatality rate (a), positive and negative mutation rate (b)curve with radiation dose
正、负突变率反映了诱变过程中正、负突变菌株数占全部被诱变菌株数的比率,随辐照剂量的变化而变化,C重离子束各辐照剂量下的正、负突变率变化如图4-b。一定辐照剂量范围内,虽然提高辐照剂量能提高致死率,亦可提高正突变率,但负突变率也会相应增加,为此在最大限度的提高致死率(提高正向突变率)情况下,还要保证负突变率不会明显的增大,才能诱变成功(即找到一个最佳辐照剂量),而多数研究所报道的当致死率处于80%时,会得到一个理想的辐照结果。蔡聪等在产左旋乳酸的乳酸菌诱变研究中,发现当被诱变菌株的致死率在70%~80%范围内,诱变后菌株才会出现较多的正向突变株,对应的诱变剂量才是最佳剂量。杨佩斯对菌株进行ARTP 诱变,发现当在约80%致死率时,菌株诱变较理想,若致死率更高,正突变率虽然可能也有所增加,但在此情况下,负突变率都会较高,不宜优良突变菌株的筛选。本研究中辐照吸收剂量为300 Gy时,致死率较高接近80%;而400 Gy 时致死率虽然更高,但负突变率相较于300 Gy 时有了明显的升高,达到了11.49%,不利于理想突变株的筛选,故选择300 Gy 为最佳辐照剂量较为合适。
2.4 突变乳酸菌菌株的初筛
对最佳辐照诱变剂量300 Gy 下的正向突变菌株采用1.2.6 所述的方法进行筛选,以原始野生菌株JF12-1 的平均HC 值3.26 作为初筛对照,筛选出20株HC 值相较于原始野生菌株HC 值增加25%以上的突变菌株,筛选结果见表2,其中突变株JF11和JF16的HC 值增加最高,分别较原始野生菌株增加了49.69%和49.97%,但多数突变后菌株的HC 值增加百分比介于30%~50%之间。突变后菌株融钙圈如图5,较原始野生菌株有明显变大,说明诱变后菌株产有机酸量有明显提升。
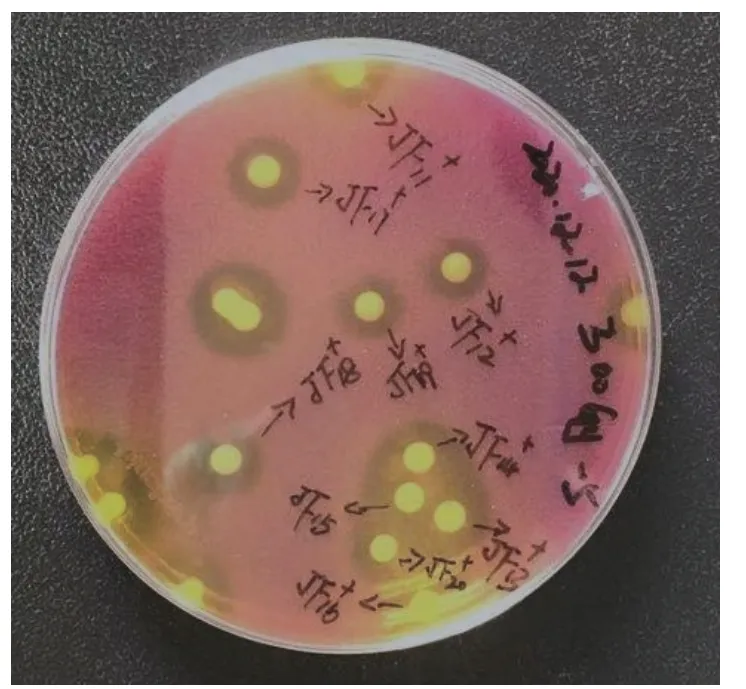
图5 初筛突变菌株融钙圈Fig.5 Preliminary screening of calcium melting circle of mutant strain
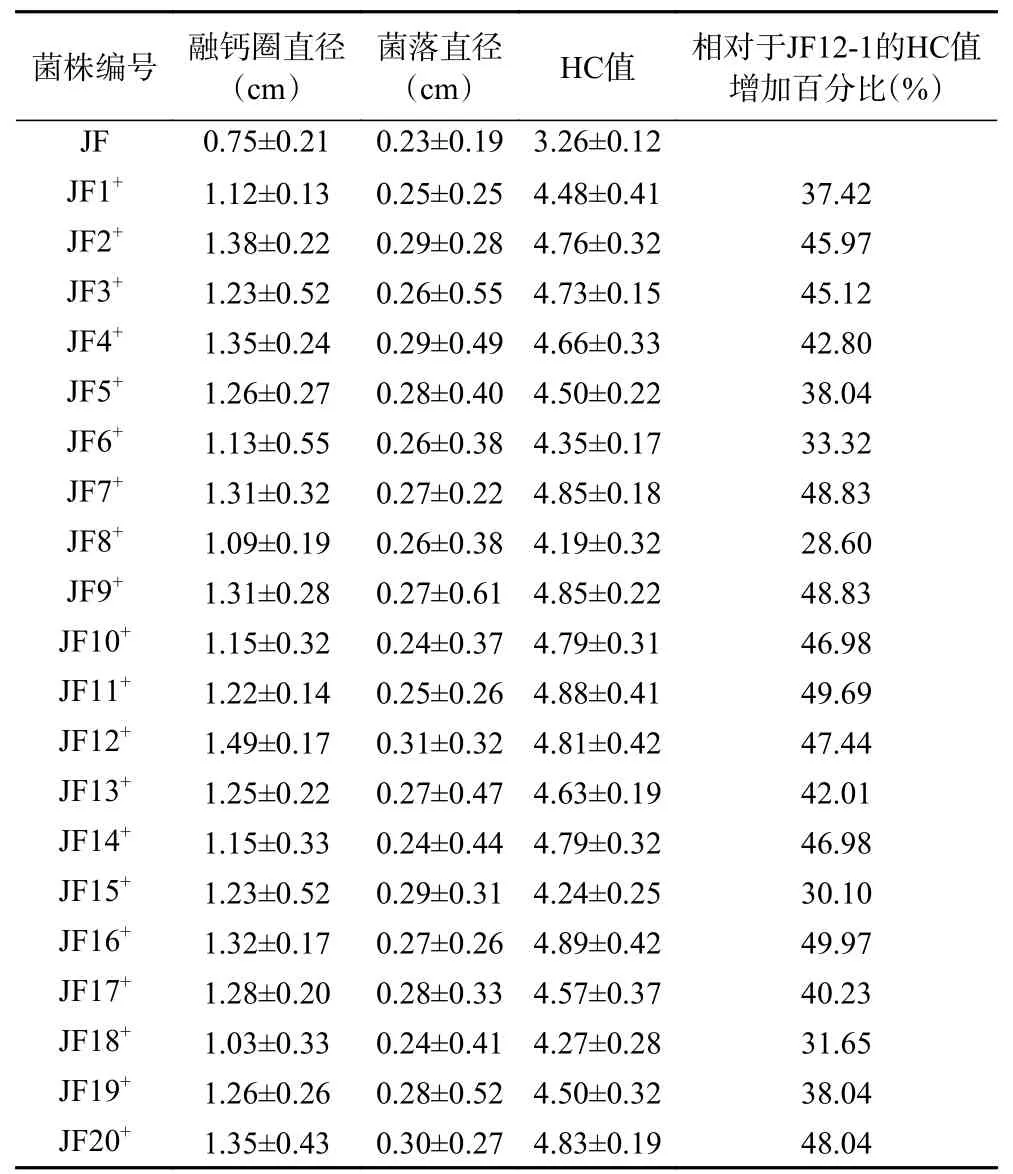
表2 最佳诱变剂量下的正向突变株Table 2 Positive mutants at optimum mutagenic dose
2.5 突变乳酸菌菌株的复筛
对初筛后的突变菌株参照1.2.7 所述方法进行大肠杆菌体外抑菌实验,以原始野生菌株JF12-1 对大肠杆菌平均抑菌圈直径19.95 mm 为参照,发现20 株初筛菌株中,只有8 株菌株的抑菌圈直径较原始野生菌株JF12-1 差异地提高(<0.05),分别为JF3、 JF4、 JF5、 JF9、 JF10、 JF11、 JF14及JF16,其抑菌圈直径分别为23.89、23.94、24.54、23.67、24.34、24.60、25.25 及24.33 mm,较原始野生菌株JF12-1 提高了18.65%~26.57%,结果见图6。最后确定这8 株突变菌株为复筛后突变菌株。
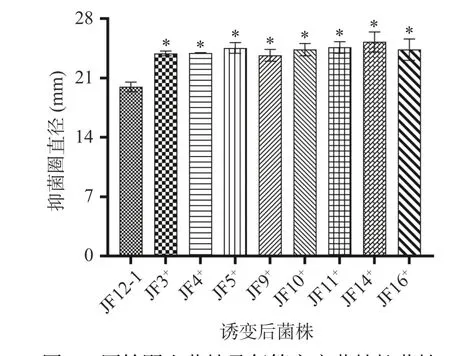
图6 原始野生菌株及复筛突变菌株抑菌性Fig.6 Bacteriostasis of original wild strain and double screening mutant strain
2.6 突变菌株的遗传稳定性
对筛选出的8 株产酸及抑菌性良好的突变菌株连续传代,隔代接种发酵对其产乳酸量进行测定,结果见表3。发菌株JF12-1 及各正向突变菌株隔代乳酸含量相比于第1 代变化不显著(>0.05),说明遗传稳定性良好。以原始野生菌株12-1 的平均产乳酸量7.92 g/L 为对照,发现各正向突变株的产乳酸量较原始野生菌株有明显提升,其中突变菌株JF16的平均产乳酸量为12.57 g/L,较原始野生菌株提高了58.74%。突变后菌株的产乳酸量及抑菌性除取决于相关基因所控制的代谢产物的表达量外,在很大程度上与菌株的培养条件密不可分。因此后续还需要研究培养基的营养配比来筛选最佳发酵条件,以使突变后的基因得以充分的表达,以进一步研究突变后菌株优良特性的表达。
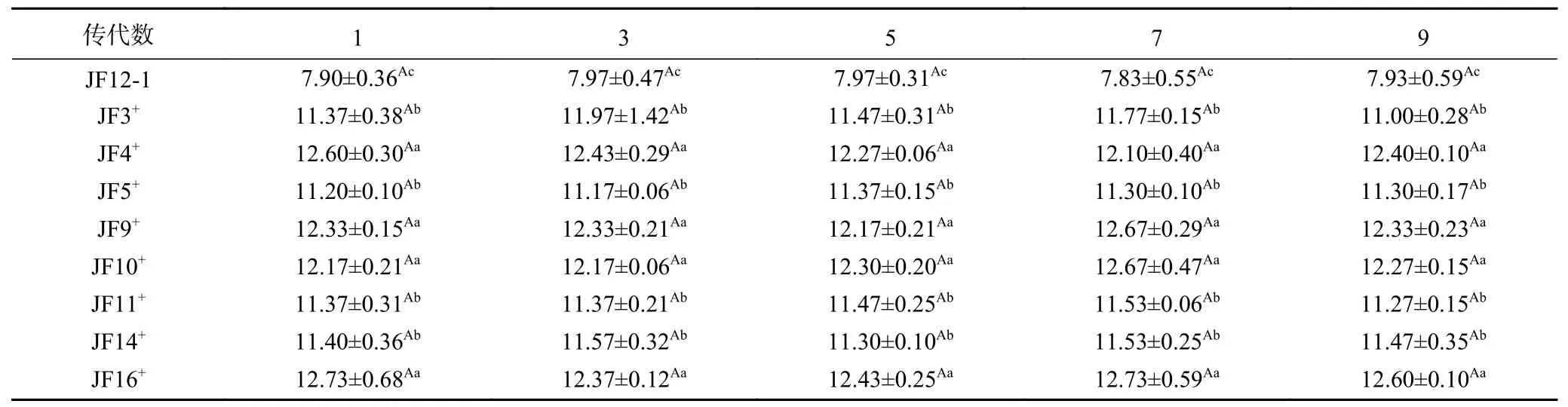
表3 突变株传代产乳酸量的稳定性(g/L)Table 3 Stability of lactate production in subculture of mutant strains(g/L)
2.7 突变菌株的16S rDNA 测序结果
通过琼脂糖凝胶电泳拍照,原始野生菌株和稳定突变菌株的16S rDNA 序列扩增成功,如图7 所示,分子量均为1500 bp,与原始野生型菌株JF12-1 的分子量相同。测序比对结果与同源相似序列构建的系统发育树如图8,很好地显示了诱变前后各菌株与鼠李糖乳杆菌的亲缘关系。本研究诱变选育后菌株的16S rRNA 基因片段未发现碱基突变,这与WANG 等对植物乳杆菌太空诱变菌株的序列研究相似,说明乳酸菌株16s rRNA 基因片段普遍具有保守性,这与其物种的亲缘关系有关。而促使其产酸、抑菌功能增强的突变位点可能存在于其他基因区段,这需要进一步对诱变选育后菌株的全基因组序列进行研究才能确定。
图7 原始野生菌株及复筛突变菌株的16S rDNA 电泳图Fig.7 16S rDNA electrophoresis of the original wild strain and the double-screened mutant strain
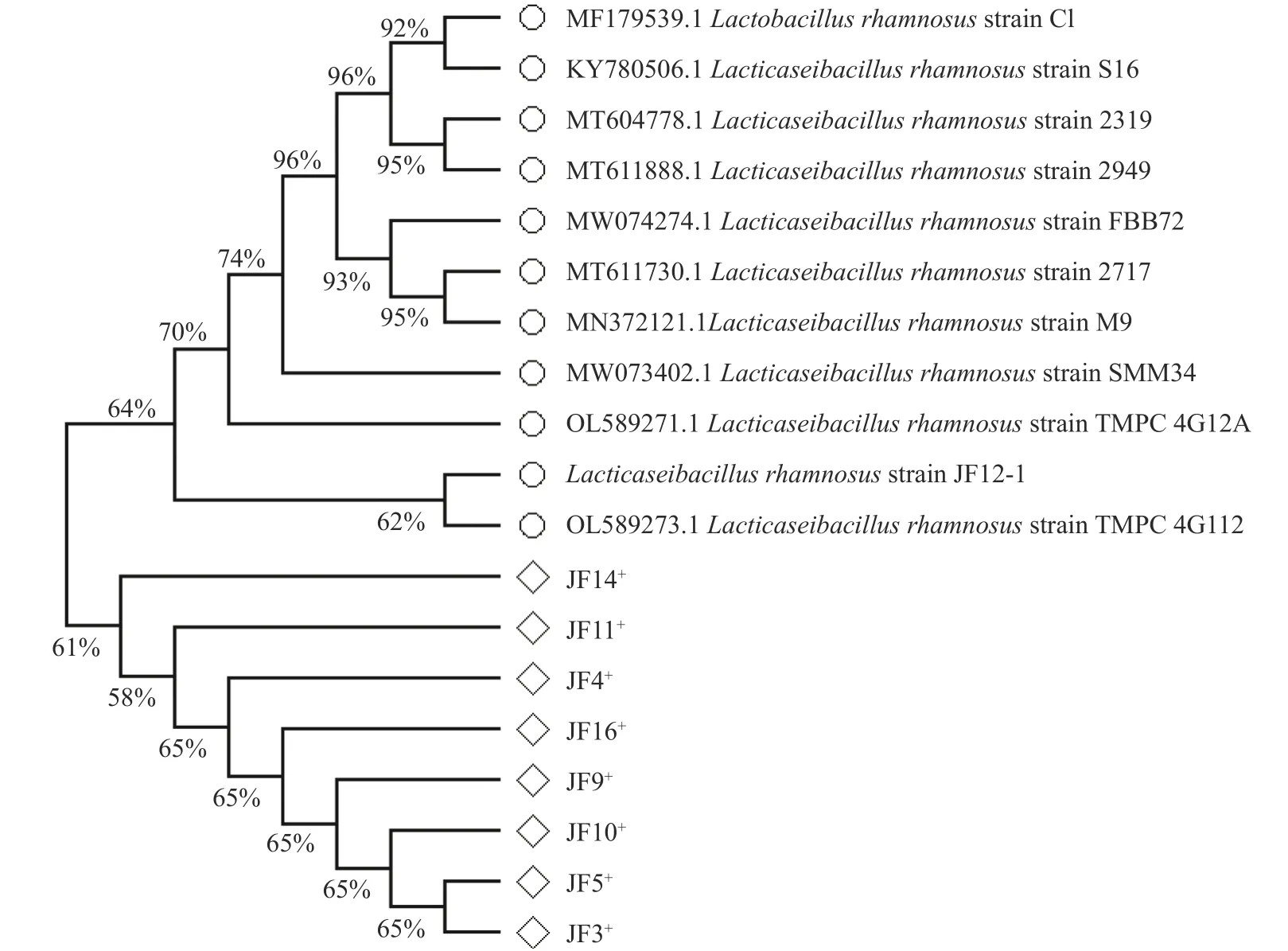
图8 原始野生菌株JF12-1 及诱变后菌株的发育进化树Fig.8 The phylogenetic tree of primitive wild strain JF12-1 and the mutated strain
3 结论
本研究成功利用C重离子束对奶牛源鼠李糖乳杆菌JF12-1 进行了辐照诱变及选育。诱变确定300 Gy 为最佳辐照剂量,该剂量下致死率为79.86%,正突变率为30.33%,负突变率为5.38%,正向突变株最多;对最佳辐照剂量下的突变菌株初筛,得到20 株HC 值较原始野生菌株提高25%突变株,复筛得到JF3、JF4、JF5、JF9、JF10、JF11、JF14及JF16为体外对大肠杆菌抑菌性较原始野生菌株提高18.65%~26.57%的菌株;连续传代后接种发酵,发现这8 株突变乳酸菌株产乳酸较原始野生菌株提高了43.92%~58.74%且具有良好的遗传稳定性。说明C重离子束在优良稳定鼠李糖乳杆菌菌株选育中的使用是切实可行的。

