营养风险筛查与干预对食管癌手术患者的影响
谭雪丽,江 超,蒋蓉蓉
(中山大学附属肿瘤医院 广东广州510000)
食管癌患者因病变位置的特殊性,术前表现为进食困难,加之恶性肿瘤的消耗,常合并不同程度的营养不良。患者术后机体处于高分解、高代谢状态且无法进食,易造成水电解质和营养素的丢失,被认为是营养风险最高的恶性肿瘤[1]。据相关文献报道,食管癌营养风险的发生率为32.8%~85.0%[2]。有研究表明,营养风险是影响手术患者预后的独立危险因素,不利于患者术后恢复,增加术后并发症发生率及病死率[3]。因此,对食管癌患者进行营养风险筛查,并提供合理、及时的营养支持干预十分必要。营养风险筛查表(NRS-2002)建立在循证医学的基础上,是目前临床应用广泛的营养风险筛查工具[4]。本研究旨在探讨营养风险筛查与干预对食管癌手术患者的影响。现报告如下。
1 资料与方法
1.1 临床资料 选取2020年7月1日~2021年6月30日收治的62例食管癌手术患者,术前均采用NRS-2002[5]进行筛查,存在营养风险。纳入标准:经病理学确诊,符合食管癌诊断标准[6];年龄18~75岁,择期手术者;知情同意,自愿参加本研究;术前未行放化疗;能配合NRS-2002筛查;临床资料完整。排除标准:凝血功能障碍、免疫系统疾病;严重心、肺功能障碍;既往行消化道重建手术者;食管癌转移者;合并肠道器质性疾病或功能性疾病;严重糖尿病、甲亢等;术后24 h死亡者。将患者按入组顺序分组,奇数为对照组,偶数为观察组,各31例。对照组男22例、女9例,年龄(65.62±15.21)岁;体质量指数(21.45±3.12);肿瘤大小:<5 cm 18例,≥5 cm 13例;病理分期:Ⅰ期15例,ⅡA期8例,ⅡB期8例;肿瘤部位:胸上段7例,胸中段15例,胸下段9例;组织学类型:鳞癌29例,腺癌2例;其中合并吞咽困难者13例。观察组男21例、女10例,年龄(56.23±14.12)岁;体质量指数(21.78±3.34);肿瘤大小:<5 cm 20例,≥5 cm 11例;病理分期:Ⅰ期14例,ⅡA期10例,ⅡB期7例;肿瘤部位:胸上段6例,胸中段14例,胸下段11例;组织学类型:鳞癌30例,腺癌1例;其中合并吞咽困难者15例。两组一般资料比较差异无统计学意义(P>0.05)。本研究符合《赫尔辛基宣言》相关伦理原则。
1.2 方法
1.2.1 营养风险筛查 术前采用NRS-2002进行筛查,按照欧洲肠外肠内营养学会制订的评定方法,从营养状态受损情况、疾病严重程度、年龄3个方面进行筛查,包含近期体质量变化、人体学测量、膳食摄入情况和疾病严重程度。①营养状态受损。0分(无):正常营养状态;1分(轻度):食物摄入比正常需要量低25%~50%或3个月内体重丢失>5%;2分(中度):食物摄入比正常需要量低50%~75%,或2个月内体重丢失>5%或一般情况差;3分(重度):前1周食物摄入比正常需要量低75%~100%,或1个月内体重丢失>5%或3个月内体重下降15%,或BMI<18.5且一般状况差。②疾病严重程度。0分(无):正常营养需要量;1分(轻度):营养需要量轻度增加,如慢性疾病有急性并发症者(血液透析、慢性阻塞性肺部疾病、肝硬化、糖尿病、一般肿瘤患者)或髋关节骨折;2分(中度):营养需要量重度增加,脑卒中、血液恶性肿瘤、腹部大手术、重症肺炎;3分(重度):营养需要量重度增加,APACHE评分>10分的ICU患者、骨髓移植、颅脑损伤患者。③年龄。若年龄≥70岁则加1分。总分≥3分则提示营养不良风险,并建议进行临床营养支持。该评分表可操作性强,使用简便Kappa值=0.67。两组患者均于入院24 h内完成营养风险筛查,本研究62例患者NRS-2002评分均≥3分。
1.2.2 营养干预 两组患者手术治疗方式、麻醉方式及其他围术期护理方法基本均衡。对照组:术前不进行特殊营养支持,按入院前饮食方式进食,术前8 h禁饮食。观察组:术前3 d采用肠外营养和肠内营养相结合的营养策略。肠外营养:静脉滴注10%脂肪乳250 ml+8.5%复方氨基酸18AA 250 ml+10%葡萄糖注射液500 ml。肠内营养:每日口服或鼻饲200~400 ml肠内营养乳剂;术前12 h口服或鼻饲不含纤维的膳食肠内营养液瑞素500 ml;术前2 h静脉滴注5%葡萄糖注射液200 ml。两组术后第1天均给予肠内营养支持,根据患者的体质量指数、病情给予基本热能需要量,最多不超过1500 ml。营养液的泵入按照由慢至快、由少至多、由淡至浓的原则进行,控制温度36~39 ℃,采用肠内营养支持泵24 h匀速泵入,热量不足者由肠外营养补充。
1.3 评价指标 ①比较两组入院第2天及术后7 d 血清白蛋白(ALB)、血红蛋白(Hb)、体质量减少情况。于入院第2天、术后7 d采集患者清晨空腹外周静脉血,采用全自动生化分析仪检测ALB、Hb,于我院检验科抽血、化验。统计患者入院至术后7 d体质量减少的情况,采用TCS-200-RT 型电子体质量仪,于同一时间测量,以“kg”为单位,患者穿短衣裤、赤足,自然站立。②比较两组术后排气时间(每日固定时间监测肠鸣音)、首次排便时间、胸管留置时间、术后住院时间。术后胃肠功能恢复,体温正常,无并发症,可经口进食,且经主治医师确认状况良好后可出院[7]。③比较两组术后并发症发生率,包括切口愈合不良、感染、胃肠道症状、吻合口瘘。

2 结果
2.1 两组入院第2天及术后7 d ALB、Hb、体质量减少情况比较 见表1。

表1 两组入院第2天及术后7 d ALB、Hb、体质量减少情况比较
2.2 两组术后排气时间、首次排便时间、胸管留置时间、术后住院时间比较 见表2。

表2 两组术后排气时间、首次排便时间、胸管留置时间、术后住院时间比较
2.3 两组术后并发症发生率比较 见表3。
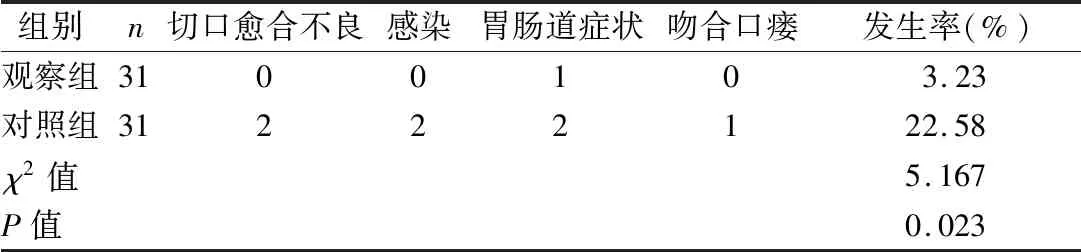
表3 两组术后并发症发生率比较(例)
3 讨论
食管癌是消化系统比较常见的恶性肿瘤,发病率占恶性肿瘤第六位,是一种高发病率、高病死率的恶性肿瘤[8]。目前,手术是治疗食管癌的主要方法,辅以放化疗能够有效控制病情,延长患者的生存期。近年来,手术技术的发展在一定程度上提升了治疗效果,但患者预后仍难以达到满意效果。主要是由于多数食管癌患者术前营养状态不佳,术后受手术创伤、消化道生理结构改变、围术期禁食等因素影响,增加了营养不良的发生风险。本研究存在营养风险的食管癌患者占65.26%。营养不良会降低患者对术后应激的耐受性,增加并发症的发生率[9]。有研究认为,通过多种途径干预食管癌患者的营养不良状况,对改善患者预后有积极意义[10]。因此,对食管癌患者,特别是准备手术的食管癌患者,术前进行营养风险筛查十分必要。但如何合理进行营养风险评估、制订营养支持计划,目前尚未形成统一意见。
营养筛查工具NRS-2002是住院患者营养风险筛查的首选工具,已经被多个研究机构认证了有效性,具有较高的特异性和敏感度[11]。NRS-2002既包含了其他营养筛查工具的营养指标部分,又考虑了手术应激的影响,并采用评分的方法对营养风险程度进行量化,较其他营养筛查工具能够更好预测患者的临床结局,且操作简便、易行,平均耗时5~10 min。
蛋白质缺乏型营养不良是食管癌患者营养不良的主要表现,其中ALB、Hb是评价营养的重要指标。体重减轻可作为独立预测食管癌患者死亡的指标。体重下降意味着肌肉丢失,同时伴随全身功能减退。陈彩文等[12]研究报道,对有营养风险的食管癌患者术前进行营养支持治疗,能够改善其ALB水平,且术前营养支持并未显著增加患者的经济负担。陈燕等[13]研究也证实,对存在营养风险的患者进行个体化营养支持能够显著改善术后营养指标,与本研究结论基本一致。术前进行肠内营养支持能够避免大量静脉滴注肠外营养引起的心肺功能障碍,保证机体足够能量供应的同时食物直接经消化道吸收,有利于术后胃肠功能恢复,这可能是观察组患者术后胃肠症状少的重要原因。存在严重营养不良患者应于术前10 d给予营养支持[14]。但也有研究认为,术前过长时间的营养支持会刺激肿瘤的生长与增殖[15]。鉴于上述观点,本研究选择术前3 d进行营养支持,既有利于患者营养状态的改善,又不会增加肿瘤增殖的风险。乔汇等[16]研究指出,术前营养风险筛查及干预能够促进食管癌患者术后恢复,缩短排气时间、排便时间、住院时间和胸腔引流管拔除时间。这与观察组患者营养状态改善及术前营养支持使肠胃器官对肠内营养支持产生了一定适应性有关。营养状态差的患者机体组织生长和愈合能力差,免疫力降低。因此,术后易发生感染、切口愈合不良、吻合口瘘。程明锦等[17]研究发现,存在营养风险的食管癌患者吻合口瘘发生率增加。观察组患者经NRS-2002筛查存在营养风险,术前采用肠外营养和肠内营养相结合的营养策略,显著改善了患者的术后营养状态,因此大大减少了并发症的发生。王晓莉等[18]研究也表明,对食管癌患者术前进行营养风险筛查和干预能够减少术后并发症的发生,促进患者康复。本研究结果显示,观察组术后7 d ALB、Hb、体质量减少情况优于对照组(P<0.01);观察组术后排气时间、首次排便时间、胸管留置时间、术后住院时间短于对照组(P<0.01),术后并发症发生率低于对照组(P<0.05)。
综上所述,食管癌患者术前营养风险较高,对合并营养风险的患者给予术前营养支持,能够有效改善术后营养状态,促进术后恢复,减少并发症。

