工业碱性水电解制氢用析氧催化材料研究进展
王宇超,徐京辉,尹永利,杜逸云,殷雨田
(1.航天长征化学工程有限公司,北京 101111;2.国核电力规划设计研究院有限公司,北京 100095)
“温室效应”对人类生产、生活的影响日益严重,传统化石能源因储量有限、燃烧产生CO2,将逐步被新能源所取代。氢能因具备能量密度高、燃烧不产生CO2、储存周期长、制备方法简单及发电效率高等优点,被认为是未来主要新能源之一,逐渐受到各国的重视[1]。当前众多的制氢方法中,电解水制氢技术因原料来源广泛、制氢过程几乎不产生碳排放,以及能与新能源发电有效耦合[2],被认为是未来主流的制氢方法[3]。
自1900年施密特发明第一台工业水电解槽以来,电解水制氢技术已经历了100多年的发展,逐步发展出碱性水电解制氢(Alkaline water electrolysis,AWE)、固体聚合物电解槽制氢(Solid polymer electrolyte,SPE)和固体氧化物电解槽制氢(Solid oxide electrolyser cell,SOEC)3种技术路线[4]。其中,AWE是历史最悠久并实现工业应用的制氢技术,该技术使用Ni和Fe等储量丰富的金属作为催化材料,成本相对较低;SPE技术中的质子交换膜制氢虽已初步商业化,但其需要使用贵金属Ir和Pt作为催化材料,且设备成本高昂,而设备成本相对较低的碱性阴离子交换膜制氢技术尚不成熟;SOEC制氢技术产氢规模小,目前尚处于实验室阶段。综上,AWE因工艺成熟、设备成本低且产氢规模大,成为当前最适宜于工业化的制氢技术,并已在国内得到广泛推广应用。与SPE的高电流密度(10000~30000 A/m2)、SOEC的高制氢效率(>90%)相比,AWE的电流密度较小(<8000 A/m2)、制氢效率偏低(50%~70%),这限制了AWE的大规模工业化应用。为提高AWE的电流密度与制氢效率,一般可从结构设计及材料研发两个方面进行突破。但AWE结构经过多年的工业应用与优化,已经相对成熟,取得突破性成果的可能性较低,因此催化材料的研发成为提高AWE性能的主要途径。
AWE催化材料研发包括析氢催化材料与OER催化材料的开发。催化材料的作用是降低水电解过程中析氢反应(Hydrogen evolution reaction,HER)与析氧反应(Oxygen evolution reaction,OER)的过电位。HER为两电子转移步骤,OER为四电子转移步骤;与HER相比,OER过电位更难降低,对AWE性能提升的制约也更为明显。因此,开发高效OER催化材料是提高AWE效率的主要方向[5]。经过多年研发,OER催化材料已发展出金属氧化物[6-18]以及层状双氢氧化物(Layered double hydroxides,LDH)[19-28]两种成熟的催化材料体系,其中金属氧化物催化材料又包括钙钛矿结构[6-13]与尖晶石结构[14-18]两类。除上述两种成熟的OER催化材料体系外,研究人员近年来又开发出了金属氢氧化物、金属单原子催化材料和高熵硫化物等新结构的OER催化材料[29-33]。这些催化材料可降低OH-与材料表面的结合能,从而降低OER反应过电位,达到提高制氢效率的目的。对高性能OER催化材料的研究已有很多[34],但目前国内大规模使用的工业碱性水电解槽以传统的泡沫镍或镍网作为阳极,其OER过电位依然很高。因此,如何有效地将实验室OER催化材料研究成果应用于大规模工业制氢,就成为未来AWE技术的重点研发方向之一。
本文对当前不同类型OER催化材料进行介绍,通过对比其OER催化性能与制备方法,探讨不同类型OER催化材料的工业化应用前景。最后基于上述分析提出OER催化材料的发展趋势,从而为开发工业化AWE的OER催化材料提供参考。
1 碱性环境中的OER机理
对于电解槽制氢,一般阳极发生OER,阴极发生HER,其中,OER总反应式如下式(1)。
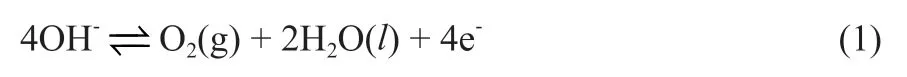
在反应中,OH-首先吸附在OER催化材料表面的活性点上,之后逐步发生电子转移,形成式(2)~式(5) 4个电子转移步骤[19,35-36]。
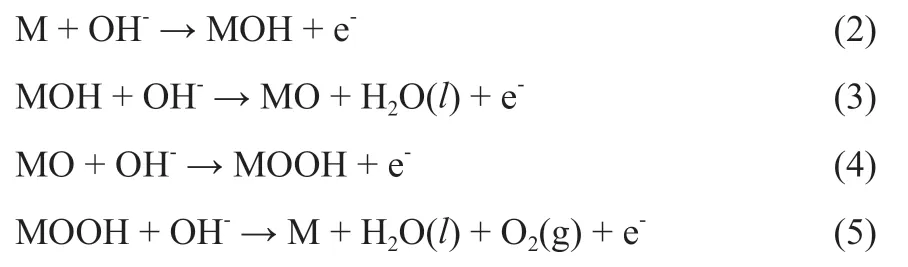
式中,M为OER催化材料的活性点。
OER过程涉及到MOH、MO和MOOH等多个中间产物的形成及分解,见图1。中间产物形成能过高时,会显著提高OER反应过电位,从而降低OER反应速率。因此,如何有效降低OER反应中间产物的形成能,进而降低析氧过电位成为当前OER催化材料研发的首要问题。
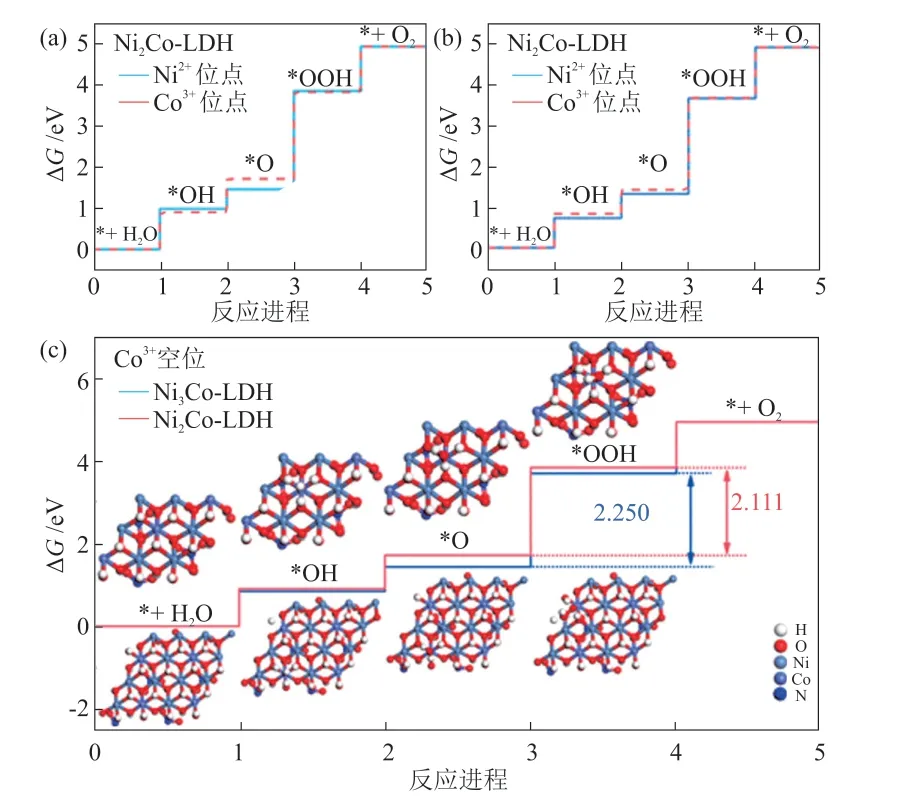
图1 Ni3Co-LDH和Ni2Co-LDH催化材料各析氧反应步骤反应电位第一性原理计算结果[19]Fig.1 DFT calculation results of OER potential of Ni3Co-LDH and Ni2Co-LDH catalytic materials[19]
2 OER催化材料
受限于质子交换膜电解制氢(Protron exchange membrane water electrolysis,PEMWE)的强酸性环境,PEMWE只能以稳定性好但价格昂贵的贵金属Ir、Ru的氧化物作为OER催化材料。对于碱性水电解槽,由于绝大部分金属在碱性环境中都具备良好的稳定性,碱性水电解槽可选用储量丰富,且价格相对低廉的Ni、Fe和Co金属材料作为OER催化材料。在OER催化材料的开发过程中,一般使用元素掺杂的方法调控OER催化材料电子结构,或在电导率高的载体上锚定OER催化材料这两种方法来提高OER催化性能[37],以满足OER催化材料活性好、比表面积大、亲水性好、导电性好、耐腐蚀性且电化学稳定性好等要求[38-39]。
经过多年发展,AWE的OER催化材料已发展出金属氧化物、LDH及其他新结构材料等类型。
2.1 金属氧化物OER催化材料
基于不同的氧化物晶体结构,金属氧化物OER催化材料可分为钙钛矿结构(ABO3)与尖晶石结构(AB2O4)催化材料。
2.1.1 钙钛矿结构催化材料开发与性能
钙钛矿结构源于CaTiO3,这类催化材料的结构通式为ABO3(Pm3m),其中A位原子为碱金属/稀土金属原子,B位原子为过渡金属原子(一般为Co、Ni、Fe和Mn等)[40-41]。在钙钛矿结构中,B位原子处于6个氧原子形成的八面体间隙中,A位原子位于8个BO6八面体结构的间隙中,并与12个氧原子形成配位结构,见图2。对于钙钛矿结构催化材料的开发,通常通过改变A、B位掺杂原子数量及类型、调整B位原子的3d轨道电子,以及增加氧空位浓度及掺杂阴离子等方式,来获取高催化活性的钙钛矿结构OER催化材料。
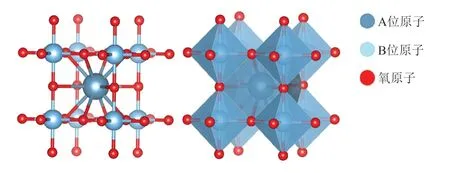
图2 钙钛矿结构OER催化材料(Pm3m)Fig.2 Perovskite structure OER catalytic materials (Pm3m)
对于改变A位原子数量,DA等[6]利用溶胶凝胶法制备了SrCoO3-δ体系,首先其通过掺杂Fe3+代替部分Co以稳定材料结构,并得到SrCoFeO3-δ(SCF),再通过调整Sr数量对氧空位数量进行调控。结果表明,适当调整A位缺陷有可能引起晶格膨胀并增加氧空位,从而有效提高材料OER催化性能。与SCF相比,S0.95CF在10 mA/cm2下的析氧过电位从415 mV降低至370 mV。OMARI等[7]利用溶胶凝胶法制备了NdFeO3,通过提高A位缺陷数量增强材料的催化性能,发现Nd0.9FeO3具备最佳的OER催化活性。XIE等[8]利用溶胶凝胶法在LaCoO3-δ(LCO)中掺杂不同数量的Pr并制备得到LaxPr1-xCoO3-δ(LPC,图3)。测试结果表明,Pr在LCO中A位掺杂,随着掺杂Pr数量的增加,LCO结构从菱形向正交菱形转变,其OER性能也随之先增加后降低。当x=0.5(LPC-50)时,LPC性能最佳,在10 mA/cm2下的析氧过电位为312 mV,优于LCO(371 mV)与PrCoO3-δ(PCO,406 mV)。

图3 LCO、LPC-50和PCO样品的表面形貌观察及元素分布分析[8]Fig.3 Morphology and elements distribution of LCO,LPC-50 and PCO[8]
优化B位原子的3d轨道电子结构亦可提升催化性能。ZHAO等[9]在LaCoO3中掺杂Sr制得La1-xSrxCoO3,发现Sr掺杂后LaCoO3的性能发生了改变。结果表明,Sr2+取代部分La3+并引起部分Co4+的形成,Co4+提高了Co 3d轨道与O 2p轨道的杂化程度,从而降低了LaCoO3的OER过电位。XU等[10]通过溶胶凝胶法制备了SrNiO3(SNO)与SrFeO3(SFO),之后将SNO与SFO通过球磨混合后置于700 °C环境中烧结5 h得到SNO@SFO异质结氧化物;实验与理论计算结果表明,异质结的形成重构了催化材料B位原子的3d轨道电子,SNO中部分Ni 3d轨道上的电子转移至SFO的Fe上,提高了SNO与SFO的催化性能;在300 mV的过电位下,SNO@SFO的质量比活性分别为SNO和SFO的2.35倍和16.44倍。
改变氧空位数量也可实现对催化材料OER性能的调控。CHEN等[11]利用溶胶凝胶法制备BaTiO3-x,然后在1300 °C下还原引入了更多的氧空位。研究发现,提升氧空位数量极大地提高了BaTiO3-x的OER催化性能,其在低于1.6 V电位下的电流密度优于IrO2。
除上述研究外,WANG等[12]通过固相反应法制备了掺杂不同S元素摩尔质量的SrCoO3-x。测试结果表明,S掺杂可促使六方钙钛矿转变为立方钙钛矿,并增加SrCoO3-x的电导率,进而提高了SrCoO3-x的OER催化性能。ZHANG等[13]利用溶胶凝胶法制备了氯离子掺杂的LaFeO3-xClx。测试结果表明,氯离子掺杂可提高催化材料的表面氧空位并降低吸附能,与LaFeO3相比,LaFeO3-xClx的OER催化性能明显增强。
对上文中部分钙钛矿结构OER催化材料的制备工艺及性能进行了总结,见表1。由表1可知,采用溶胶凝胶法、固相反应法等方法可制得性能良好的钙钛矿结构OER催化材料。在制备过程中通过优化A、B位原子、氧空位及掺杂阴离子均可有效提升材料的OER催化性能。在上述材料中,SNO@SFO的性能最佳,其在0.1 mol/L KOH溶液、10 mA/cm2电流密度下的OER过电位仅为282 mV。

表1 部分钙钛矿结构OER催化材料的制备方法与性能Table 1 Performances and preparation methods of partial OER catalytic materials of perovskite structure
2.1.2 尖晶石结构催化材料开发与性能
尖晶石结构为AB2O4(Fd3m),其中A位原子一般为碱金属过渡金属原子,处于4个氧原子形成的四面体间隙中;B位原子一般为过渡金属或13族元素原子,位于6个氧原子形成的八面体间隙中,见图4。可通过金属掺杂、离子替代和催化材料结构调整等方式来改善尖晶石结构OER催化材料的性能。

图4 尖晶石结构OER催化材料(Fd3m)Fig.4 Spinel structure OER catalytic materials (Fd3m)
赵强等[14]采用共沉积法制备了NiCo2O4,测试结果表明,NiCo2O4的OER催化性能随Ni元素摩尔质量增加而降低。HUANG等[15]合成了多金属尖晶石氧化物纳米盒,并实现了阳离子的可控调节,其具有良好的电催化性能,在10 mA/cm2电流密度下,OER过电位仅为274 mV。方晗等[16]在NiCo2O4中掺杂Mn,并在1 mol/L KOH环境中测试,结果表明,Mn掺杂后,NiCo2O4在10 mA/cm2下的OER过电位从323 mV降低至300 mV。YUE等[17]利用湿化学法将MoFe2O4与CoFe2O4负载在泡沫铁上,在N2气氛中400 °C热处理制备了MCFO NS/IF,通过空位锚固的方法将Fe随机填充进八面体间隙,明显提高了催化材料的OER催化性能,在500 mA/cm2的电流密度下过电位仅为290 mV。叶蓉蓉等[18]利用水热法在三维骨架上制备了MnCo2O4,测试结果表明,自分叉型催化材料在10 mA/cm2电流密度下具有300 mV的OER过电位。
表2对上述尖晶石结构OER催化材料的制备方法与性能进行了总结。可见制备尖晶石结构OER催化材料的方法包括共沉淀法、水热法等。其中,以湿化学法制备的MCFO NS/IF的OER催化性能最好,其在1 mol/L KOH电解液中、500 mA/cm2的电流密度下OER过电位仅为290 mV。

表2 部分尖晶石结构OER催化材料的制备方法与性能Table 2 Performances and preparation methods of partial OER catalytic materials of Spinel structure
2.2 LDH类OER催化材料
LDH为层状结构(图5),具有层板组成多样且富含羟基、层间客体可调、合成成本较低和原料来源丰富等优点[20],被认为是一种良好的OER催化材料,受到了广泛研究。传统的LDH合成方法包括水热法、共沉淀法以及电沉积法,但上述方法依然较为复杂,且制备得到催化材料孔隙率较低。因此,最近研究者又引入了刻蚀法,以进一步简化催化材料制备方法,并提高材料孔隙。但在LDH合成过程中,容易出现层板堆叠造成LDH纳米片变厚,导致催化材料活性位点减少、导电性能变差,进而OER过电位升高。为提高LDH的催化性能,通常可采用的策略包括减小LDH纳米片厚度、形貌调控、掺杂及与导电材料有效复合等[21]。
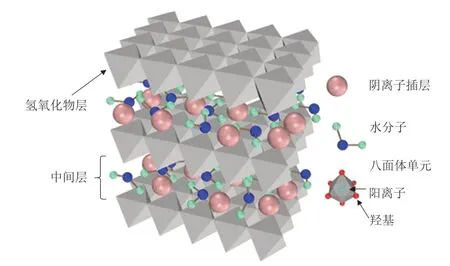
图5 LDH的结构[22]Fig.5 Structure of LDH[22]
ZHU等[23]将NiFeCo-LDH原位电沉积至泡沫镍上得到Ni2.5Co0.5Fe/NF电催化材料,发现该催化材料具有丰富的活性位点及超疏气结构,可有效降低OER过电位,在1 mol/L KOH中,当电流密度为10 mA/cm2时,Ni2.5Co0.5Fe/NF的OER过电位仅为275 mV。ZHOU等[24]依据不对称梯度效应,利用水热法在泡沫镍上生长纳米级NiFe-LDH,研究表明,不对称梯度效应增加了活性位点浓度以及催化材料的结合强度,从而提高了催化性能。郭文君等[25]利用水热法制备了NiCoFe-LDH,并在1 mol/L KOH溶液中测试其电催化性能,结果表明,引入适量的Fe可增加金属间的协同作用、提高材料表面粗糙度、增加缺陷浓度,从而增强材料的OER催化性能。当电流密度为120 mA/cm2时,NiCoFe-LDH的OER过电位仅需200 mV。
近年来,研究人员利用刻蚀法制备了多种LDH类OER催化材料。ZHAO等[26]通过腐蚀刻蚀方法将NiFe-LDH生长在泡沫铁上,制备了NiFe-LDH@IF,研究表明,该方法可通过改变NiFe-LDH上活性位点(FeOOH)密度与Ni/Fe比例来优化催化材料性能。NiFe-LDH@IF-200-72催化材料在100 mA/cm2下的OER过电位仅为209 mV。LI等[27]利用一步液相刻蚀法在泡沫镍上合成了NiFe-LDH,该方法具有制备工艺简单,催化材料与基体结合力强、催化活性点多的优势。获得的NF/NiFe-LDH-1.5-4样品在100 mA/cm2电流密度下的OER过电位仅为190 mV。XIN等[28]先利用电沉积法在泡沫镍上制备LDH结构的NiFeCr/NF样品,之后利用刻蚀法溶解NiFeCr/NF上的部分Cr,并最终得到多孔NiFeCr/NF(holey-NiFeCr/NF,h-NiFeCr/NF),见图6。对比NiFeCr/NF样品与h-NiFeCr/NF可知,刻蚀后的NiFeCr/NF样品OER催化性能提高,与NiFeCr/NF相比,其在100 mA/cm2电流密度下的OER过电位从295 mV降低至260 mV。

图6 NiFeCr/NF (a)和h-NiFeCr/NF (c)的HRTEM图像及NiFeCr/NF (b)和h-NiFeCr/NF (d)的TEM-EDS面扫图像[28]Fig.6 HRTEM images of NiFeCr/NF (a) and h-NiFeCr/NF (c) and EDS maps of NiFeCr/NF (b) and h-NiFeCr/NF (d)[28]
表3总结了部分LDH结构OER催化材料的制备工艺及性能。由表3可知,利用电沉积法、水热法与刻蚀法均可制备性能良好的LDH催化材料,其中,刻蚀法可有效提升LDH催化性能。在LDH材料中,利用刻蚀法制备的NiCoFe-LDH与NF/NiFe-LDH的OER催化性能相对较好,其在1 mol/L KOH中,100 mA/cm2电流密度下的OER过电位均小于200 mV。综合对比LDH结构与金属氧化物OER催化性能,可观察到LDH材料OER催化普遍优于除MCFO NS/IF外的金属氧化物。

表3 部分LDH结构OER催化材料性能Table 3 Performances of partial OER catalytic materials with LDH structure
2.3 其他OER催化材料
随着氢能行业的发展,又出现了许多新的催化材料,包括金属单原子电极、金属氢氧化物电极、高熵合金以及双功能催化材料等。这些新材料可显著降低OER过电位,但目前仍处于实验室研究阶段。
对于金属单原子电极,LEI等[29]通过在Ni3-xFexS2上电沉积Ir单原子获得了Ir1/NFS电催化材料,并在1 mol/L KOH中测试了催化材料的OER催化性能;实验测试与DFT计算结果表明,样品中Ir-S配位的形成可有效提高电极的OER催化性能,在10 mA/cm2电流密度下,Ir1/NFS的OER过电位仅为170 mV。NGUYEN等[30]采用两步溶剂热法合成高熵硫化物FeNiCoCrXS2(X=Mn、Cu、Zn或Al),性能略低于Ir1/NFS,当X为Mn时,其在1 mol/L KOH电解液中的OER过电位为199 mV。
与上述两种材料相比,金属氢氧化物电极的OER催化性能略低于贵金属单原子与高熵硫化物,但制备方法却更为简单。李玉平等[31]将不锈钢网在不同浓度Ni2+溶液中浸泡,制备了镍金属氢氧化物电极(SS/Ni-OH);测试结果表明,浸泡后电极OER催化性能明显提高,在1 mol/L KOH中,产生10 mA/cm2电流密度的OER过电位为214 mV。过渡金属掺杂到MoS2中也可制得性能良好的OER催化材料。WANG等[32]通过一步水热法将过渡金属(Ni、Co和Fe)掺杂到MoS2(1T-MoS2)中,结果表明,Ni掺杂的1T-MoS2在1 mol/L KOH中具有最佳OER催化性能,在10 mA/cm2电流密度下的过电位为224 mV。除上述材料外,王天河等[33]基于双金属模板,通过水热硒化过程合成了双金属NiFe硒化物。测试结果表明,NiFe硒化物具有良好OER催化性能,驱动10 mA/cm2电流密度的OER过电位仅为297 mV,OER催化性能相对最低。
表4总结了其他方法制备OER催化材料的制备方法及性能。由表4可知,贵金属单原子Ir1/NFS的OER催化性能最佳,其在1 mol/L KOH、10 mA/cm2电流密度下的OER过电位为170 mV;水热硒化法制备得到的Ni0.67Fe0.33Se电极OER催化性能最低,其在相同测试条件下的OER过电位为297 mV。利用溶液浸渍法得到的SS/Ni-OH2M-120s,OER催化性能介于Ir1/NFS与Ni0.67Fe0.33Se之间,但考虑到溶液浸渍法工艺简单的优点,其在大规模工业化AWE中具备一定的应用潜力。

表4 其他类型OER催化材料性能Table 4 Performances of OER catalytic materials with other structures
3 OER催化材料工业化应用要求
氢能行业已进入快速发展阶段,以AWE为代表的制氢方法正日益受到工业界的重视。除传统的中船718研究院等企业外,近年来,国富氢能、隆基氢能和氢氢松松等新兴企业也纷纷涉足AWE领域。随着氢能需求的快速增加,碱性水电解槽未来将向增大有效电解面积、提高制氢效率、增加电流密度以及延长电解槽寿命等方向发展。而作为影响电解槽寿命与制氢效率的主要因素,OER催化材料的研究也需契合碱性水电解槽的发展方向。
符合碱性水电解槽工业应用的OER催化材料应满足以下几方面要求:(1)材料成本低、合成工艺简单。考虑到产业化后的成本,碱性水电解槽OER催化材料应具备原料来源广、储量高,制备工艺相对简单的特点。(2)制备设备可大型化。当前1000 m3/h(标准状况)规模的碱性水电解槽极板直径为1.8~2.0 m,OER催化材料制备设备需满足上述尺寸要求。(3)催化性能好、OER过电位低。开发OER催化材料,降低其OER过电位,以提高制氢效率、降低能耗,从而降低制氢成本。(4)材料稳定性好。一般工业用碱性水电解槽的寿命在10年以上,因此要求催化材料与基体结合牢固,且耐腐蚀,从而确保设备在长时间运行过程中的稳定性。
以MCFO NS/IF[17]、NiFe-LDH@IF[26]、NF/NiFe-LDH[27]和SS/Ni-OH2M-120s[31]为代表的OER催化材料具备良好催化性能。其中,MCFO NS/IF的制备过程较为复杂;NiFe-LDH@IF及NF/NiFe-LDH的制备方法简单、催化性能好,具有工业化应用前景,但其稳定性需要进一步提升,且使用寿命也需得到长期验证;以SS/Ni-OH2M-120s为代表的其他结构催化材料,具备原材料易于获取、制备工艺简单和催化性能良好的优点,工业化应用潜力大,但其寿命及性能尚未得到工业化应用的验证。与上述材料相比,其他OER催化材料或合成工艺复杂、或制作成本高、或催化性能较差,不能满足工业化应用要求,需从催化材料、结构调控和制备方法等方面进行改进。
4 结语与展望
在当前氢能行业快速发展的背景下,AWE具备良好的应用前景,但较低的制氢效率制约了其发展,而OER催化材料是影响制氢效率主要因素之一。目前析氧催化材料包括金属氧化物、LDH与其他结构3类,其中金属氧化物催化材料按结构类型又可划分为钙钛矿结构与尖晶石结构。钙钛矿结构析氧催化材料以SNO@SFO的催化性能最好,其在0.1 mol/L KOH电解液中,10 mA/cm2电流密度下的OER过电位仅为282 mV。尖晶石结构OER催化材料中的MCFO NS/IF具备最佳催化性能,其在1 mol/L KOH电解液中,500 mA/cm2电流密度下的OER过电位仅为290 mV。LDH的OER催化性能普遍高于金属氧化物催化材料,NiCoFe-LDH与NF/NiFe-LDH在200 mVOER过电位下的电流密度均高于100 mA/cm2。其他新材料亦具备良好的OER催化性能,如贵金属单原子催化材料Ir1/NFS在10 mA/cm2电流密度下的OER过电位为170 mV。
上述材料在大规模工业化应用中尚存不足。金属氧化物催化材料的OER催化性能相对低于LDH。MCFO NS/IF虽具良好的OER催化性能,但其在400 °C氮气环境中烧结制成,而国内1000 m3/h规格碱性水电解槽极板直径为1.8~2.0 m,故制备相对困难。LDH具有良好的催化性能,但电解槽一般寿命长达8年,其稳定性需得到进一步验证。贵金属单原子Ir1/NFS催化材料OER催化性能良好,但价格昂贵,其工业化会显著增加设备成本。基于上述不足,未来工业化OER催化材料需具备OER催化性能好、材料成本低、合成难度低、材料稳定性好以及制备设备可大型化的特点。

