腹透液中中性粒细胞明胶酶相关载脂蛋白联合白细胞介素6 对腹透相关性腹膜炎预测价值
庄乙君, 陈 文, 云曼丽, 钟业腾, 林 叶, 李 军, 李 飞, 汪水连, 韩淑苗
海南医学院第二附属医院1.肾内科;2.检验科,海南 海口 570311;3.海南医学院 研究生学院,海南 海口 570100
腹膜透析(peritoneal dialysis,PD)是终末期肾病患者的主要替代治疗方式之一,但PD 的实施存在长期留置透析管、反复换液及部分患者操作欠规范等问题,易引起腹透相关性腹膜炎(peritoneal dialysis related peritonitis,PDRP)[1]。有研究报道,单次腹膜炎会明显损害腹膜功能,而频发的腹膜炎会导致腹膜失功、透析效能下降,甚至危及生命[2-3]。既往临床多通过监测腹透液C 反应蛋白(C-reactive protein,CRP)、腹透液致病微生物等对PDRP 进行评估,但CRP 的特异性较差,而PDRP 的致病菌较多,可通过腹透液涂片或培养进行确定,但疾病早期的致病菌培养结果无法及时得到,且部分腹膜炎患者致病菌培养结果为阴性,影响患者治疗及预后评估[4]。 白细胞介素6(interleukin-6,IL-6)是细胞间传递信号的细胞因子,PD 患者发生腹膜炎时,腹膜的单核巨噬细胞产生IL-6,并集聚白细胞[5]。 中性粒细胞明胶酶相关载脂蛋白(neutrophil gelatinase associated lipocalin,NGAL)是一种分泌性糖蛋白,是PDRP 的新型标志物[6]。 目前,有关腹透液中IL-6 联合NGAL 预测PDRP 的研究少见报道。 本研究旨在探讨腹透液中NGAL 联合IL-6 对PDRP 的预测价值。现报道如下。
1 资料与方法
1.1 一般资料 选取自2019 年1 月至2020 年12 月海南医学院第二附属医院肾内科收治的88 例行PD 的患者为研究对象。 纳入标准:(1)行PD 并规律随访者;(2)年龄>18 岁者;(3)腹透置管手术>90 d 者。 排除标准:(1)既往腹部手术史者;(2)长期服用免疫抑制剂者;(3)腹膜腔外局部或全身感染者;(4)腹膜炎发作后于外院用药治疗者。 根据是否发生PDRP[7]将患者分为PDRP 组(n =27) 和非PDRP 组(n =61)。 PDRP 组中,男性15 例,女性12 例;平均年龄(47.40 ±6.37)岁;平均体质量指数(22.14 ±1.85)kg/m2;平均透析时间(20.68 ±3.83)个月;原发病:肾小球肾炎14 例,糖尿病肾病9 例,其他4 例。 非PDRP 组中,男性30 例,女性31 例;平均年龄(45.95 ±5.82)岁;平均体质量指数(21.79 ± 1.76) kg/m2; 平 均 透 析 时 间(18.52 ±3.70)个月;原发病:肾小球肾炎33 例,糖尿病肾病20 例,其他8 例。 两组患者性别、年龄、体质量指数、原发病比较,差异无统计学意义(P > 0.05)。 PDRP 组透析时间长于非PDRP 组,两组比较,差异有统计学意义(P<0.05)。 本研究获得医院伦理委员会批准。 患者及家属均签署知情同意书。
1.2 研究方法 入院即刻抽取患者肘正中静脉血5 ml 及首袋留腹时间>4 h 的腹透液。 对疑诊为PDAP 的患者用血培养瓶(需氧瓶和厌氧瓶)留取腹透液约20 ml 送检培养,所有标本均由医院检验科统一检测。 血标本常温放置30 min后3 000 r/min 离心10 min,留取上清液置于-20℃下保存待测。 全自动分析仪检测血白细胞计数(b-white blood cell,b-WBC),酶联免疫吸附法检测血CRP(b-CRP)、血IL-6(b-IL-6)。 无菌管收集10 ml 腹透液,2 h 内于3 000 r/min 下离心20 min,留取上清液于-20℃下保存。 使用手工显微镜镜检腹透液白细胞计数(p-white blood cell,p-WBC),采用酶联免疫吸附法检测腹透液IL-6(p-IL-6)、腹透液CRP(p-CRP)、腹透液NGAL(p-NGAL)。
1.3 统计学方法 采用SPSS 19.0 统计学软件处理数据。计量资料用均数±标准差(±s)表示,组间比较采用t 检验;计数资料用例(百分率)表示,组间比较采用χ2检验。 采用多因素Logistic 回归分析确定PD 患者发生PDRP 的影响因素。构建PDRP 评分预测模型,绘制受试者工作特征(receiver operating characteristic,ROC)曲线分析各指标及PDRP 评分预测模型对PDRP 的预测价值。 以P <0.05 为差异有统计学意义。
2 结果
2.1 两组患者实验室指标比较 PDRP 组b-WBC、b-CRP、b-IL-6、p-WBC、p-CRP、p-IL-6、p-NGAL 水平 均 明显高 于非PDRP 组,两组比较,差异有统计学意义(P <0.05)。 见表1。
2.2 多因素Logistic 回归分析 多因素Logistic 回归分析发现,b-CRP、p-CRP、p-IL-6、p-NGAL 是PDRP 的影响因素(P<0.05)。 见表2。
表1 两组患者实验室指标比较(±s)

表1 两组患者实验室指标比较(±s)
组别 b-WBC/个·L-1b-CRP/mg·L-1 b-IL-6/pg·ml-1p-WBC/个·L-1p-CRP/mg·L-1 p-IL-6/pg·ml-1 p-NGAL/ng·ml-1 PDRP 组 (7.15±1.17)×10932.55±5.12 365.71±37.88 (911.72±122.52) ×1063.27±0.53 124.59±14.15 225.61±41.72非PDRP 组 (5.47±1.04)×1091.82±0.26 182.95±32.54 (18.78±3.73)×1061.76±0.39 18.79±4.23 26.82±5.04 t 值 6.724 47.084 23.090 57.282 14.946 53.565 47.930 P 值 <0.05 <0.05 <0.05 <0.05 <0.05 <0.05 <0.05

表2 多因素Logistic 回归分析
2.3 各指标诊断PDRP 的ROC 曲线 b-CRP、p-CRP、p-IL-6、p-NGAL 诊断PDRP 的曲线下面积分别为0.778、0.815、0.852、0.889,最佳截断值分别为20.85 mg/L、2.57 mg/L、94.36 pg/ml、 128.68 ng/ml, 敏 感 度 分 别 为 78.41%、80.68%、 85.23%、 87.50%, 特 异 度 分 别 为 76.14%、77.27%、80.68%、81.82%。 见图1。
2.4 评分预测模型对PDRP 的预测价值 评分预测模型构建:b-CRP>20.85 mg/L 为1 分,p-CRP>2.57 mg/L 为1 分,p-IL-6 > 94.36 pg/ml 为1 分,p-NGAL > 178.68 ng/ml 为1 分,总分0 ~5 分,0 ~1 分为低危,2 ~3 分为中危,4 ~5 分为高危。 以评分预测模型总分作为自变量,以是否发生PDRP 作为因变量绘制ROC 曲线。 结果显示,ROC 曲线下面积为0.923(95% 可信区间0.794 ~ 0.995),以4 分为最佳临界值,敏感度和特异度分别为92.6% 、88.5% ,Hosmer-Lemeshow 拟合优度检验r =4.2,P =0.468。 见图2。
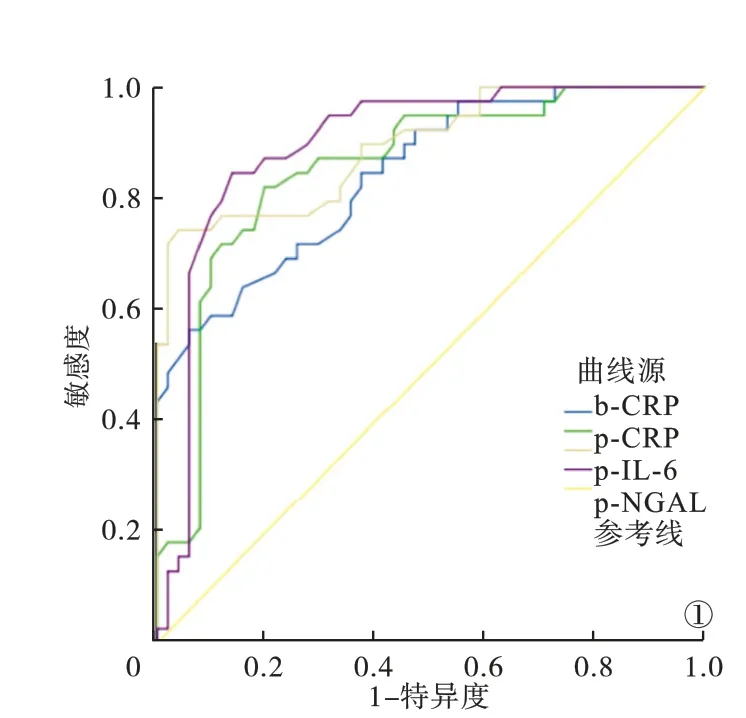
图1 各指标诊断PDRP 的ROC 曲线

图2 PDRP 评分预测模型预测PDRP 的ROC 曲线
3 讨论
PDRP 是PD 的严重并发症,持续PDRP 可能引发腹膜衰竭和腹膜纤维化,严重时可造成腹透失败及死亡。 由于PDRP 诊断的不确定性且缺乏验证性治疗方向,积极寻找诊断PDRP 的更高敏感度及特异度的标记物成为肾病的研究热点之一[8]。 本研究88 例PD 患者中,PDRP 发生率为30.68%(27/88),b-CRP、p-CRP、p-IL-6、p-NGAL 是PDRP 的影响因素。 白细胞计数是诊断PDRP 的常用指标,但部分腹膜炎患者的腹透超滤量较小,腹透液中白细胞计数受到限制[9]。 此外,并非所有PDRP 患者均会出现腹痛等腹膜炎症状和体征。 因此,仅凭腹透液浑浊程度和腹膜炎症状与体征诊断PDRP 存在一定局限性,且p-WBC 的检测依赖于人手工显微,存在主观偏倚,这可能是p-WBC 未能入选PDRP 影响因素的主要原因[10]。
有研究发现,PDRP 患者的b-CRP、p-CRP 均异常升高,且可作为PDRP 短期、长期预后的评估指标之一,持续b-CRP、p-CRP 升高往往提示预后不良[11]。 而另有研究认为,对于PD 患者,b-CRP、p-CRP 会随着肾功能恶化而进行性升高,且合并其他部位感染或心血管等其他系统并发症者的b-CRP、p-CRP 也会异常升高,使得b-CRP、p-CRP 诊断PDRP 的敏感度较高,但特异度不足[12]。
有研究发现,机体感染后,IL-6 的变化早于CRP 等指标,是诊断PDRP 的新型标志物[13]。 本研究结果显示,p-IL-6是PDRP 的影响因素,但b-IL-6 并未入选,考虑与外伤、自身免疫性疾病、其他部位感染等原因也会引起b-IL-6异常升高有关。 而p-IL-6 的变化不会受上述因素的影响,仅与腹透患者腹腔内炎症有关。 NGAL 是由中性粒细胞分泌的促炎因子,存在于过氧化物酶-中性粒细胞的颗粒中,可反馈性激活中性粒细胞释放更多的NGAL,是中性粒细胞形成的标志,参与机体炎症趋化和免疫应答等生理过程[14-15]。正常生理状态下,NGAL 在人体内表达水平极低,在急性反应时中性粒细胞受到炎症因子趋化作用后在感染部位聚集,释放各种溶酶体酶及NGAL 等,使p-NGAL 异常升高[16-17]。PDRP 会促使腹膜间皮细胞持续合成并分泌NGAL,使其发挥生物学效应,且p-NGAL 与PDRP 严重程度有关,这是p-NGAL成为PDRP 新型标志物的主要原因。 国外研究认为,IL-6 与NGAL 诊断PDRP 有较高的敏感度与特异度,在PDRP 发生早期(数小时内)即显著升高,且不受其他非腹膜因素影响,特异度较高,可反映腹膜的病生理改变[18]。 但NGAL 局限于细菌性腹膜炎,而IL-6 浓度会受到生物不相容性透析液、氧化应激等的影响,使得IL-6 与NGAL 也存在自身不足。
本研究基于Logistic 回归分析,用b-CRP、p-CRP、p-IL-6、p-NGAL 这4 项指标构建PDRP 的预测模型,采用该模型预测PD 患者PDRP 的ROC 曲线下面积达0.923,以4 分为最佳临界值的敏感度和特异度分别为92.6%和88.5%,提示当模型评分≥4 分时发生PDRP 的风险较高。 通过回归分析筛选出的PDRP 影响因素构建的评分模型包括4 项指标,可弥补既往b-CRP、p-CRP 诊断PDRP 特异度偏低的不足,同时IL-6 联合NGAL 也可以避免细菌性腹膜炎、生物不相容性透析液等的局限,利用不同标志物在诊断上的互补性获得更高的敏感度与特异度。 因此,评分模型对PDRP 有较高的预测效能,同时也提示p-NGAL 联合p-IL-6 对PDRP 的诊断有一定的临床价值,在常规CRP 指标的基础上可作为新型标志物对PD 患者的PDRP 风险进行预测。 动物研究表明,p-NGAL 浓度在腹膜炎发生后的第一天就显著增高,且与CRP、白细胞计数相关[19]。 中性粒细胞受到炎症刺激后会快速释放NGAL,而当炎症消退时NGAL 的释放也会快速减少。 因此,NGAL 在中性粒细胞依赖的PDRP 中变化尤为明显[20]。
综上所述,b-CRP、p-CRP、p-IL-6、p-NGAL 是PD 患者PDRP 的影响因素,基于b-CRP、p-CRP、p-IL-6、p-NGAL 的评分模型有利于对PD 患者PDRP 发生风险进行预测。 本研究存在不足:(1)目前NGAL 的测定多采用酶联免疫吸附法,敏感度与特异度高、重复性好,但p-NGAL 的检测尚无统一的方法,因此本研究仍采用酶联免疫吸附法检测p-NGAL;(2)受患者依从性较差、腹透液收集较困难等因素影响,本研究未能监测PD 患者p-NGAL 的动态变化,有待后续完善;(3)p-NGAL 参与腹膜炎纤维化及腹膜炎症的机制仍需进一步研究。

