高压氧辅助丁苯酞治疗急性缺血性脑卒中患者的应用
方斌 张碧蘅
(1 九江市第一人民医院,江西 九江 332000;2 九江学院附属医院,江西 九江 332000)
急性缺血性脑卒中(acute ischemic stroke,AIS)属于脑血管疾病,该病在中老年人群中有着较高的发病率,在疾病发作期间,病情变化迅速,而且进展快速,有着极高的发病率和致死率,严重威胁着患者的生命安全[1]。近些年来,全球老龄化趋势严重,使得AIS的患病人数和死亡人数不断增加。AIS在发病时,患者的脑动脉处于狭窄和闭塞的状态,导致脑部组织受到影响,处于缺血缺氧状态,机体内的氧化反应随之加快,使得毒性物质不断生成,进而对脑组织产生不良影响,使其出现坏死和凋亡,神经功能不断降低,严重影响了细胞功能和代谢[2-3]。目前,临床对于AIS患者主要采取静脉溶栓治疗,疗效得到验证,但是这种治疗方法具有较大的局限性,对时间窗有着严格的要求,故并不适用于所有患者[4]。因此,还需要寻找更加合适的治疗方案。丁苯酞属于脑神经保护药物,该药是一种新型药物,在AIS患者的治疗中具有较为确切的疗效,具有较好的抗脑缺血作用,能够促进脑血管微循环,改善局部缺血缺氧状态,使细胞能量代谢功能得以提高[5]。高压氧治疗是在高压环境下对患者进行治疗,通过增加氧气溶解量,氧分子能够进入到脑部区域,从而使血氧组织得到充足的氧分子,进而缓解了细胞缺氧状态[6]。有研究证实,在AIS患者的治疗中,采用高压氧辅助治疗能够进一步提高临床疗效[7]。但是目前临床对于高压氧辅助丁苯酞治疗AIS的研究相对少见,还需要作进一步探究。鉴于此,本次研究选取我院收治的AIS患者展开分析,在治疗中予以高压氧辅助丁苯酞治疗,观察具体应用效果,内容阐述如下。
1 资料与方法
1.1 一般资料 选取我院在2020年1月至2022年1月收治的86例急性缺血性脑卒中患者展开分析,按照随机数字表法,将86例患者分为观察组与对照组,单组样本量为43例。观察组:男性25例,女性18例;最小年龄、最大年龄分别为44岁、80岁,平均年龄(60.27±5.90)岁;发病至入院最短时间、最长时间分别为3 h、9 h,平均时间(5.86±0.81)h;梗死位置:脑干或小脑、皮下层、皮层、皮层和皮下层分别为7例、17例、15例、4例;合并症:高血压、冠心病、糖尿病分别为22例、9例、12例。对照组:男性24例,女性19例;最小年龄、最大年龄分别为45岁、79岁,平均年龄(60.18±5.86)岁;发病至入院最短时间、最长时间分别为3 h、10 h,平均时间(5.97±0.92)h;梗死位置:脑干或小脑、皮下层、皮层、皮层和皮下层分别为6例、18例、14例、5例;合并症:高血压、冠心病、糖尿病分别为21例、8例、14例。对比两组患者的一般资料,纳入统计学软件中进行分析计算,得出的各项结果均无统计学差异(P>0.05),具有可比价值。患者的临床资料完整,在知情同意书上签字,所有调查对象的临床资料递交伦理委员会审核并获得批准。
纳入标准:①所有患者符合《中国急性缺血性脑卒中诊治指南2018》中有关急性缺血性脑卒中的相关诊断标准。②患者在入院以后,采取MRI或者颅脑CT检查,均诊断为急性缺血性脑卒中,并且其脑功能缺损体征持续超过30 min。③在研究开始前,已向患者及其家属详细介绍了试验的有关内容,在取得其同意并签字的情况下,方才执行操作。④本次研究在我院伦理部门的批准下执行。
排除标准:①合并肝肾等重要器官功能障碍。②合并血液系统疾病。③合并恶性肿瘤。④对高压氧治疗不耐受。⑤对本次研究所需使用到的药物存在过敏反应。
1.2 方法
两组患者在入院治疗期间,均给予急性缺血性脑卒中常规治疗,采取抗血小板聚集、静脉溶栓、清除自由基和神经保护等对症治疗。
对照组:患者在接受治疗期间,给予丁苯酞氯化钠注射液(生产厂家:石药集团恩必普药业有限公司;批文字号:国药准字H20 100041;产品规格:100 mL)治疗,给药途径为静脉注射,并控制输注速度,以100 mL/12 h为宜,每次的输注时间不低于50 min。
观察组:患者给予高压氧辅助丁苯酞治疗,丁苯酞的使用方法与对照组相同,使用高压氧舱(烟台豪特氧业设备有限公司)治疗,仪器的型号为NC280~900,将高压氧舱的压力值进行调整,以0.2 MPa为宜,升压20 min,稳压吸氧时间为60 min,之后间隔10 min,将高压氧舱内的空气吸出,减压20 min,直到正常压力状态下出舱,治疗频率为每日1次。两组均需持续治疗2周。
1.3 观察指标
1.3.1 比较两组患者在治疗前后的神经功能和认知功能改善情况 分别采用美国国立卫生研究院卒中量表(NIHSS)和简易智力状况检查法(MMSE)来对两组患者治疗前后的神经功能和认知功能进行评估。NIHSS、MMSE量表的总分值分别为42分、30分,NIHSS得分越高即代表了患者的神经功能受损越严重,而MMSE量表分值越低即代表了认知功能受损越严重。
1.3.2 比较两组的临床疗效 根据患者治疗前后的NIHSS、MMSE评分进行评估,共分为了3个等级,经过治疗后,患者的临床症状改善明显,并且NIHSS降低幅度和MMSE上升幅度均超过了70%即为显效;临床症状有所减轻,NIHSS降低幅度和MMSE上升幅度在30%~70%以内即为有效;未达上述标准即为无效。显效率和有效率之和即为总有效率。
1.3.3 比较两组患者治疗前后的血清水平 采集两组患者治疗前和治疗后的空腹静脉血,抽取样本量为3 mL,将标本静置30 min,然后将其放置于离心机下进行离心处理,离心速度和时间分别为3 000 r/min、5 min,将离心后的上层清液取出,测定标本中的ET-1(人内皮素1)、TXB2(人血栓素B2)和VEGF(血管内皮生长因子)水平,前两项采用放射免疫法进行测定,后一项采用双抗体夹心法进行测定。
1.3.4 对比两组治疗前后的凝血功能 记录两组患者在治疗期间的TT(凝血酶时间)、PT(凝血酶原时间)和APTT(活化部分凝血酶时间)。
1.3.5 对比两组治疗前后的血液流变学指标 分别于治疗前和治疗后对两组患者的纤维蛋白原、红细胞压积以及全血黏度进行测定,采用全自动血流变分析仪对上述指标进行测定。
1.3.6 对比两组在治疗期间的不良反应发生情况 记录两组发生腹部不适、恶心呕吐、头晕的例数。
1.4 统计学方法 采用SPSS21.0分析,计量资料以(±s)表示,经t检验,计数资料经χ2检验,以(%)表示,差异有统计学意义为P<0.05。
2 结果
2.1 比较两组患者在治疗前后的神经功能和认知功能改善情况 观察组和对照组的NIHSS评分在治疗前分别为(18.05±2.70)分、(17.97±2.82)分,MMSE评分分别为(13.15±1.57)分、(13.20±1.4 9)分,两组的数据作比较,并无显著差异(t=0.134、0.151,P=0.893、0.880);在治疗后观察组和对照组的NIHSS评分分别为(9.13±1.74)分、(13.75±2.03)分,MMSE评分分别为(18.26±2.43)分、(16.47±2.05)分,两组数据较治疗前有了明显差异,结果有统计学意义(P<0.05),并且治疗后上述指标观察组与对照组比较有显著差异,NIHSS评分对照组更高,而MMSE评分则是观察组更高,差异均有统计学意义(t=11.331、3.692,P=0.000、0.000)。
2.2 比较两组的临床疗效 观察组与对照组患者在经过对应措施治疗以后,从两组的临床疗效分析有明显差异,总有效率分别为95.35%、81.40%,观察组要显著高于对照组,差异有统计学意义(P<0.05)。见表1。
2.3 比较两组患者治疗前后的血清水平 两组治疗前ET-1、TXB2、VEGF水平比较差异无统计学意义(P>0.05);治疗后观察组与对照组的ET-1、TXB2、VEGF水平均较治疗前更优,且观察组优于对照组,差异有统计学意义(P<0.05)。见表2。
表2 对比两组患者治疗前后的血清水平(ng/L,±s)
2.4 对比两组治疗前后的凝血功能 治疗后观察组与对照组TT、PT、APTT指标水平较治疗前升高,且观察组明显高于对照组,差异有统计学意义(P<0.05)。见表3。
表3 对比两组治疗前后的凝血功能(s,±s)
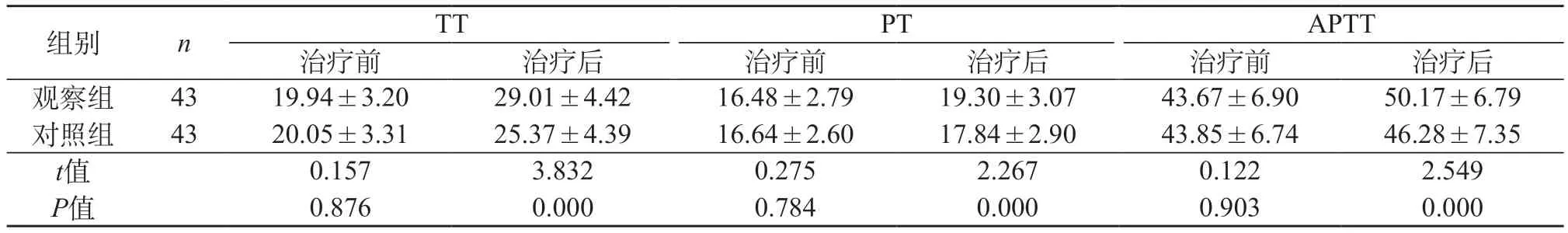
表3 对比两组治疗前后的凝血功能(s,±s)
2.5 对比两组治疗前后的血液流变学指标 治疗后观察组与对照组纤维蛋白原、红细胞压积以及全血黏度指标水平较治疗前均下降,且观察组低于对照组,差异有统计学意义(P<0.05)。见表4。
表4 对比两组治疗前后的血液流变学指标(±s)
2.6 对比两组在治疗期间的不良反应发生情况 观察组与对照组患者在接受治疗期间,均有患者出现不良反应,观察组有患者出现头晕和腹部不适,例数分别为2例、1例,总发生率为6.98%,而对照组有患者出现恶心呕吐和头晕,例数分别为1例、1例,总发生率为4.65%,从数据能够看出,两组在不良反应发生率方面进行比较,并无显著差异(χ2=0.212,P=0.645)。
3 讨论
AIS是临床常见的急危重症疾病,该病主要是由于患者的脑血压供应出现了障碍,使得脑部血压供给不足,脑组织处于缺血缺氧状态,从而引起脑组织缺血性坏死,并且该病呈进行性发展,随着病情发展,将会对患者的神经功能造成严重损伤。若是患者在病情发作后,未能及时接受有效治疗,不仅会使患者的神经功能受损严重,并且还会对患者的肢体和语言功能产生严重不良影响,进而使患者的生活质量不断下降[8-9]。有研究发现,对于AIS患者在治疗中,改善患者的脑组织缺血缺氧状态,建立侧支循环对其受损神经细胞功能恢复有着非常深刻的意义[10-11]。因此,在该病的临床治疗中,应当以改善脑组织缺血,促进侧支循环建立为重点,选择安全有效的治疗方案,以改善患者的临床症状。
本次研究结果显示,治疗后观察组的NIHSS评分和MMSE评分均优于对照组,由此可知,在AIS患者的治疗中,在丁苯酞治疗的基础上采用高压氧辅助治疗AIS患者,能够改善患者的临床症状,对病情恢复有帮助。丁苯酞主要是从芹菜籽中提取的,该药对于线粒体功能有着良好的改善作用,并且能够减少机体内谷氨酸等的释放,具有抗血小板聚集功效,有效缓解血管痉挛,使脑部的血流量增加,进而改善了脑组织缺血缺氧状态,有利于神经功能恢复[12]。高压氧具有多重神经保护作用,通过医用高压氧舱能够将氧分子送至脑组织缺血缺氧部位,为脑组织提供所需的氧分子,加快了脑细胞有氧代谢,改善了患者的临床症状[13]。本次研究发现,经过治疗后,从血清ET-1、TXB2、VEGF、TT、PT、APTT、纤维蛋白原、红细胞压积以及全血黏度指标方面进行比较,观察组的ET-1、TXB2水平以及纤维蛋白原、红细胞压积以及全血黏度均低于对照组,VEGF、TT、PT、APTT均高于对照组,由此结论可知,高压氧辅助丁苯酞在AIS患者的治疗中,能够使患者的凝血功能和血液流变学得到明显改善,并且血管内皮损伤有明显减轻。分析其原因在于,采用高压氧治疗AIS患者,可使患者的脑组织缺氧状态得到改善,使患者病灶处的神经元供氧得以恢复,使患者受损神经元内环境得以改善,还能够促进新生血管的生成,进而起到了颅脑功能重建的作用,并且高压氧能够增加氧分压,使氧代谢得以提高,促进了细胞膜功能恢复,红细胞的变形力明显增加,进而降低了血液黏度[14]。除此以外,本次研究还发现,观察组和对照组在治疗期间不良反应发生率进行对比,并未有明显差异,这表明高压氧辅助丁苯酞治疗AIS患者,具有较高的安全性。
综上所述,在急性缺血性脑卒中患者的临床治疗中,在丁苯酞治疗的基础上采用高压氧辅助治疗AIS患者,能够进一步提高患者的临床疗效,患者的临床症状得到明显改善,而且能够对脑组织起到良好的保护作用,患者的凝血功能和血液流变学均有了明显改善,该治疗方案具有较高的可行性。

