生理盐水引导腔内心电图技术用于早产儿脐静脉置管尖端定位的效果
江雪玲 廖瑞雪
(重庆大学附属三峡医院,重庆 404000)
脐静脉置管(umbilical vascular catheterization,UVC)是近些年来新兴的静脉穿刺技术,其通过新生儿尚未关闭的脐静脉,将一次性硅胶导管慢慢置入脐静脉,导管通过静脉达下腔静脉,从而帮助新生儿建立安全有效的中心血管通路[1]。经外周静脉穿刺置入中心静脉导管技术(peripherally inserted central catheters,PICC)是临床常用的穿刺技术,具有操作简单、穿刺成功率高、无需反复穿刺等优点,目前已广泛用于新生儿、极(超)低体质量早产儿,利用PICC置管技术,可以帮助新生儿输注刺激性药物或营养液[2]。然而,由于早产儿年龄的特殊性,身体各项功能尚未发育完全,其皮肤比较娇嫩,血液循环状态比较差,血管细小且具有隐匿性,所以对早产儿行脐静脉置管是必经之路。UVC是近些年在临床上被广泛应用的置管方式,具有留置时间长、操作简单、穿刺痛苦小等特点[3]。对于出生体质量<1 000 g或外周静脉通路无法建立而需要紧急建立静脉输液途径进行抢救的新生儿均应优先选择UVC[4]。因此,在严格意义上,UVC是指管端放置在靠近下腔静脉入心脏的位置。目前临床一般采用标准的胸腹部X线片对导管尖端位置进行定位。但该定位方法存在系统误差,导致置管一次性成功率较低,采用标准的胸腹部X线片对导管尖端位置进行定位的置管异位率为21.46%~61.20%[5-6]。导管尖端异位会导致肝损伤、坏死性小肠结肠炎、气腹等严重并发症[7]。已有较多文献报道,生理盐水引导腔内心电图(intracavitary electrocardiography,IC-ECG)技术辅助新生儿PICC导管尖端定位方法可靠,但在早产儿中未见相关报道。为了进一步探讨应用生理盐水引导IC-ECG引导UVC导管尖端定位的可行性和精准性,此次研究以我院新生儿科120例脐静脉置管早产儿为例进行分析,探讨生理盐水引导IC-ECG技术用于导管尖端的效果,以期为临床相关研究提供参考,报道如下。
1 资料与方法
1.1 一般资料 本研究时间在2020年12月至2021年12月,研究对象是120例脐静脉置管早产儿。研究对象的纳入标准和排除标准如下。①纳入标准:出生时间<48 h;孕周<37周;体质量<3 000 g;病情危重需随时抢救的新生儿;置管前基础常规心电图记录显示P波正常;家属自愿配合本研究,并签署知情同意书。②排除标准:患有先天性心脏病;脐带有畸形新生儿,家属不同意参加本研究。按住院号尾数的奇偶数分为干预组和对照组,各60例。对照组:胎龄27~37周,平均(31.11±1.87)周;男32例(占比53.33%),女28例(占比46.67%)。干预组:胎龄28~34周,平均(31.52±2.77)周;男婴占比56.67%(34例),女婴占比43.33%(26例)。对比分析两组性别例数及胎龄的分布情况,P>0.05。见表1。此次研究对象的临床资料完整,所有调查对象的临床资料递交伦理委员会审核并获得批准(审批文号2020-41),患儿监护人均签署知情同意书。
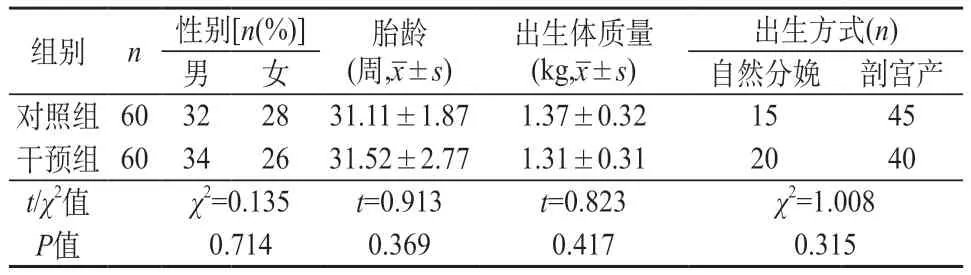
表1 两组一般资料比较
1.2 方法
1.2.1 成立置管小组 由取得脐静脉置管资质的新生儿专科护士及新生儿科高年资专科医师组成,成立新生儿UVC维护小组,每日进行评估及维护。制订相关制度及流程、标准化预案。置管小组成员经过统一培训并考核合格。
1.2.2 脐静脉置管所需仪器设备 在实施脐静脉置管前,护理人员需提前准备好医疗器材,具体包括:①3.5F脐血管导管。②12号针头。③静脉切开包。④100 mL的生理盐水。⑤10 mL注射器。⑥心血管专用监护仪。⑦无菌鳄鱼夹。⑧无菌心电导联线。
1.2.3 置管方法
1.2.3.1 对照组 在为早产儿进行脐静脉置管前,需要根据其出生体质量判断置入导管的深度,置入导管深度的计算公式=[出生体质量(kg)×3+9]/2+脐带残端(cm)。脐静脉导管置入预测长度,完成置入后利用缝合线进行固定,之后进行床旁胸腹部X线摄片,观察导管尖端的位置,导管尖端的最佳位置为T8~T10。
1.2.3.2 干预组 参照汪丽平等[7]UVC操作方法置管。①在为早产儿实施脐静脉置管前,需根据其出生体质量预估置管深度,计算公式与对照组相同。②将早产儿轻轻放置在远红外辐射台上,协助其维持仰卧姿势,妥善固定好四肢,避免四肢随意摆动,观察早产儿的血氧饱和度;随后找准早产儿左下腹、右下腹、右上锁骨第2肋骨,在上述部分粘贴电极片,连接心血管专用监护仪,并将其无菌心电导联的绿色电极放置在早产儿的右下腹,将红色电极放置在早产儿的左下腹,将白色电极放置在右上锁骨第2肋,蓝色电极随意放置。③消毒脐周,医护人员需要穿隔离衣,戴上无菌手套,进行消毒铺巾后,确保脐部区域充分显露在医护人员的视野中,在脐带根部系上一根无菌棉线后利用无菌剪刀剪除脐带的多余部位,注意脐带残端需保留1~2 cm,采用止血钳轻轻夹住脐带切面的边缘部位,置入装满生理盐水的脐血管导管。④观察心血管专用监护仪,等到监护仪的波形稳定后,在监护仪的显示屏进行操作,抓取第1次心电图作为体表心电图;在脐静脉置管期间,脐静脉导管需要连接肝素帽,利用10 mL注射器抽取生理盐水后连接头皮针,将钢针轻轻置入肝素帽,注意需显露2/3的针柄,将充满生理盐水的导管作为导电电极和血液介质,导出心电信号,排净导管内的空气后使用无菌鳄鱼夹夹住针头,将无菌鳄鱼夹的另一端连接心血管专用监护仪的蓝色电极;在脐静脉置管过程中,导管置入预测深度时,需要慢慢推注1 mL的生理盐水,并仔细观察心电图Ⅱ导联P波及QRS波群振幅的变化情况,当导管进入下腔静脉时,QRS波群振幅会慢慢增加,医护人员需要继续置入导管,直到观察到倒置的P波或双向P波后方可停止置入动作,并慢慢向外调整导管的置入深度,直到腔内心电图显示正常的QRS波和圆顿的P波,且呈现正向增高后,方可停止调整行为。⑤完成置管后,妥善固定导管,并做好记录。⑥利用床旁胸腹部X线摄片,观察导管尖端的位置,导管尖端的最佳位置为T8~T10。
1.2.4 固定方法 准确定位导管尖端,并且置管成功后,采用橡胶圈套扎外露导管,并详细记录导管的置入深度、外露长度等;随后以肚脐为中心、半径为1 cm,将导管环形固定在早产儿的脐部,根据环形导管的宽度(宽度约为3 cm),将半径为5 cm的圆形水胶体透明敷料剪裁成3 cm的空心圆,覆盖在导管上,注意肚脐要显露出来,采用无菌纱布包裹肚脐,并使用医用胶带固定在腹部,随后每日进行脐部护理和导管护理。在置管24 h内需要更换一次脐部敷料,如无渗血、渗液则每7 d更换敷料1次,输液速度≥3 mL/h,并每8 h用生理盐水1~2 mL脉冲式冲管1次,保证管路通畅,直到拔除导管方可停止上述医疗行为。在帮助早产儿更换敷料时,首先需要使用0.5%聚维酮碘对脐部及脐周局部皮肤进行消毒处理,随后利用灭菌生理盐水擦洗皮肤,等到皮肤干燥后方可粘贴水胶体敷料。
1.3 观察指标
1.3.1 观察两组的尖端位置 判断依据:①导管尖端的最佳位置为T8~T10。②导管尖端的位置处于T11及以下,评定为导管尖端过浅。③导管尖端的维持处于T7及以上,则视为导管尖端过深。④导管尖端处于肝脏内部,视为导管尖端异位。
1.3.2 统计两组的下腔静脉1次到位率 脐静脉置管后,第1次拍摄X线片结果显示导管末端处于第8~9胸椎之间,并且导管路径未出现异常情况,则视为下腔静脉1次到位。仔细记录下腔静脉1次到位例数,计算下腔静脉1次到位率。
1.3.3 并发症 记录置管后至拔出导管48 h内患儿腹胀、导管相关性感染、导管堵塞、静脉炎、出血的发生率。
1.3.4 疼痛程度与送管困难率 ①疼痛程度:评估标准参照新生儿疼痛评估量表(Neonatal Infant Pain Scale,NIPS)[8]进行评估,总计0~7分,分数越低,评定为痛感越轻。②送管困难率:在送管过程中若有明显阻力,或需反复后退送入时,评定为送管困难。
1.3.5 置管时间与穿刺处出血量 统计两组的置管时间与穿刺处出血量。置管时间:对照组为穿刺时间与立即行胸部X线片定位时间之和;干预组为穿刺时间与生理盐水引导腔内心电定位时间之和。利用称重法计算穿刺处的出血量。
1.4 统计学方法 采用SPSS 23.0统计学软件对数据进行分析。计量资料采用(±s)表示,组间比较行t检验;计数资料采用[n(%)]表示,组间比较行χ2检验;P<0.05表示差异有统计学意义。
2 结果
2.1 对比分析两组的导管尖端分布情况 在首次尖端到位率上,相较于对照组38.33%(23/60),干预组75.00%(45/60)明显更高(P<0.05)。见表2。

表2 两组导管尖端分布情况比较[n(%)]
2.2 两组新生儿下腔静脉1次到位率的比较 对照组患儿下腔静脉1次到位率为47.92%(23/48),其他25例导管位置过深;干预组患下腔静脉1次到位率为81.82%(45/55),导管位置过深10例。在下腔静脉1次到位率上,干预组显著高于对照组(χ2=13.131,P<0.001)。
2.3 评价分析两组的并发症发生情况 在并发症发生率上,相较于对照组,干预组明显更低,对比差异显著(χ2=4.183,P=0.041)。见表3。
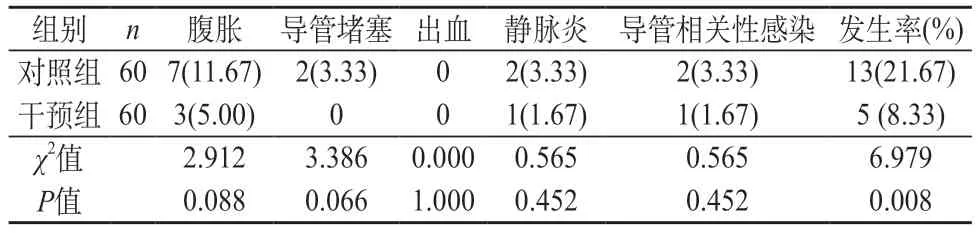
表3 评价分析两组的并发症发生情况[n(%)]
2.4 两组NIPS评分与送管困难率比较 干预组在穿刺5 min后的NIPS评分与送管困难率均低于对照组(P<0.05)。见表4。
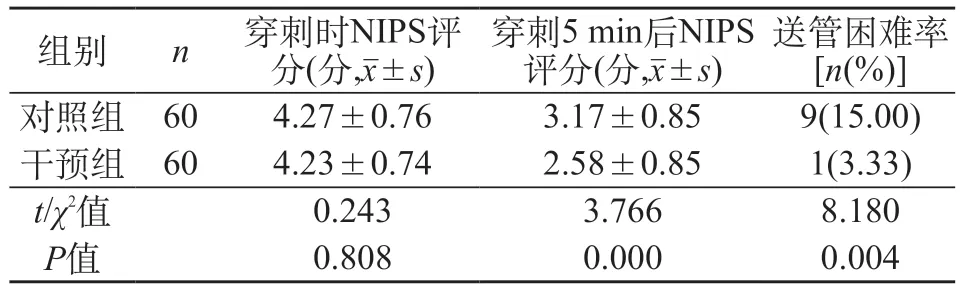
表4 两组NIPS评分与送管困难率比较
2.5 两组置管时间与穿刺处出血量比较 在置管时间上,干预组短于对照组;在穿刺处出血量上,干预组少于对照组(P<0.05)。见表5。
表5 两组置管时间与穿刺处出血量比较(±s)
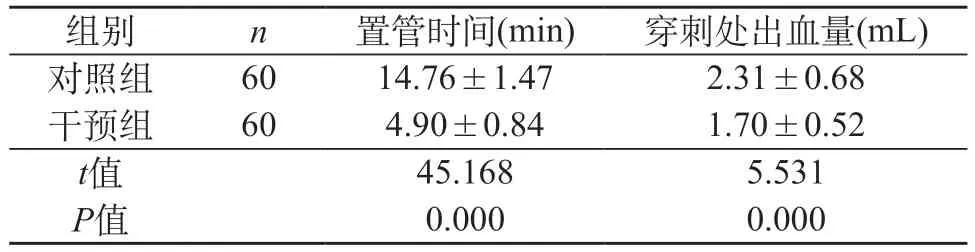
表5 两组置管时间与穿刺处出血量比较(±s)
3 讨论
3.1 生理盐水导引腔内心电图定位技术提高了导管定位精准率 据报道,经IC-ECG定位技术置脐静脉一次性成功率高达100%[9]。在脐静脉置管过程中应用腔内心电图定位,可作为导管穿刺成功后确定导管尖端位置的方法之一,在不需要进行胸部X线片检查的情况下,就可以判断导管是否进入下腔静脉[10]。在此次研究中,部分对照组早产儿存在导管尖端过深现象,发生这种现象是因为操作人员为了防止导管置入过浅而影响导管留置时间,故在置入导管时常常会深入预估导管深度,从而常发生导管置入过深情况。临床研究发现,置管对操作人员的技术要求极高,并且具备足够的临床操作经验,充分认识到导管过深的危害,才可以按照预估深度进行置管,从而减少并发症的发生[11]。本研究干预组对于两组导管尖端过浅各2例,分析原因可能是因为一次性硅胶导管只能置入预定深度,导管没有通过静脉导管,而是分别进入了门静脉左支、肝静脉等,回抽的时候没有回血或者仅存在少量回血,并只能退到距离脐根部3~5 cm位置,作为外周静脉使用。本研究干预组3例3次调整仍未出现特征性P波变化,经过胸腹部X线摄片发现导管尖端异位到了门静脉,对照组的导管尖端异位发生在门静脉。分析其原因是:由于脐静脉与门静脉、静脉导管及下腔静脉的解剖结构不同,并不是所有的脐静脉导管可以成功通过脐静脉导管置入下腔静脉,在置管的时候常存在一定的阻力。
3.2 生理盐水导引IC-ECG定位技术的安全性 生理盐水导引IC-ECG定位技术可以根据P波和QRS波群振幅的变化情况,仔细调整导管置入的深度,防止因为留置部位不正确而诱发相关并发症的发生。临床研究发现,对新生儿进行脐静脉置管时若置管深度不达标,会增加其发生并发症的风险[12]。本研究发现,两组早产儿均存在腹胀情况,这可能与导管尖端未达到最佳位置有关,医护人员利用X线片检查评估后,及时调整导管尖端的深度,拔管后早产儿的腹胀症状消失。两组早产儿置管后,出现静脉炎和导管相关性感染,这可能与脐静脉置管后操作不当有关,临床应定期组织护理人员学习和培训脐静脉置管的相关护理知识,不断提升其护理技能,减少静脉炎和导管相关性感染的发生[13]。在UVC置管前后给予集束化标准护理,置入时最大化无菌屏障、手卫生、每日评估导管临床需求情况、使用中心静脉包、规范穿无菌手术衣、进行技术培训、使用穿刺及维护检查表[14]。生理盐水引导IC-ECG定位技术具有操作简单、准确率高、无辐射损伤等优点,目前临床尚未报道过在使用生理盐水引导IC-ECG定位技术时,出现过与技术相关的心律失常、电流损伤等技术相关的并发症。
实施生理盐水引导IC-ECG定位技术时发生与技术相关的并发症,如心律失常、电流损伤等[15]。此次研究结果显示,干预组在使用生理盐水引导IC-ECG定位技术时,尚未出现任何与技术相关的并发症,这证实了生理盐水引导IC-ECG定位技术使用的安全性。
在置管过程中由于穿刺进针,患儿会感受到痛苦,出现哭闹、局促不安等情况,增加了患儿穿刺失败的概率,延长了置管时间。由于患儿年龄较小,在送管过程中可能存在阻力,需反复进行后退送入行为,增加了送管困难,导致置管失败,影响治疗效果。本次研究发现,干预组穿刺5 min后的NIPS评分、送管困难率及穿刺处出血量均低于对照组,置管时间短于对照组,提示生理盐水引导IC-ECG定位脐静脉导管末端位置的效果显著,有利于减轻早产儿的疼痛感,减少穿刺处出血量,临床应用安全性高。
综上所述,生理盐水引导腔内心电图技术用于早产儿脐静脉置管末端位置定位的效果确切,能够减少调整导管位置的次数,避免早产儿X线暴露,并且操作方法简单,安全可靠,值得临床加大推广力度。

