腹腔镜下两种入路右半结肠癌根治术的对比研究
罗顺添 郭亮 关阳铭 张锐江 吴桂堂 李均贤
(中山陈星海医院,广东 中山 528415)
结直肠癌是我国常见的恶性肿瘤,发病率及病死率逐年上升,据2020年全球癌症统计数据[1-2],我国结直肠癌新发病例为55.5万,居恶性肿瘤第3位;病死率为12.0/10万,居恶性肿瘤的第5位[3]。手术是临床上治疗结肠癌的一个常见方案,其包括两种类型,即开腹术与腹腔镜术,国内外已广泛开展腹腔镜结直肠切除手术多年,腹腔镜结肠切除已成为常规手术[4-5]。右半结肠切除具有解剖层次相对复查的特点,比邻胰腺十二指肠、输尿管、下腔静脉等,而且常伴有血管变异,D3淋巴结清扫难度相对较大,所以腹腔镜下右半结肠切除相对更难[6-7]。对比研究各种手术方法入路方式的优缺点,目前仍未定论哪种手术入路方式是最佳的[7-8]。我院于2016年1月至2021年12月行尾侧联合中间翻页式清扫及中间入路腹腔镜下右半结肠癌根治术48例,现回顾分析相关临床资料并进行对比研究,总结报道如下。
1 资料与方法
1.1 一般资料 回顾性研究我院2016年1月至2021年12月实施腹腔镜下行右半结肠癌摘除术患者48例,结合手术类型的差异性,分成两组,即:观察组(n=24,采用尾侧入路联合中间翻页式清扫手术)和对照组(n=24,采用传统中间入路手术)。观察组患者平均年龄(62.60±14.90)岁,对照组(62.23±12.70)岁;两组患者性别、年龄、术前TNM分期、BMI、肿瘤直径等具有可比性(P>0.05)。见表1。本研究已获得我院伦理委员会的批准。
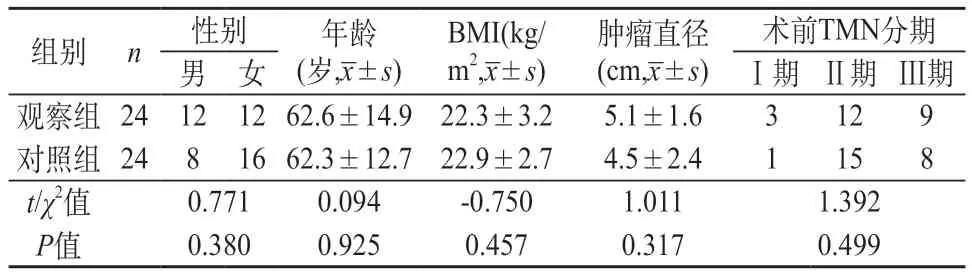
表1 两组患者一般资料对比
纳入标准:①经病理活检确诊为结肠癌,病灶位于右半结肠。②临床分期Ⅰ~Ⅲ期。③BMI(体质指数)≤30 kg/m2。④未做新辅助化疗。排除标准:①肿瘤直径≥10 cm。②已发生腹腔转移,或侵犯后腹膜及邻近器官。③合并肠梗阻、肠穿孔。④有开腹手术史,腹腔粘连严重。
1.2 手术方法
观察组:采用尾侧入路联合中间翻页式清扫入路方式,方法为:患者仰卧分腿位,采用常规的5孔法,①在脐下约5 cm切开1 cm的切口,置入10 mm Trocar观察孔,固定在左侧锁骨中位肋缘下3 cm处,这是一个主操作孔;另外一个辅助孔是5 mm Trocar,处于左下腹反麦氏点;同时还包括两个助手辅助孔,处于右腹对称方位。常规腹腔探查后头低脚高左倾位,将大网膜、小肠移至左上腹,助手提起回盲部,显露回肠系膜根部的“膜桥”;切开膜桥进入Toldt's间隙,采用钝性加锐性分离,由内向外拓展结肠后间隙,头侧显露十二指肠降部及胰头部,内侧至肠系膜上静脉左侧缘,外侧显露生殖血管至升结肠内侧缘,并留置纱条标识。②将小肠翻转至左中下腹,显露肠系膜上静脉(SMV)的投影位置,在回结肠血管与SMV夹角处切开系膜进入Toldt's间隙,与已游离好的结肠后间隙贯通,由尾侧向头侧解剖显露SMV及各分支,依次结扎离断回结肠及中结肠血管和Henle干分支,翻页式清扫各分支血管根部的脂肪组织淋巴结。③调头高足低位,在胃网膜血管弓外(扩充右半时进行胃网膜血管弓内摘除)切割胃结肠韧带,使其转移至小网膜囊中,顺着胃胰皱襞位置对胃、横结肠系膜的融合缝隙进行分离,然后将其偏离在右横结肠系膜根处后端,并渗透到结肠系膜后缝隙,且和已经完全游离的胰十二指肠前间隙进行衔接与融合;对外侧整合肝结肠韧带、升结肠侧韧带,由此能够达到结肠肝曲与升结肠隔离等目的。④选择上腹正中切口,然后确定标本,对其实施右半结肠摘除,同时进行回肠横结肠侧侧吻合术处理,其根本目的是避免系膜扭转,关闭系膜裂孔。
对照组:采用中间入路方式,方法为:①体位及Trocar布局与尾侧入路组相同。于回结肠血管与SMV夹角间切开肠系膜进入右结肠后Toldt's间隙,向头侧及外侧、尾侧稍作拓展。②沿肠系膜上静脉由尾侧向头侧分别分离处理回结肠、右结肠、中结肠血管,然后实施D3淋巴结清扫处理。③选择头高足低,将胃结肠与肝结肠等韧带实施分离,然后将右半结肠外端完全分离出去。④选择上腹部正中切口方位,确定标本能够完全分离,将回肠与横结肠行侧侧吻合,关闭系膜裂孔(方法同前组)。
1.3 观察指标 ①手术相关指标(手术时间、术后首次排气时间、术后住院时间、切除标本长度、术中出血量、术中淋巴结清除数、术后并发症发生率)。②手术前、手术后第7天炎性反应指标(白细胞计数、C-反应蛋白)、肿瘤标志物(CEA)及免疫指标(CD4+/CD8+)的变化。
1.4 统计学方法 通过SPSS25.0软件实施数据整理与研究,其中,计量指标对其实施(±s)描述,并行t检验;计数指标对其实施χ2检验,如果P<0.05表示数据差异有显著性。
2 结果
2.1 两组患者的手术相关指标对比 观察组的手术时间、术中出血量明显少于对照组,两组差异明显,P<0.05。而两组的术后首次排气时间、术后住院时间、术中淋巴结清除数、切除标本长度、术后并发症发生率均无显著性差异,P>0.05。其中,观察组并发症包括:1例吻合口瘘,1例腹腔感染,1例不完全性肠梗阻;对照组1例吻合口瘘,2例肺部感染,1例切口感染。两组患者均无中转开腹和围手术期死亡病例。见表2。
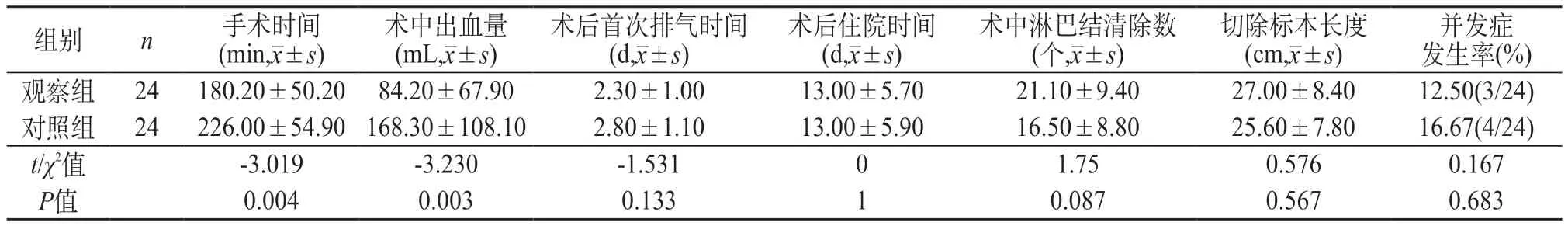
表2 两组患者手术相关指标对比
2.2 两组患者手术前后炎症指标、肿瘤标志物指标、免疫指标变化对比 研究结果显示,两组患者术后白细胞计数、C-反应蛋较术前均升高,但差异无统计学意义(P>0.05);两组CEA水平术后较术前明显下降,但两组对比差异无统计学意义(P>0.05);两组患者手术前CD4+/CD8+比值差异均无统计学意义(P>0.05),但手术后的CD4+/CD8+比值观察组比对照组高,且差异有统计学意义(P<0.05)。见表3。
表3 两组患者手术前后炎症指标、肿瘤标志物指标、免疫指标对比(±s)
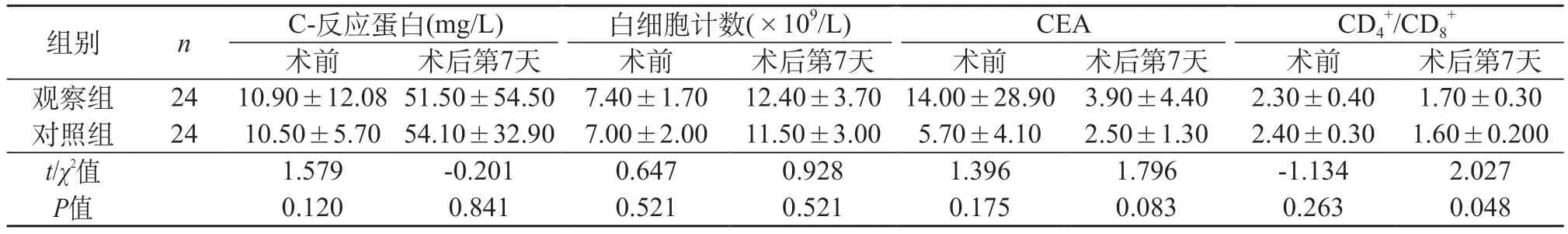
表3 两组患者手术前后炎症指标、肿瘤标志物指标、免疫指标对比(±s)
3 讨论
Jacobs等[9]在1991年报道了第1例腹腔镜结肠切除手术,郑民华和蒋渝[10]于1993年在国内率先实施了腹腔镜乙状结肠切除术。2009年,德国Hohenberger等[11]创建了结肠癌摘除术中的全面系膜摘除(简称CME),由此明确了结肠癌具体的摘除范围。20多年来,随着国内腹腔镜结直肠手术的迅速发展,不论是技术上还是理念上都在逐步发展成熟。其中,腹腔镜右半结肠癌摘除术也实现了进一步地升级与优化,确保其操作更加规范与有序。不过,考虑到右半结肠的生理结构相对独特,且存在血管变异明显等特征,必然会对腹腔镜右半结肠摘除术的应用造成一定的限制[12-13]。确定适宜的手术路径有助于正确地进入Toldt's间隙,为后面的血管处理和淋巴结清扫做好铺垫。
中间入路是继外侧入路后应用较多的手术方式,其优点是先离断属支血管清扫血管根部淋巴结,再充分游离肠管,不需要先接触肿瘤,更符合肿瘤根治术的无瘤技术原则(no-touch)。但中间入路存在一些手术难点:①对于部分血管变异和肥胖的患者,在寻找进入Toldt's间隙时,进入错误层面的风险较高,走深则可能误伤输尿管、生殖血管、十二指肠等比邻器官,走浅则可能进入结肠系膜内,导致系膜血管出血或者破坏肠系膜的完整性,导致不符合CME手术原则。②中间入路没有首先显露Henle干及分支的后方,解剖及显露更困难,容易误伤Henle干分支,或者误伤胰腺组织及其表面血管导致出血、视野不清,增加手术难度和延长手术时间。③由于前面的一些问题,可能导致中间入路学习曲线相对较长[14]。近些年出现了头侧及尾侧入路,头侧入路一般有两种,即:中间入路与联合入路。一方面,顺着胃大弯中点下横行摘除大网膜前叶,同时将其于幽门下实施横结肠系膜前叶游离,完全显露出其静脉的胃结干、结肠内部血管等,再按照尾侧入路或中间入路的手术方式完成接下来的手术步骤。头侧入路要求熟悉如何辨认解剖胃系膜和结肠系膜的融合间隙,初学者可能不易掌握。尾侧入路首先拓展右结肠后间隙,再沿肠系膜进行血管分离与解剖处理,通过结扎的方法摘除右半结肠属支血管,并且,还需要对其实施淋巴结扫描处理。主要包括尾内侧入路和尾背侧入路两种方式。其以回肠系膜根部“膜桥”为切入点,比较容易进入正确的Toldt's间隙,由此能够更方便地实施应用与学习[15]。本研究通过尾端入路与中间翻页法进行清扫治疗,同时兼有尾端入路、中间入路等操作方法的优势,手术过程较容易进入正确的平面从而保证CME的完成,同时降低了处理属支血管和淋巴结清扫的难度,且遵守肿瘤根治术的no-touch原则[16]。
本研究结果显示,观察组手术时间和术中出血量均少于对照组,分析原因可能是:①尾侧入路沿解剖结构相对固定的膜桥进入Toldt's间隙,难度降低,不易走错平面,故而节省了手术时间[17]。②联合中间翻页式清扫时,由于之前已经将右半结肠间隙充分拓展,显露SMV各属支的后方,减少对血管变异的误判,降低出血的风险;即使出现出血,由于血管前后都显露良好,更有利于止血[18]。③手术期间责任医师不用调整占位,操作非常便捷与顺畅,确保助手能够无缝对接与密切协助,节约手术时间[19]。另外,两组患者的术后排气时间、住院时间、并发症率等指标,能够看出两组差异并不明显。由此可知,以上2种入路法对患者术后恢复带来的影响并不明显。故两种方法都具有较强的安全性与有效性。除此之外,对两组患者的淋巴结清扫数、切除标本长度等指标的差异性进行比较发现没有统计学意义。由此来看,尾端入路+中间翻页法清扫和传统中间入路的临床疗效相仿,但在实际操作中笔者认为尾侧入路联合中间翻页式清扫入路淋巴结清扫相对其他入路方式难度更小[20]。CEA属于结肠癌患者实施临床检验的一个非常关键的血清学指标,个别结肠癌患者具有一定的高表达水平。本研究结果显示,手术前后血清CEA水平差异无统计学意义,说明两种入路手术均可以有效降低患者体内肿瘤标志物浓度。有研究表明右半结肠癌患者的预后与身体免疫功能受到抑制的情况有着直接的相关性,患者机体免疫力下滑愈明显时,其预后效果愈差[21]。体内CD4+、CD8+T淋巴细胞的表达水平一般能够说明机体的免疫情况,倘若CD4+/CD8+的数据明显减小,那么能够看出机体的免疫力也在下滑[22]。有研究将腹腔镜和开腹术对免疫状态带来的影响展开比较得出,结肠癌患者术后的CD4+T淋巴细胞、CD4+/CD8+水平明显降低,但是CD8+T淋巴细胞水平则明显提升,同时,腹腔镜术后的CD4+T淋巴细胞、CD4+/CD8+水平等明显地超过传统的开腹手术,但是不会对患者的免疫力造成一定的干扰[23]。也有一些学者的研究结果与其类似[24-25],提示腹腔镜结直肠癌摘除术患者在实施手术治疗之后,CD4+T淋巴细胞、CD4+/CD8+等指标较传统开放性手术要高,这一研究结果提示腔镜结直肠癌根治术比开腹术对患者身体免疫力的遏制效应要轻,能够提升患者的预后效果。本研究中,观察组患者CD4+/CD8+比值比对照组高,两组差异有统计学意义,说明对观察组患者免疫系统的影响相对较小,可能与尾侧入路组相对更容易进入正确层面,导致手术时间相对更短,以及出血量相对减少等有关系。
综上所述,尾端入路+中间翻页清扫术、传统中间入路术等都能够获得不错的临床治疗效果。通过对比来看,前者的手术操作时间、术中出血量等相对少一些,其优势更为突出,对患者免疫功能影响相对较小,且手术难度相对较低,更容易被初学者所掌握,适合在基层医院推广应用。不过在实际操作过程中手术入路并不是一成不变的,有时需要根据术中情况及时调整手术入路,对于某些困难手术可能需要多种入路联合才能更好的完成手术,总之要根据患者实际情况选择合适的具体手术方式。本研究存在样本数量不多的不足,并未对术后局部复发率、远期疗效、生存率等进行统计分析,且仅为回顾性研究,所以需要日后行大样本、前瞻性研究进一步证实远期效果。

