电针调节功能性消化不良大鼠胃肠动力障碍及对胃窦组织铁死亡相关因子的影响
李跃兵,王焕梅*,孙柳青,陈佳怡,侯培媚,李 筝,佘 艳,彭 艳
(1.湖南中医药大学针灸推拿与康复学院,湖南 长沙 410208;2.武汉市第九医院康复科,湖北 武汉 430010)
功能性消化不良(functional dyspepsia, FD)是一组以上腹痛、腹胀、腹泻、反酸、嗳气等为主要表现的非器质性胃肠病,流行病学调查显示,FD 发病率为18%~38%,我国发病率为19.8%[1]。 FD 发病机制至今尚不清楚,胃肠动力障碍被认为是FD 发生最主要的生理机制之一[2]。 本课题组前期研究表明,电针能够有效改善FD 大鼠运动功能,降低FD 大鼠肠道敏感性,提高FD 大鼠胃排空率及小肠推进率,能够良性调节FD 大鼠胃肠动力功能[3]。 铁死亡是一种以铁依赖性、细胞脂质活性氧族簇(reactive oxygen species, ROS)积累为特征的新型细胞死亡方式。研究发现,铁死亡与多种胃肠道疾病发生有密切关系[4]。 谷胱甘肽过氧化物酶4(glutathione peroxidase 4, GPX4)是公认的铁死亡关键物质之一,胱氨酸/谷氨酸反向转运蛋白(cystine/glutamate reverse transporter, system Xc-)负责将还原型谷胱甘肽(glutathione, GSH)的合成原料半胱氨酸转运至胞内,GPX4 在GSH 的辅助下,降解脂质过氧化物,避免细胞发生氧化性损伤,从而降低铁死亡的发生[5]。本研究以FD 大鼠为研究对象,采用电针FD 大鼠足三里为干预手段,通过观察电针对FD 大鼠胃肠动力调节情况、对铁死亡相关因子表达的影响以及二者的相关性分析,从铁死亡途径探讨电针调节FD大鼠胃肠动力功能的可能机制。
1 材料与方法
1.1 动物来源
SPF 级功能性消化不良大鼠40 只,雌雄各半,体质量200~250 g,由湖南中医药大学动物实验中心提供(大鼠订购编码:DWDG-202111150005)。 饲养温度为20~25 ℃,湿度为55%~65%,12 h∶12 h明暗光线交替照射。本实验经湖南中医药大学伦理委员会评审批准实施,动物实验过程及对实验动物的处理符合国家科技部《关于善待实验动物的指导性意见》[5]。
1.2 主要试剂与仪器
多潘立酮片(10 mg×30 s,批号:国药准字H10910003,西安杨森制药有限公司);0.9%氯化钠注射液(250 mL,批号:H20033973,湖南比扬医疗科技有限公司);伊利脱脂纯牛奶(批号:66115271050,内蒙古伊利实业集团股份有限公司);墨汁(250 g,批号:BR-987/975, 上海晨光文化用品有限责任公司);亚铁比色法测试盒、GSH 比色法测试盒、MDA比色法测试盒(批号:国械注进20162401765、CB75771065、FS-E9710,武汉伊莱瑞特生物科技股份有限公司);荧光染料PCR 检测试剂盒、反转录试剂盒(批号:KL14-49500、KL14-49600,江苏科惟生物技术有限公司);大鼠GPX4 抗体、System Xc-抗体、GAPDH(批号:BM5231、Bs-6883、BM1623, 武汉博士德生物科技有限责任公司)。 酶标仪、荧光酶标仪、流式细胞仪(型号:A51119500C、A51119600C、A51119700C,湖南比扬医疗科技有限公司);微量高速离心机、隔水式恒温培养箱(型号:TG16W、GNP-9080,湖南比扬医疗科技有限公司);华佗牌无菌针灸针(0.25 mm×25 mm,批号:津械注准20172270152,苏州医疗用品有限公司);电子针灸治疗仪(型号:HANS100A,苏州医疗用品有限公司)。
1.3 造模方法
将40 只SD 大鼠分为空白组、模型组、电针组、西药组,每组10 只。 除空白组外,其余30 只大鼠按复合病因造模法造模,具体方法如下:将大鼠隔日禁食,隔日进食,进食时足量喂食,将大鼠置于(0±1) ℃冰水中游泳20 min,之后用(-4±2) ℃冰板刺激大鼠腹部,每日2 次,上午、下午各1 次,连续21 d。 在造模过程中,大鼠出现便溏、体质量减轻、运动迟缓、运动量少等症状,则视为造模成功[6]。
1.4 干预方法
1.4.1 空白组 正常饲养,足量喂食。
1.4.2 模型组 造模成功后正常饲养,足量喂食。
1.4.3 电针组 (1)足三里穴定位[7]:位于小腿外侧,膝关节后外侧,腓骨小头下约5 mm。(2)电针方法[8]:FD 大鼠清醒固定,直刺,深度0.2~0.3 寸,进针后,接电针仪,疏密波(2 Hz,波频率100 Hz),强度以针柄轻微抖动为度,每次留针20 min。 于造模成功后第3天开始针刺,每天1 次,连续治疗21 d。
1.4.4 西药组 将多潘立酮片研成细粉末,溶于蒸馏水中,制备浓度为0.27 mg/mL 的多潘立酮溶液,置于冰箱,4 ℃恒温保存备用,用时充分摇匀,多潘立酮(10 mg/kg)采用灌胃给药,每日1 次,连续给药21 d,治疗时间与电针组一致[9]。
1.5 观察指标及检测方法
于实验第22 天,各组大鼠禁食24 h 后,解剖取胃窦组织进行检测。 胃窦组织取材方法:剪取一部分取胃窦组织,冰生理盐水冲洗,然后放入4%多聚甲醛中4 ℃固定24 h 时,石蜡包埋备用,用于免疫组化检测。
1.5.1 胃内残留率的测定[10]治疗结束后,各组大鼠禁食24 h 后,给予每只大鼠按1 mL/100 g 灌胃容积灌服营养性半固体糊(羧甲基纤维素钠5 g,奶粉8 g,糖4 g,淀粉4 g,活性炭3 g,蒸馏水约150 mL),30 min 后处死动物,打开腹腔,分离出胃。 沿胃幽门处剪取胃,拭干,称全重(M1);再沿胃大弯处剪开胃,用生理盐水洗净内容物,用滤纸拭干,称胃净重(M2)。计算胃残留率:胃残留率=(M1-M2)/灌胃量×100%。
1.5.2 小肠推进率的测定[11]治疗结束后,各组大鼠禁食、灌胃方法同前,30 min 后处死动物,打开腹腔,分离出肠。 用镊子轻轻提取上端至幽门、下端至回盲部的肠管,平铺于试验台上,不牵扯,轻轻将小肠拉成直线,用直尺测量小肠全长(L1)以及幽门至炭末所达最前端的长度(L2),计算肠推进率:小肠推进率=(L2/L1)×100%。
1.5.3 胃窦组织Fe2+含量检测[12]将采集各组FD大鼠胃窦组织离心(4 ℃,3000 r/min,半径10 cm,离心10 min),取上层清液200 μL 加入酶标板相应孔中,混匀,37 ℃孵育10 min,在酶标仪593 nm 处测定各孔OD 值,依据OD 值测定血清中Fe2+含量。
1.5.4 胃窦组织GSH 含量、MDA 含量测定[13]取离心后的上清液0.1 mL,设置标准孔、测定孔、空白孔,酶标仪波长405 nm 振板1 min,静置5 min,严格按照试剂盒说明书进行操作,测定各孔吸光度并计算GSH 含量。
1.5.5 胃窦组织ROS 含量检测[14]将胃窦组织离心(4 ℃,3000 r/min,半径10 cm,离心10 min),取40 μL 细胞悬液加入试管内,再加50 μL(1∶20,用DPBS 稀释)灭活正常兔血清,用洗涤液洗涤2 次(4 ℃、30 min),加入适量荧光标记物,充分振摇(4 ℃30 min),加入1 mL 固定液制备标本,用流式细胞仪检测胃窦组织ROS 含量。
1.5.6 胃窦组织GPX4mRNA、system Xc-mRNA 表达检测[15]用RT-PCR 法检测胃窦组织GPX4mRNA表达水平。 具体方法如下:收集各组胃窦组织细胞,用Trizol 法提取细胞总RNA,紫外分光光度计检测RNA 浓度及纯度,并将RNA 逆转录为cDNA,严格按照说明书进行RT-PCR 反应,并计算GPX4mRNA、system Xc-mRNA 相对表达量。
1.5.7 胃窦组织GPX4 蛋白、system Xc-蛋白表达检测[16]用Western blot 法检测胃窦组织GPX4 蛋白表达水平。具体方法如下:取适量冻存的胃窦组织,研磨后于冰山裂解,混匀,30 min 后置于离心机上离心(4 ℃,10 000 r/min,半径15 cm,离心10 min),取适量上清液与PBS 混匀,用BCA 法测定蛋白浓度,严格按照说明书进行电泳、转膜、封闭、稀释,加入稀释后的GPX4 抗体、system Xc-抗体,4 ℃孵育过夜、TBST、加入HRP 二抗,恒温37 ℃下继续孵育1 h,ECL 化学液化显影,凝胶成像系统进行分析,计算目标蛋白条带的相对表达量。
1.6 统计学方法
所有数据均用SPSS 22.0 进行数据处理,各检测指标统计数据均用“±s”表示。计量资料符合正态分布、方差齐性者,组间比较用单因素方差分析,若存在差异, 进一步的组间两两比较采用LSD 检验,方差不齐则选用Tamhane’s T2 检验,Pearson 检验描述组间比较的相关性。均以P<0.05 为差异具有统计学意义。
2 结果
2.1 各组大鼠胃内残留率、小肠推进率比较
与空白组相比,模型组大鼠的胃内残留率明显升高、小肠推进率明显降低(P<0.05);与模型组相比,电针组、西药组的胃内残留率下降、小肠推进率升高(P<0.05);与西药组相比,电针组的胃内残留率明显下降、小肠推进率明显升高(P<0.05)。 详见表1。
表1 各组大鼠胃内残留率、小肠推进率比较(±s,%)

表1 各组大鼠胃内残留率、小肠推进率比较(±s,%)
注:与空白组比较,▲P<0.05;与模型组比较,▼P<0.05;与西药组比较,▽P<0.05。
组 别空白组模型组电针组西药组n 10 10 10 10胃内残留率40.28±13.78 46.91±13.41▲42.35±12.84▼▽43.71±13.43▼小肠推进率64.11±10.33 57.69±7.76▲62.23±7.43▼▽61.25±7.55▼
2.2 各组大鼠胃窦组织Fe2+浓度比较
与空白组相比,模型组大鼠的胃窦组织Fe2+浓度升高(P<0.05);与模型组相比,电针组、西药组大鼠胃窦组织Fe2+浓度降低(P<0.05);与西药组相比,电针组大鼠的胃窦组织Fe2+浓度降低(P<0.05)。 详见表2。
表2 各组大鼠胃窦组织Fe2+含量比较(±s,μmol/g)

表2 各组大鼠胃窦组织Fe2+含量比较(±s,μmol/g)
注:与空白组比较,▲P<0.05;与模型组比较,▼P<0.05;与西药组比较,▽P<0.05。
组 别空白组模型组电针组西药组n 10 10 10 10 Fe2+12.51±0.59 14.01±0.61▲13.27±0.65▼▽13.83±0.69▼
2.3 胃窦组织GSH、MDA 含量比较
与空白组相比,模型组大鼠胃窦组织MDA 含量增高、GSH 含量降低(P<0.05);与模型组相比,电针组、西药组大鼠胃窦组织MDA 含量降低、GSH含量升高(P<0.05);与西药组相比,电针组大鼠胃窦组织MDA 含量降低、GSH 含量升高(P<0.05)。详见表3。
表3 各组大鼠胃窦组织GSH、MDA 含量比较(±s)
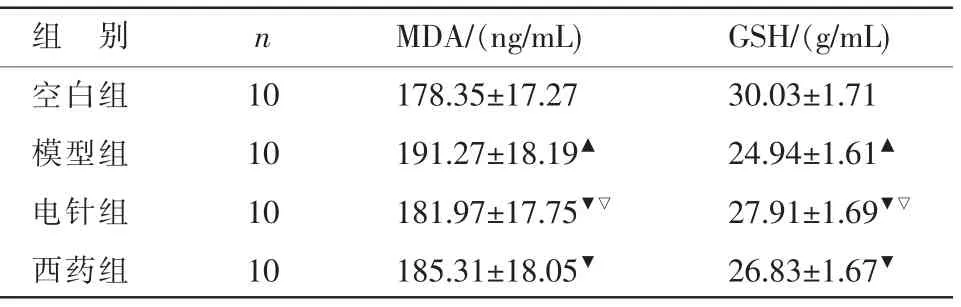
表3 各组大鼠胃窦组织GSH、MDA 含量比较(±s)
注:与空白组比较,▲P<0.05;与模型组比较,▼P<0.05;与西药组比较,▽P<0.05。
组 别空白组模型组电针组西药组n 10 10 10 10 MDA/(ng/mL)178.35±17.27 191.27±18.19▲181.97±17.75▼▽185.31±18.05▼GSH/(g/mL)30.03±1.71 24.94±1.61▲27.91±1.69▼▽26.83±1.67▼
2.4 各组大鼠胃窦组织细胞脂质ROS 含量比较
与空白组相比,模型组大鼠胃窦组织脂质ROS含量明显升高(P<0.05);与模型组相比,电针组、西药组大鼠胃窦组织脂质ROS 含量降低(P<0.05);与西药组相比,电针组大鼠胃窦组织脂质ROS含量降低(P<0.05)。 详见表4。
表4 各组大鼠胃窦组织细胞脂质ROS 含量比较(±s,%)

表4 各组大鼠胃窦组织细胞脂质ROS 含量比较(±s,%)
注:与空白组比较,▲P<0.05;与模型组比较,▼P<0.05;与西药组比较,▽P<0.05。
组 别空白组模型组电针组西药组n 10 10 10 10 ROS 3.01±0.01 3.93±0.07▲3.11±0.03▼▽3.57±0.05▼
2.5 各组大鼠胃窦组织GPX4mRNA、system XcmRNA 表达水平的比较
与空白组相比,模型组大鼠胃窦组织GPX4mRNA、system Xc-mRNA 表达降低(P<0.05);与模型组相比,电针组、西药组大鼠胃窦组织GPX4mRNA、system Xc-mRNA 表达增强(P<0.05);与西药组相比,电针组大鼠胃窦组织GPX4mRNA、system XcmRNA 表达增强(P<0.05)。 详见表5。
表5 各组大鼠胃窦组织GPX4mRNA、system Xc-mRNA表达水平的比较(±s)
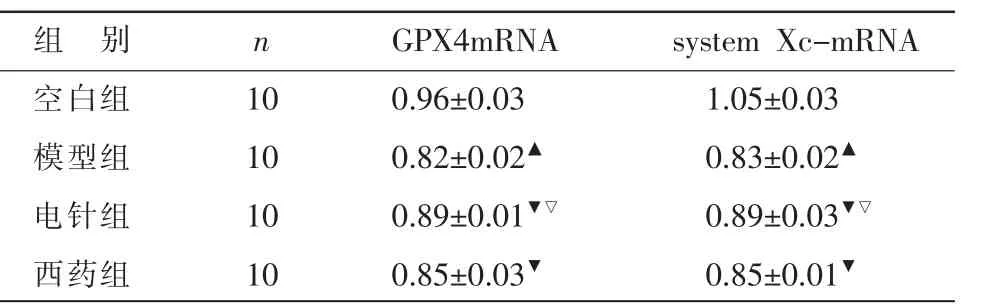
表5 各组大鼠胃窦组织GPX4mRNA、system Xc-mRNA表达水平的比较(±s)
注:与空白组比较,▲P<0.05;与模型组比较,▼P<0.05;与西药组比较,▽P<0.05。
组 别空白组模型组电针组西药组n 10 10 10 10 GPX4mRNA 0.96±0.03 0.82±0.02▲0.89±0.01▼▽0.85±0.03▼system Xc-mRNA 1.05±0.03 0.83±0.02▲0.89±0.03▼▽0.85±0.01▼
2.6 各组大鼠胃窦组织GPX4 蛋白、system Xc-蛋白表达水平的比较
与空白组相比,模型组大鼠胃窦组织GPX4 蛋白、system Xc-蛋白表达降低(P<0.05);与模型组相比,电针组、西药组大鼠胃窦组织GPX4 蛋白、system Xc-蛋白表达增强(P<0.05);与西药组相比,电针组大鼠胃窦组织GPX4 蛋白、system Xc-蛋白表达增强(P<0.05)。 详见表6。
表6 各组大鼠胃窦组织GPX4 蛋白、system Xc-蛋白表达水平的比较(±s)

表6 各组大鼠胃窦组织GPX4 蛋白、system Xc-蛋白表达水平的比较(±s)
注:与空白组比较,▲P<0.05;与模型组比较,▼P<0.05;与西药组比较,▽P<0.05。
组 别空白组模型组电针组西药组n 10 10 10 10 GPX4/β-actin 1.17±0.09 0.81±0.05▲0.93±0.07▼▽0.88±0.03▼system Xc-/β-actin 1.13±0.11 0.85±0.03▲0.97±0.07▼▽0.91±0.05▼
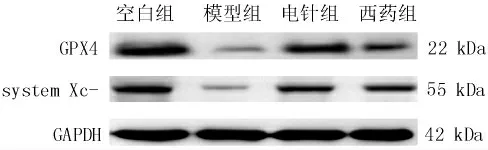
图1 各组大鼠胃窦组织GPX4 蛋白、system Xc-蛋白相对表达情况
2.7 各组大鼠胃内残留率、小肠推进率与胃窦组织铁死亡相关因子相关性的比较
各组大鼠胃内残留率与胃窦组织Fe2+、MDA、ROS 成正相关(r=0.50,P<0.05),与GSH、GPX4mRNA、system Xc-mRNA、GPX4 蛋白、system Xc-蛋白成负相关(r=-0.51,P<0.05);各组大鼠小肠推进率与胃窦组织与Fe2+、MDA、ROS 成负相关(r=-0.49,P<0.05),与GSH、GPX4mRNA、system Xc-mRNA、GPX4蛋白、system Xc-蛋白成正相关(r=0.51,P<0.05)。 详见表7。
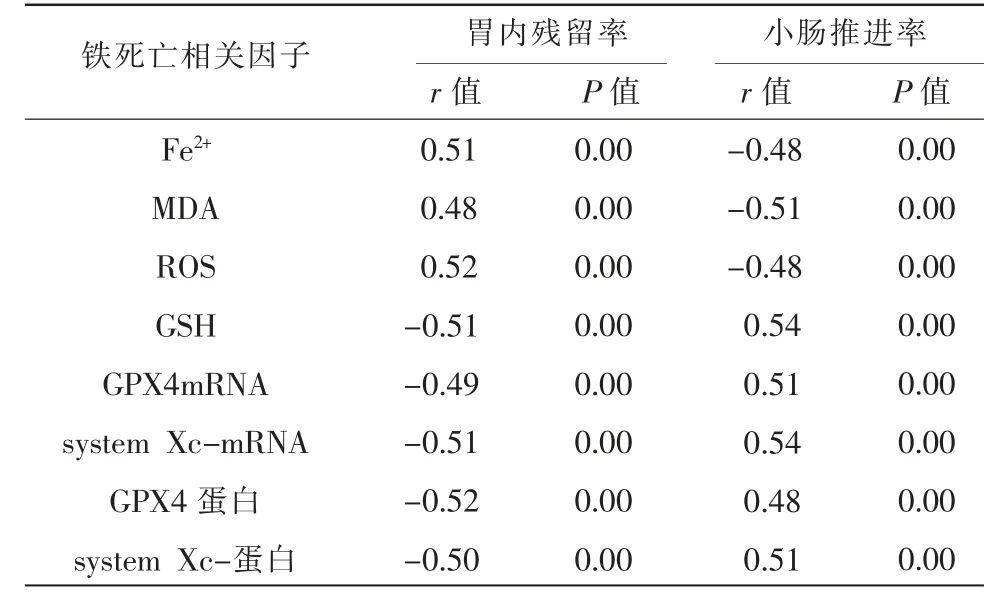
表7 各组大鼠胃内残留率、小肠推进率与胃窦组织铁死亡相关因子相关性的比较
3 讨论
FD 属于中医学“痞满”的范畴,中医认为情绪紧张、饮食不洁等因素致使脾失健运,运化精微无力,从而诱发本病[17]。 足三里穴为胃经合穴、下合穴,能健脾燥湿、生发胃气,主治消化不良等胃肠病。 《灵枢·四时气》有云:“着痹不去,久寒不已,卒取其三里。骨为干。肠中不便,取三里,盛泻之,虚补之。……取三里以下。 胃气逆,则刺少阳血络以闭胆逆,却调其虚实,以去其邪[18]。”本研究常用多因素造模,运用电针足三里调节FD 胃动力水平,研究结果显示,与空白组相比,模型组大鼠的胃内残留率升高、小肠推进率降低(P<0.05),造模后食物在胃肠道内停留时间延长,说明胃肠道消化功能出现障碍,结合大鼠便溏、体质量减轻等症状,说明造模成功。 与模型组相比,电针组、西药组FD 大鼠胃内残留率降低、小肠推进率升高(P<0.05),说明电针与西药对FD大鼠胃肠功能具有良性调节作用;与西药组相比,电针组FD 大鼠胃内残留率降低、小肠推进率升高(P<0.05),说明电针较多潘立酮更能良性调节FD 大鼠胃肠动力功能,经过电针治疗,FD 大鼠胃肠功能障碍情况有所缓解。
铁死亡是一种铁依赖性的,区别于细胞凋亡、细胞坏死、细胞自噬的新型细胞程序性死亡方式[19],主要表现为细胞内铁离子积累、GSH 耗竭和脂质过氧化。在Fe2+的作用下,通过芬顿反应可启动细胞膜脂质体过氧化,产生羟自由基和过氧自由基,活化的自由基通过损伤细胞膜系统造成细胞死亡[20]。 GSH 主要发挥抗氧化、清除自由基作用,与多种生理、病理代谢产物结合,将其转化为无害物质排出体外;system Xc-是调节细胞内外GSH 平衡状态的主要蛋白,system Xc-将细胞外胱氨酸转运到细胞,转化为半胱氨酸用于GSH 的合成,同时将细胞内谷氨酸转运到细胞外,调节细胞内外氨基酸水平来影响GSH合成[21]。 研究发现,抑制system Xc-时,导致细胞内GSH 的合成减少,氧自由基堆积,诱导细胞铁死亡[22]。GPX4 是谷胱甘肽过氧化物酶家族成员之一,是一种富含硒元素的蛋白酶,能够特异性降解细胞膜脂质过氧化物,GPX4 在GSH 的作用下,使得脂质过氧化的过氧键转变为羟基,失去其过氧化物的活性,降低铁死亡的发生[23]。 研究表明,GPX4 与铁死亡发生密切相关,如果GPX4 活性受到抑制,启动脂质过氧化,导致细胞内脂质ROS 堆积,脂质ROS 是脂质过氧化的产物,在铁的参与下产生氧自由基,引起细胞损伤[24]。 生物体内自由基作用于脂质发生过氧化反应,氧化终产物为丙二醛(malondialdehyde, MDA),MDA 会引起蛋白质、核酸等生命大分子交联聚合,且具有细胞毒性。 因此,脂质氧化终产物MDA 在体外影响线粒体呼吸链复合物及线粒体内关键酶活性,它的产生还能加剧细胞膜的损伤,因而测试MDA的量可反映机体脂质过氧化的程度,间接反应出细胞损伤的程度[25]。
研究结果显示:与空白组相比,模型组大鼠胃窦组织Fe2+含量、MDA 浓度、细胞脂质ROS 含量升高,GSH 浓度、GPX4mRNA、system Xc-mRNA、GPX4 蛋白、system Xc-蛋白表达降低(P<0.05),上述结果表明造模后FD 大鼠胃窦细胞铁死亡发生频率提高;与模型组相比,电针组、西药组FD 大鼠胃窦组织Fe2+含量、MDA 浓度、脂质ROS 含量降低,GSH 浓度、GPX4mRNA、system Xc-mRNA、GPX4 蛋白、system Xc-蛋白表达升高(P<0.05),说明电针和多潘立酮均能抑制FD 大鼠胃窦组织细胞铁死亡的发生;与西药组相比,电针组FD 大鼠胃窦组织胃窦组织Fe2+含量、MDA 浓度、脂质ROS 含量降低,GSH 浓度、GPX4mRNA、system Xc-mRNA、GPX4 蛋白、system Xc-蛋白表达升高(P<0.05),说明电针较多潘立酮更能抑制FD 大鼠胃窦组织铁死亡的发生。相关性分析结果显示:各组大鼠胃内残留率与胃窦组织Fe2+含量、MDA浓度、脂质ROS 含量成正相关(r=0.50,P<0.05),与GSH、GPX4mRNA、system Xc-mRNA、GPX4 蛋白、system Xc-蛋白成负相关(r=-0.51,P<0.05);各组大鼠小肠推进率与胃窦组织与Fe2+、MDA、脂质ROS 含量成负相关(r=-0.49,P<0.05),与GSH、GPX4mRNA、system Xc-mRNA、GPX4 蛋白、system Xc-蛋白成正相关(r=0.51,P<0.05), 说明铁死亡的发生与FD 大鼠胃肠动力障碍密切相关。
综上所述,胃窦组织细胞铁死亡的发生与FD大鼠胃肠动力障碍密切相关,本研究进一步揭示电针可能是通过抑制FD 大鼠胃窦组织铁死亡,来实现缓解FD 大鼠胃肠动力障碍,良性调节FD 大鼠胃肠动力功能。 本研究为认识FD 提供了新途径,为探索针灸治疗FD 提供了新靶点,为今后进一步研究针灸治疗FD 提供了参考的试验依据。

