基于OPG/RANK/RANKL 信号通路探究益肾健骨颗粒对绝经后骨质疏松大鼠BMSCs 成骨分化的影响
刘 勇,易振宇,张信成
(1.湖南省中西医结合医院医保科,湖南 长沙 410006;2.湖南省中西医结合医院脊柱骨肿瘤科,湖南 长沙 410006;3.湖南省中西医结合医院创伤关节科,湖南 长沙 410006)
骨质疏松症主要表现为骨量减少、骨微结构破坏,可增加骨折风险,多发于老年人,在绝经后的女性中发病率高达50%,雌激素替代疗法为治疗骨质疏松症的有效措施,但是长期使用可增加乳腺癌的风险[1-2]。 益肾健骨颗粒具有补益肝肾、益气养血、化瘀通络的作用,对芳香化酶抑制剂相关的肌肉骨骼症状具有良好的改善作用[3]。骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSCs)可分化为成骨细胞,在维持骨的重建过程中发挥重要作用[4]。 研究显示,健骨颗粒可以调低miR-141 的表达,促进BMSCs 成骨分化[5]。 骨保护素(osteoprotegerin,OPG)/核因子κB 受体活化因子(receptor activator of nuclear factor-kappa B, RANK)/RANK 配体(RANK ligand, RANKL)信号通路在骨吸收与骨形成过程中发挥调控作用,激活OPG/RANKL/RANK 信号通路可抑制破骨细胞的分化和成熟,促进BMSCs细胞成骨分化[6]。 因此,本研究探索肾健骨颗粒对绝经后骨质疏松大鼠BMSCs 成骨分化及OPG/RANK/RANKL 信号通路的影响,以期阐明其作用机制。
1 材料与方法
1.1 动物
SPF 级SD 雌性未受孕大鼠(7~8 周龄),体质量(200±20) g,购自广州中医药大学[生产许可证号:SCXK(粤)2019-0047]。
1.2 主要材料
益肾健骨颗粒(批号:20210320,湖南省中医药研究院制剂室);β-磷酸甘油钠(批号:G9422)、地塞米松磷酸钠注射液(批号:D1576)、茜素红S(批号:A5533)均购自美国Sigma 公司;OPG 小干扰RNA(small interfering RNA-OPG, si-OPG,批号:Z190301)、小干扰RNA 阴性对照(small interfering RNA negative control, si-NC,批号:A20210324)、碱性磷酸酶(alkaline phosphatase, ALP,批号:202104085)、Runt 相关转录因子2(Runt-associated transcription factor 2,Runx2,批号:202006011)、骨钙素(osteocalcin, OCN,批号:H20210816)引物均购自广州锐博生物科技有限公司;反转录第一链cDNA 合成试剂盒(批号:K1622,美国Thermo Fisher 公司);通用型荧光定量试剂盒(批号:04913914001,美国Roche 公司);5-溴-4-氯-3-吲哚基-磷酸盐(5-bromo-4-chloro-3-indolyl phosphate, BCIP)/四唑硝基蓝(nitro blue tetrazolium chloride monohydrate, NBT)碱性磷酸酯酶显色试剂盒(批号:C3206)及ALP 活性试剂盒(批号:P0321M)均购自碧云天生物科技有限公司;OPG(sc-390518)、RANK(批号:sc-59981)、RANKL(批号:sc-52950)抗体均购自美国Santa cruz 公司;异硫氰酸荧光素(fluorescein isothiocyanate, FITC)荧光标记抗体CD29-FITC(批号:ab21845)、藻红蛋白(phycoerythrin,PE)标记的CD44-PE(批号:ab23396)、CD45-FITC(批号:ab33916)和CD34-PE(批号:ab223930)抗体均购自美国Abcam 公司。 凝胶成像系统(型号:FluorChem HD2, 美国自然基因科技有限公司);流式细胞仪(型号:CytoFLEX, 美国贝克曼库尔特公司);相差显微镜(型号:CX23,日本奥林巴斯公司)。
1.3 方法
1.3.1 含药血清制备 给予大鼠益肾健骨颗粒灌胃,根据大鼠与人药物计量换算关系,大鼠每日用量为140 mg,溶解于0.5 mL 生理盐水。 另取大鼠给予不含药的生理盐水0.5 mL 灌胃。 所有大鼠均给药1周,给药结束后,腹主动脉采全血后,1500 r/min,离心半径10 cm,离心10 min 取上清液并过滤除菌,分别获得益肾健骨颗粒含药血清及正常血清,置于-20 ℃冰箱冷冻备用。
1.3.2 BMSCs 细胞分离与鉴定 参照文献[7]中的方法,采用背侧双切口切除双侧卵巢建立绝经后骨质疏松模型,术后1 d 开始各组每日注射青霉素(2.0×105 IU/kg),共3 d。造模12 周后,用microCT 股骨远端扫描及检测体质量,当骨密度,骨体积分数、骨小梁数量等数值较正常显著降低时,提示造模成功[8]。
造模成功后断颈处死大鼠,无菌条件分离股骨和胫骨,去两端骨骺暴露骨髓腔,使用注射器注射α-MEM 培养基反复吹打骨髓腔,收集细胞并过滤,接种至培养瓶中常规传代培养,每隔3 d 换液,取第3 代BMSCs 用于后续实验,倒置相差显微镜观察细胞形态。
流式细胞术鉴定BMSCs 表面标志物:收集细胞液,1000 r/min,离心半径10 cm,离心5 min 收集细胞沉淀,PBS 洗涤并重悬,加入CD29-FITC、CD44-FITC、CD45-PE-Cy5.5 和CD34-PE 抗体,避光孵育,流式细胞仪检测。
1.3.3 BMSCs 细胞分组及成骨分化诱导 第3 代BMSCs 制备成1×104/mL 的细胞悬液,接种于6 孔板中,将细胞分为对照组(N 组)、含药血清组(J 组)、含药血清+si-NC 组(J+C 组)、含药血清+si-OPG 组(J+O 组),每组6 个复孔。J+C 组、J+O 组细胞分别转染si-NC、si-OPG 质粒。 转染48 h 后,N 组培养液加入正常血清,其余组培养液中均加入益肾健骨颗粒含药血清。 待细胞融合至约90%时,进行成骨分化诱导培养,使用α-MEM 培养基(含有10% FBS、10 μmol/Lβ-磷酸甘油、10 μmol/L 地塞米松、50 μmol/L维生素C)进行诱导培养,每隔3 d 换成骨分化诱导培养基。
1.3.4 ALP 染色 成骨分化诱导7 d 后,弃去培养液,于4%多聚甲醛中固定15 min,加入BCIP/NBT碱性磷酸酯酶染色液,避光染色30 min,观察染色情况。 另收集细胞,使用ALP 检测试剂盒检测ALP活性。
1.3.5 茜素红S 染色 BMSCs 成骨诱导28 d 后,弃去培养液加入4%多聚甲醛固定30 min, 加入0.2%茜素红S 染色液染色30 min,蒸馏水冲洗多余液体,待细胞干燥后,倒置相差显微镜观察并拍照,随机选取5 个视野,计算矿化结节数。
1.3.6 RT-qPCR 实验检测ALP、Runx2、OCN mRNA表达 收集各组BMSCs 细胞,加入Trizol 试剂提取中总RNA,使用反转录试剂盒反转录合成cDNA,PCR 扩增检测ALP、Runx2、OCN mRNA 相对表达量。 ALP 正向引物为TGGTACTCGGACAATGAGATGC,反向引物为GCTCTTCCAAATGCTGATGAGGT;Runx2 正向引物为CCTCTGACTTCTGCCTCTGG,反向引物为GATGAAATGCTGGGAACTG;OCN 正向引物为GGGCTCCAAGTCCATTGTT,反向引物为ACCCGAATGTTGAGCGAGAG。 以β-ation 为内参,采用2-△△Ct法计算各基因相对表达量。
1.3.7 Western blot 检测OPG、RANK、RANKL 蛋白表达 BMSCs 成骨诱导培养7 d 后,离心收集各组细胞加入RIPA 裂解液裂解细胞,离心收集上清液,BCA 法检测蛋白浓度,取40 μg 蛋白加上样缓冲液煮沸变性后,进行SDS-PAGE 分离蛋白并转膜,分别加入稀释后的OPG、RANK、RANKL 抗体和βactin 抗体,4 ℃摇床过夜,加入相应二抗37 ℃孵育1 h,加入增强ECL 化学发光液显色,FluorChem HD2 凝胶成像系统成像,以β-actin 为内参,Image J软件分析蛋白表达。
1.4 统计学方法
采用SPSS 25.0 进行统计分析。 计量资料符合正态分布及方差齐检验,用“±s”描述,多组间比较行单因素方差分析,组间两两比较行SNK-q 检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 BMSCs 形态观察、鉴定
成功分离BMSCs 细胞,大鼠第1 代细胞培养24 h后,贴壁细胞形态不一,呈现长梭形,培养至第3 代细胞时,细胞铺满瓶底呈梭形,且形态均一,排列紧密呈放射状或旋涡状。 详见图1。
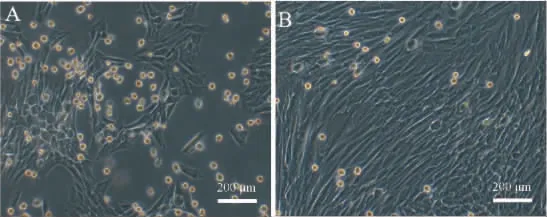
图1 显微镜下观察BMSCs 形态
流式细胞术检测BMSCs 细胞显示:CD29(97.34%)、CD44(98.35%)呈阳性表达,CD45(1.85%)、CD34(2.34%)呈阴性表达。 详见图2。
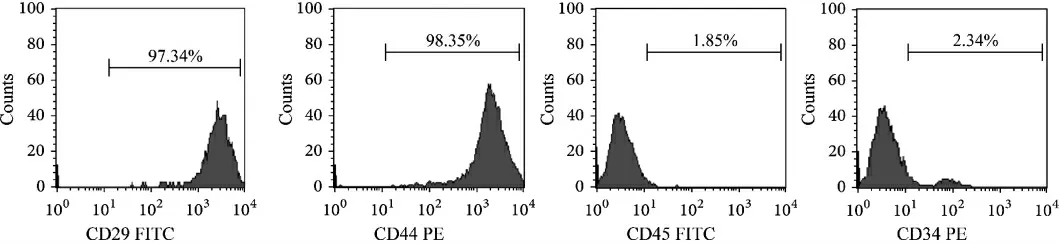
图2 BMSCs 的流式细胞仪分析
2.2 益肾健骨颗粒对BMSCs ALP 的影响
成骨分化诱导7 d 后,ALP 染色阳性为蓝黑色。 与N 组比较,J 组与J+C 组染色加深,ALP 活性明显升高(P<0.05)。 与J 组、J+C 组比较,J+O 组ALP染色变浅,ALP 活性明显降低(P<0.05)。 详见表1、图3。

图3 各组BMSCs 的ALP 染色(×200)
表1 益肾健骨颗粒对BMSCs ALP 活性的影响(±s,n=6)

表1 益肾健骨颗粒对BMSCs ALP 活性的影响(±s,n=6)
注:与N 组相比,*P<0.05;与J+C 组相比,#P<0.05;与J 组相比,&P<0.05。
组别N 组J 组J+C 组J+O 组ALP/(U·L-1)278.26±21.64 426.51±30.29*435.62±28.46*383.47±24.32#&
2.3 益肾健骨颗粒对BMSCs 成骨分化矿化结节的影响
诱导成骨分化28 d 行茜素红染色,矿化结节被染成红色。 J 组、J+C 组较N 组矿化结节数显著增加(P<0.05),J+O 组较J 组、J+C 组矿化结节数显著减少(P<0.05)。 详见图4、表2。
图4 各组BMSCs 成骨分化的茜素红染色(×200)
表2 益肾健骨颗粒对BMSCs 成骨分化矿化结节的影响(±s,n=6)

表2 益肾健骨颗粒对BMSCs 成骨分化矿化结节的影响(±s,n=6)
注:与N 组相比,*P<0.05;与J+C 组相比,#P<0.05;与J 组相比,&P<0.05。
组别N 组J 组J+C 组J+O 组矿化结节数/个6.53±1.13 15.43±2.76*14.90±2.95*9.53±1.78#&
2.4 益肾健骨颗粒对BMSCs 成骨分化相关基因mRNA 表达的影响
与N 组比较,J 组与J+C 组ALP、Runx2、OCN mRNA 表达水平显著升高(P<0.05)。 与J 组、J+C 组比较,J+O 组ALP、Runx2、OCN mRNA 表达水平显著降低(P<0.05)。 详见表3。
表3 益肾健骨颗粒对BMSCs 细胞成骨分化相关基因表达的影响(±s,n=6)
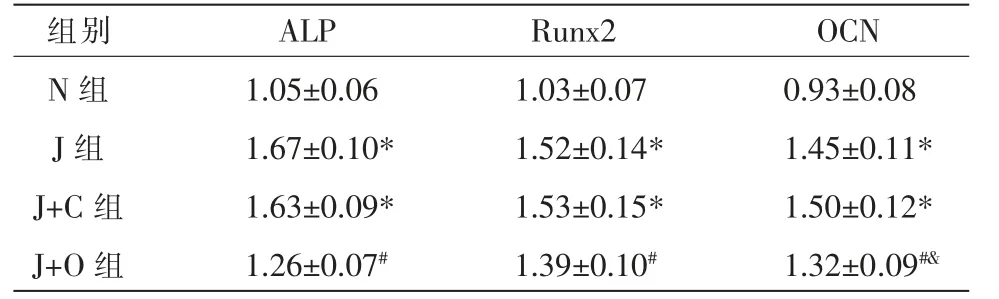
表3 益肾健骨颗粒对BMSCs 细胞成骨分化相关基因表达的影响(±s,n=6)
注:与N 组相比,*P<0.05;与J+C 组相比,#P<0.05;与J 组相比,&P<0.05。
组别N 组J 组J+C 组J+O 组ALP 1.05±0.06 1.67±0.10*1.63±0.09*1.26±0.07#Runx2 1.03±0.07 1.52±0.14*1.53±0.15*1.39±0.10#OCN 0.93±0.08 1.45±0.11*1.50±0.12*1.32±0.09#&
2.5 益肾健骨颗粒对BMSCs 蛋白OPG、RANK、RANKL 表达的影响
与N 组比较,J 组与J+C 组OPG 表达水平显著升高(P<0.05),RANK、RANKL 表达水平显著降低(P<0.05)。 与J 组、J+C 组比较,J+O 组OPG 表达水平显著降低(P<0.05),RANK、RANKL 表达水平显著升高(P<0.05)。 详见图5、表4。

图5 Western blot 检测各组BMSCs 蛋白OPG、RANK、RANKL 表达
表4 各组细胞OPG、RANK、RANKL 蛋白表达比较(±s,n=6)
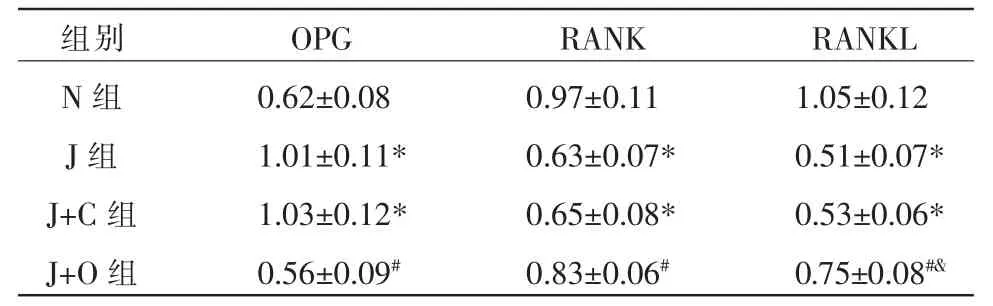
表4 各组细胞OPG、RANK、RANKL 蛋白表达比较(±s,n=6)
注:与N 组相比,*P<0.05;与J+C 组相比,#P<0.05;与J 组相比,&P<0.05。
组别N 组J 组J+C 组J+O 组OPG 0.62±0.08 1.01±0.11*1.03±0.12*0.56±0.09#RANK 0.97±0.11 0.63±0.07*0.65±0.08*0.83±0.06#RANKL 1.05±0.12 0.51±0.07*0.53±0.06*0.75±0.08#&
3 讨论
BMSCs 在一定的条件下可向软骨细胞、成骨细胞、脂肪细胞、心肌细胞等分化,BMSCs 在成骨诱导条件下,向成骨细胞分化,促进BMSCs 成骨分化是治疗与预防骨质疏松症的有效策略[9-10]。 目前, 促进BMSCs 成骨分化的报道有很多,中药提取物如补骨脂素可诱导BMSCs 成骨分化[11]。 另有研究显示,固本增骨方(炙黄芪、当归、烫狗脊)含药血清可促进BMSCs 的增殖,并诱导其成骨分化[12]。中医学认为骨质疏松症是脾虚、肾亏等引起的,益肾健骨颗粒主要由千年健、红花、砂仁、熟地黄等构成,方中千年健有强筋止痛功效,红花、丹参具有益气活血的作用,淫羊藿有活血补肾的作用,熟地黄可以强筋健骨,诸药合用可以强筋健骨、补肾健脾之功效[13-14]。 本研究建立绝经后骨质疏松大鼠模型,经前期研究,灌胃给药益肾健骨颗粒可改善大鼠的骨质疏松症,但其具体作用机制尚不清楚。
本研究建立绝经后骨质疏松大鼠模型,成功分离大鼠的BMSCs 细胞,经观察细胞形态与鉴定细胞表面标志物,与相关报道[15]一致。 本研究BMSCs 细胞使用益肾健骨颗粒含药血清培养后,经成骨分化诱导培养7 d 后,ALP 染色加深,ALP 活性明显升高(P<0.05),诱导成骨分化28 d 行茜素红染色显示矿化结节数显著升高(P<0.05),提示益肾健骨颗粒可能具有促进BMSCs 细胞成骨分化的作用。 Runx2是成骨过程中最重要的转录因子,调控间充质干细胞向成骨细胞分化;OCN 为钙结合蛋白,参与骨钙代谢,可反映骨形成[16-17]。本研究RT-qPCR 检测ALP、Runx2、OCN mRNA 表达显示,J 组ALP、Runx2、OCN mRNA表达水平显著升高(P<0.05),证实益肾健骨颗粒有促进BMSCs 细胞成骨分化的作用。
OPG/RANK/RANKL 信号通路在参与骨代谢、免疫调节、肿瘤发生方面发挥重要调控作用,该通路可诱导破骨细胞分化成熟、促进骨吸收,而上调OPG 水平可降低RANKL 与RANK 的相互作用,降低骨吸收,促进成骨分化[18-19]。 激活OPG/RANKL/RANK信号通路可抑制破骨细胞的分化和成熟,促进BMSCs向成骨分化[20]。 本研究结果显示,经益肾健骨颗粒含药血清的大鼠BMSCs 细胞中OPG 表达水平显著升高(P<0.05),RANK、RANKL 表达水平显著降低(P<0.05),提示益肾健骨颗粒可调节OPG/RANK/RANKL信号通路。本研究结果也显示,与只经益肾健骨颗粒含药血清处理的BMSCs 细胞相比, 先转染抑制OPG 表达、 再用含药血清处理的BMSCs 细胞的OPG 表达水平显著降低,RANK、RANKL 表达水平显著升高,且ALP 活性及矿化结节数降低,即抑制OPG 表达可部分逆转益肾健骨颗粒对BMSCs 细胞成骨分化的促进作用。 以上结果表明,益肾健骨颗粒可通过调节OPG/RANK/RANKL 信号通路,促进绝经后骨质疏松大鼠BMSCs 成骨分化。
综上所述,益肾健骨颗粒可通过调节OPG/RANK/RANKL 信号通路,促进绝经后骨质疏松大鼠BMSCs 成骨分化。

