黄连素对脑出血大鼠脑组织免疫炎症反应的影响
任怡君,陈玺倩,卢 伟*
(中南大学湘雅二医院神经病学科,湖南 长沙 400012)
脑出血(intracerebral hemorrhage, ICH)是一种常见的、具有高死亡率及高致残率的脑血管疾病[1]。ICH 造成脑组织损伤的原因包括由血肿直接引起占位和压迫作用造成的原发性损伤,以及由于脑水肿、释放的血液成分以及炎症反应等造成的继发性损伤[2]。免疫炎症反应失调是ICH 后继发神经功能损伤的重要原因[3]。ICH 后血肿附近区域小胶质细胞被激活,同时外周的炎性细胞通过受损的血脑屏障浸润脑组织,并产生大量炎性细胞因子,引起脑水肿并导致大量脑细胞死亡[4-5]。 但这些免疫细胞对于血肿的清除也起到了至关重要的作用[5]。 小胶质细胞是中枢神经系统中重要的免疫细胞,活化后主要分化为M1(促炎型)和M2(抗炎型)亚型[6]。 调节小胶质细胞的M1/M2 比例可以影响免疫炎症反应的程度,可能改善患者的临床结局,然而目前临床上尚缺乏针对性药物。
黄连素是中药黄连中的主要有效活性成分之一。 黄连素易于透过血脑屏障,其药理作用广泛,具有抗菌、消炎、抗病毒、降血糖、降血脂、抗抑郁、抗肿瘤等生物学活性[7]。 在脑缺血再灌注、阿尔茨海默病、帕金森病等神经系统疾病的研究中,黄连素表现为脑保护作用[8]。黄连素可以通过对神经递质的调节起到改善神经退行性疾病的作用[9]。但是对于ICH 后黄连素治疗是否可以减轻脑组织中免疫炎症反应尚无具体报道。 因此,本研究通过建立ICH 大鼠模型,探究黄连素对ICH 的具体治疗作用。
1 资料和方法
1.1 实验对象及分组
体质量为250~300 g 的SPF 级雄性SD 大鼠,购自湖南斯莱克景达动物实验公司。 实验动物饲养在湖南省人民医院实验动物中心清洁级动物房中,饲养环境温度恒定,遵循昼夜节律,每日光照时间12 h,自由摄取食物及饮用水。将48 只SD 大鼠随机分为3 组:假手术(Sham)组,模型(ICH)组,黄连素(BBR)组。 各组大鼠分为24 h 及72 h 两个时间点,每个亚组8 只。
1.2 主要试剂和仪器
Ⅳ型胶原酶(美国Sigma 公司,批号:V900893);10%水合氯醛(湖南维世尔生物科技有限公司,批号:WB05007A);黄连素(盐酸小檗碱片)(江苏亚邦药业,批号:H32024537);基质金属蛋白酶9(matrix metalloproteinase-9, MMP-9)一抗、离子钙接头蛋白分子1(ionizedcalciumbindingadaptor molecule-1,Iba1)一抗(英国Abcam 公司,批号:ab76003、ab5076);肿瘤坏死因子α(tumor necrosis factor α, TNF-α)一抗、白细胞介素-6(interleukin-6, IL-6)一抗、精氨酸酶-1(arginase-1, Arg-1)一抗、诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)一抗(美国Proteintech 公司,批号:17590-1-AP、21865-1-AP、16001-1-AP、18985-1-AP)。
脑立体定位仪(安徽正华生物仪器设备公司,型号:ZH-蓝星B);大鼠用颅骨钻(北京众实迪创科技发展有限责任公司,型号:ZS-GSZ);台式冷冻离心机(湖南湘仪实验室仪器开发有限公司,型号:H1650R);电泳仪、转膜仪(北京六一生物科技有限公司,型号:DYY-6C、DYCZ-40D);光学显微镜(麦克奥迪实业集团有限公司,型号:BA410T)。
1.3 造模方法
1.3.1 ICH 大鼠模型的建立 采用Ⅳ型胶原酶法造模[10]。 按照0.004 mL/g 的剂量腹腔注射10%水合氯醛麻醉大鼠。麻醉成功后,将大鼠固定于脑立体定位仪上。剔除头部毛发,消毒,剪开中线处的头部皮肤,暴露前囟,以前囟为原点,以向右3 mm、向前1 mm、深5 mm 为注射点,颅骨钻钻开颅骨,缓慢插入微量注射器到目标注射点,以0.4 μL/min 的速度注入2 μL胶原酶溶液(含0.2 U Ⅳ型胶原酶),留针10 min,后将注射器取出,骨蜡封闭钻孔,逐层缝合组织。Sham 组大鼠注入等量生理盐水。术后大鼠送回动物房。待大鼠麻醉复苏后,使用Zea Longa 评分方法判断造模是否成功。 Zea Longa 评分包含0~4 分,神经功能缺损越严重则得分越高,其中1~3 分的大鼠视为造模成功,0 分及4 分者予以剔除[11]。
1.3.2 黄连素给药方法 ICH 大鼠模型构建成功后,采用灌胃法对大鼠进行黄连素干预,200 mg/kg,每日1 次,直至处死当日。 其余组采用等量纯净水灌胃处理。
1.4 检测指标
1.4.1 改良Garcia 评分[11]评估大鼠神经功能缺损 采用0~3 分4 级评分方式,从以下6 个方面对动物的表现进行评分:运动的自主性、体态对称性、前肢伸展运动、网壁攀爬能力、两侧躯体触觉反应和两侧胡须触觉反应。 总分最低3 分、最高18 分,分数越高说明神经功能缺损越轻,18 分代表无神经功能缺损。1.4.2 Western blot 法检测MMP-9、TNF-α 和IL-6含量 将血肿周围新鲜脑组织匀浆,提取总蛋白并定量。 取等量裂解产物,上样,电泳,转膜,室温封闭1 h,将膜于一抗中4 °C 孵育过夜,TBST 洗膜3 次,每次5 min。 二抗37 °C 孵育2 h,TBST 洗膜3 次,每次5 min,ECL 化学发光法显色,运用ImageJ 图像分析系统进行灰度分析。
1.4.3 免疫荧光染色法标记脑组织中小胶质细胞
取脑组织切片室温放置30 min 后洗涤、室温孵育,加入一抗4 °C 过夜,PBS 振洗3 次,每次15 min,二抗孵育90 min,PBS 振洗3 次,每次15 min,封片。使用激光共聚焦显微镜观察及拍照。
1.5 统计学分析
采用Graphpad Prism 8.0 软件对数据进行统计分析以及绘图。 各组计量数据以“±s”表示,采用One-way ANOVA 检验比较各组间的差异,方差齐者采用LSD-t 检验,方差不齐者采用Dunnett's 检验。以P<0.05 为差异具有统计学意义。
2 结果
2.1 ICH 大鼠模型的建立
以10%水合氯醛麻醉SD 大鼠后,采用Ⅳ型胶原酶法造模。 Sham 组未见明显的脑组织内血肿形成;ICH 组大鼠尾状核区出现明显的血肿组织,提示ICH 模型构建成功。 详见图1。

图1 大鼠脑组织冠状切面
2.2 黄连素干预对大鼠改良Garcia 评分的影响
与Sham 组相比,ICH 组大鼠在24 h 及72 h改良Garcia 评分明显降低(P<0.05)。与ICH 组相比,BBR 组大鼠在24 h 时改良Garcia 评分差异无统计学意义(P>0.05),在72 h 时改良Garcia 评分呈回升趋势,但差异无统计学意义(P>0.05)。 详见表1。
表1 各组大鼠改良Garcia 评分(±s,n=8,分)
注:与Sham 组比较,*P<0.05。
时间点24 h 72 h Sham 组17.50±0.58 17.25±0.50 ICH 组11.25±1.50*9.25±1.71*BBR 组11.25±0.50 10.25±0.96
2.3 黄连素干预后ICH 大鼠血肿周围脑组织中炎症因子表达情况
与同时间点Sham 组相比,ICH 组大鼠脑组织中MMP-9、TNF-α、IL-6 表达均明显增加(P<0.05)。24 h 时,与ICH 组相比,BBR 组大鼠脑组织中MMP-9 表达明显降低(P<0.05),TNF-α 和IL-6 表达降低,但差异无统计学意义(P>0.05)。 72 h 时,与ICH 组相比,BBR 组大鼠脑组织中MMP-9 和TNF-α 表达明显降低(P<0.05),IL-6 表达降低,但差异无统计学意义(P>0.05)。 详见图2。

图2 各组大鼠炎症因子表达情况
2.4 黄连素干预后ICH 大鼠脑组织中小胶质细胞极化情况
24 h 及72 h 时,Sham 组大鼠脑组织中Iba1、i-NOS、Arg-1 荧光信号弱,小胶质细胞基本未活化。与Sham 组相比,24 h 及72 h ICH 组大鼠脑组织中Iba1、iNOS、Arg-1 荧光信号增强;与24 h ICH组相比,72 h ICH 组大鼠脑组织中Arg-1 荧光信号更强。与ICH 组相比,24 h 及72 h BBR 组iNOS 荧光信号减弱,Arg-1 荧光信号增强,且Arg-1 与Iba-1双阳性的细胞(M2 型小胶质细胞)比例升高。 详见图3。
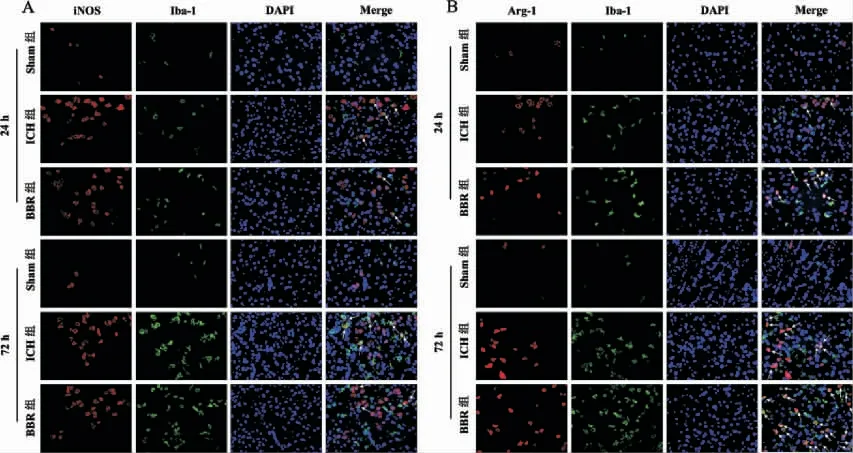
图3 各组大鼠小胶质细胞标记物免疫荧光染色图(×400)
3 讨论
ICH 是第二大卒中类型,具有发病率高、致残率高和死亡率高的特点,已经成为全球危及健康的主要问题之一[1,12]。 ICH 后继发性脑损伤是引起神经功能缺损的主要原因之一,包括脑水肿形成、凝血酶释放、细胞凋亡、血脑屏障破坏和免疫炎症反应等[5],其中免疫炎症反应又是引起继发性脑损伤的重要因素。 ICH 后大量血浆蛋白和细胞因子等物质被释放到组织间隙中,继而激活补体、免疫系统[13],引起局部和全身炎症反应,造成脑组织损伤以及炎症水肿,但是免疫炎症反应同时也参与了血肿清除等修复过程[5]。 因此,调控免疫炎症反应可能有助于清除血肿、减轻脑水肿,从而改善ICH 造成的神经功能障碍[14-15]。 然而,目前临床上ICH 继发性损伤的治疗效果不甚理想,特别是缺乏有效调节ICH 后免疫炎症反应的药物,因此,寻找一个理想的治疗药物对改善ICH 患者临床预后具有重要意义。
黄连素是传统中草药黄连中的有效生物活性成分之一,曾经是治疗消化道感染的一线药物,目前随着各项研究的开展,发现其在高血糖、高脂血症、心血管疾病、神经退行性疾病中均可以发挥药理作用[7]。 研究发现,黄连素具有抗炎、抗菌、神经保护、调节免疫等多种生物活性[8,16-17]。 但目前黄连素在ICH中的作用研究甚少。有研究发现,口服黄连素可以抑制线粒体凋亡通路,从而改善ICH 大鼠的神经功能缺损[18],提示黄连素可能有助于ICH 的治疗,但是黄连素是否可以在ICH 后调节脑组织免疫炎症反应尚不清楚。 基于黄连素在既往其他疾病研究中的免疫调节作用,本研究在ICH 大鼠模型中探索黄连素是否可以通过调节ICH 后免疫炎症反应来减轻神经功能缺损,从而改善预后。
本研究结果显示,使用黄连素干预后,ICH 大鼠脑组织中的促炎因子MMP-9、TNF-α、IL-6 表达出现不同程度的下降,因此认为黄连素可能通过缓解ICH 大鼠脑组织中的免疫炎症反应而发挥神经保护作用。
此外,对大鼠脑组织中小胶质细胞活化和极化的研究显示,经黄连素干预的ICH 大鼠脑组织中出现M1 型小胶质细胞比例降低、M2 型小胶质细胞比例升高,且在72 h 时这种小胶质细胞亚型极化的改变趋势更为显著。 既往文献表明,M1 型小胶质细胞为促炎亚型,可造成组织损伤加重,而M2 型小胶质细胞为抗炎亚型,发挥抗炎和神经保护作用[19],小胶质细胞向M2 型极化比例增加可以减轻炎性损伤。 而在黄连素干预24 h 后大鼠神经功能缺损无改善,72 h 后的大鼠神经功能缺损呈现改善趋势,但无统计学差异,推测可能与黄连素干预后观察时间点较短,或与样本量较少有关,下一步实验将适当延长观察时间以及增加实验样本量进行验证。因此,黄连素可能通过下调炎症因子表达、促进小胶质细胞极化为M2 抗炎亚型,从而影响中枢神经系统免疫反应,表现出神经保护作用。
黄连素作为传统中药成分,提取自天然植物中,价格低廉、口服副作用小。 虽然黄连素经胃肠道吸收效果有限,但目前通过纳米技术、微分子等药物新形式提高药物利用度的研究方向是一大热点[20]。本研究发现黄连素具有缓解ICH 后脑组织中免疫炎症反应的作用,为临床上使用黄连素药物作为ICH 辅助治疗方案提供了实验数据。 在未来,黄连素在ICH 中的具体神经保护机制仍有待进一步研究,这对于挖掘和发展中医药医学具有十分重要的意义。

