丹白颗粒对子宫内膜异位症大鼠异位症血管生成及应激水平的影响
姜艳玲,王金华*,李发余,徐善荣,郭海龙
(1.中药制药共性技术国家重点实验室,山东 临沂 276006;2.福建医科大学附属第一医院妇科,福建 福州 350005;3.日照市人民医院妇科,山东 日照 276826)
子宫内膜异位症(endometriosis, EMT)是育龄妇女的常见病,发病率高达10%~15%,经期子宫内膜碎片随经血逆流,通过输卵管种植于卵巢和邻近的盆腔腹膜,随后在种植处继续生长和蔓延,异位病灶组织的生长均有侵袭、局部播散、转移以及复发等诸多方面的特征,最终EMT 形成[1-2]。 据研究,EMT是否发病与激素水平密切相关[3];另有研究发现,氧化应激反应及异位内膜病灶血管生成在EMT 的发生发展中起到重要作用,EMT 患者血清中血管内皮生长因子(vascular endothelial growth factor, VEGF)水平明显升高,血管生成是EMT 种植生长维持的必要条件,VEGF 水平越高则表明促血管生成作用越强[4]。 异位内膜组织病灶处的血管异常增生及炎性反应是EMT 的主要致病基础,抑制血管生成对EMT 的治疗至关重要[5]。目前,EMT 主要依靠手术或药物进行治疗,而中医学在该病的治疗方面有着独特的优势。 大量研究表明,中医药的有效干预能够显著抑制异位病灶的生长,并能有效改善患者临床症状[6]。本研究通过动物实验,探讨丹白颗粒对EMT 大鼠异位内膜组织中血管生成和应激反应的影响[7]。
1 材料与方法
1.1 材料
1.1.1 实验动物 选取48 只SD 大鼠雌性,性成熟,无交配记录,体质量200~240 g,购自北京华阜康有限公司动物研究中心,8~9 周龄,许可证号为SYXK(京)2021-0015,使用许可证号:SYXK(鲁)2018-008,伦理批准编号:NH-IACUC-2021-022,所有大鼠均饲养在中药制药共性技术国家重点实验室动物房中,温度25 ℃,相对湿度50%,保持环境安静、干净、透气,12 h/12 h 间断光照,自由饮食、饮水,定期更换垫料,清洁、消毒鼠笼。
1.1.2 主要仪器与试剂 离心机(H2050R,湘仪离心机仪器有限公司);石蜡切片机(TYJ10,绍兴谱尔仪器设备有限公司);显微镜(E100,尼康公司);酶标仪(SHE-3000,北京赛尔福公司)。 孕三烯酮胶囊(国药准字H19980020,2.5 mg/粒,华润紫竹药业有限公司,生产批号00321081);丹白颗粒(国药准字Z20090651,8 g/袋,山东新时代药业有限公司,生产批号2111222);VEGF 检测试剂盒购自北京兴康生物科技有限公司;测定促卵泡生成素(follicle stimulating hormone, FSH,批号:140625-201411)、促黄体生成素(luteinizing hormone, LH,批号:120903-201510)、孕酮(proges-terone, P,批号:111826-201806)试剂盒购自上海酶联生物科技有限公司;超氧化物歧化酶(superoxide dismutase,SOD,批号:111854-201905)、丙二醛(malondialdehyde,MDA,批号:121038-201405)、谷胱甘肽过氧化物酶(glutathione peroxidase, GSHPx,批号:100533-201805)检测试剂盒由北京生物工程研究所提供。
1.2 方法
1.2.1 模型制备 按SPF 级动物要求饲养,采用戊酸雌二醇灌胃使大鼠处于统一动情期,选择动情周期4~5 d、有连续2 个正常动情周期的大鼠,适应性喂养1 周开始造模。 称量大鼠体质量,腹腔注射2.5%戊巴比妥钠溶液(剂量为45 mg/kg)进行麻醉,给药剂量为0.3 mL/kg,将大鼠仰卧位固定至鼠板,剪开腹壁,剪取部分子宫内膜组织,用缝合针把内膜缝合于腹壁上,关腹缝合。术后连续3 d 给予青霉素钠腹腔注射预防感染,术后10 d 开始进行戊酸雌二醇(0.2 mg/只)灌胃,连续5 d。 手术后4 周,选择动情期大鼠再次麻醉,开腹观察,异位病灶体积增大,有血管增生或水肿病变,呈小囊状或透明结节状,内含清亮液体,表面有血管形成和结缔组织覆盖,可以认定为造模成功[8]。
1.2.2 分组与给药 取造模成功大鼠40 只,随机编号并染色标记,采用随机数字表法分为模型组、阳性药组、低剂量组、中剂量组、高剂量组,每组8 只。 另取8 只大鼠仅开腹剪开子宫后缝合,设为假手术组。造模成功后,阳性药组:孕三烯酮胶囊灌胃给药,取胶囊内容物与适量的蒸馏水混合研磨溶化,每次按0.5 mg/kg 灌胃,每周2 次;低剂量组、中剂量组、高剂量组:丹白颗粒灌胃给药,给药方法参照说明书中人用剂量进行大鼠实验剂量换算,低剂量组为70 mg/kg,中剂量组为135 mg/kg,高剂量组为200 mg/kg,用蒸馏水配制成指定浓度的丹白颗粒溶液,剂量为0.5 mL/只,每天给药3 次,连续给药2 周;假手术组和模型组给予等体积的蒸馏水,灌胃治疗过程中,观察大鼠生理状态、精神状态等情况;末次给药后每组大鼠均给予2 U 缩宫素,观察大鼠痛经状况,随后常规麻醉颈椎脱臼处死大鼠,剖取异位子宫内膜组织,部分使用组织固定液固定以制备病理切片,剩余组织于低温冰箱(-80 ℃)冻存。
1.2.3 指标测定 (1)标本采集及测量:末次给药24 h 后,吸入乙醚麻醉大鼠后处死,开腹观察各组大鼠异位子宫内膜生长情况,测量在位内膜厚度,采用游标卡尺测量异位组织体积大小并称重,保存备用;腹主动脉取血约5 mL,静置后离心(3 000 r/min,15 min,r=10 cm),收集上清液,低温(-80 ℃)保存备用;解剖取出子宫,剥离假手术组正常子宫内膜组织和其余组异位子宫内膜组织,漂洗后分成两部分,一部分用10%甲醛固定,HE 染色,切片,通过显微镜进行病理组织学检查;剩余部分各剪取约0.5 g冻存在液氮中备用。
(2)血管生成相关指标检测:采用酶联免疫吸附法(enzyme linked immuno sorbent assay, ELISA)检测大鼠血清中VEGF 含量, 取血清置于冰水浴中解冻,采用ELISA 法检测其中VEGF 水平,具体操作参照各自说明书的步骤进行。
(3)大鼠异位子宫内膜组织微血管密度(microvessel density, MVD)检测:找出各组子宫异位内膜组织中微血管最密集的部位进行观察并记录,结果以3 个200 倍视野下血管数目的平均数来表示,在内膜组织中与邻近微血管、腺体组织分界清楚的任何一个染成棕色的细胞或细胞丛均被认为是1 个新生血管[8]。
(4)相关因子水平检测:采用ELISA 法测定异位子宫内膜组织相关因子水平含量,取部分异位子宫内膜组织于离心管中,加入0.9%氯化钠溶液0.9 mL制备组织匀浆液,严格按照ELISA 试剂盒的操作说明测定各组异位子宫内膜组织中FSH、LH 水平。 采用放射免疫法检测E2、P 含量。
(5)氧化应激指标水平检测:取部分异位子宫内膜组织,低温研磨制备组织匀浆,严格按照各试剂盒的说明书测定异位子宫内膜组织中的SOD、MDA、GSH-Px 水平。
1.3 统计学分析
采用EXCEL 与SPSS 20.0 进行数据处理与分析,计量数据用以“±s”表示,进行正态性检验,多组独立、正态、方差齐资料组间比较采用单方差分析,两两比较采用LSD-t 检验;P<0.05 为差异有统计学意义。
2 结果
2.1 子宫内膜组织比较
假手术组无异位组织生长,模型组、阳性药组、低剂量组、中剂量组、高剂量组均有异位组织生长。与模型组相比,阳性药组、低剂量组、中剂量组、高剂量组大鼠的异位组织体积、异位组织重量、在位内膜厚度降低(P<0.05);与阳性药组比较,低剂量组、中剂量组、高剂量组大鼠的异位组织体积、异位组织重量、在位内膜厚度升高(P<0.05)。 详见表1。
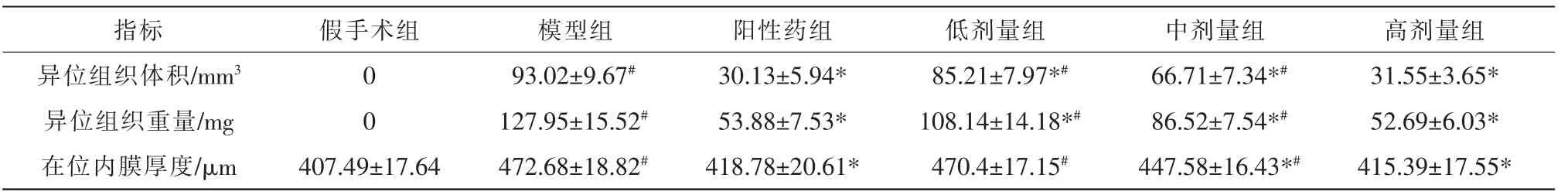
表1 子宫内膜组织检测结果(n=8)
2.2 内膜组织病理观察
假手术组大鼠内膜组织上皮细胞排列整齐,界限清晰,间质细胞排列均匀;模型组大鼠异位病灶较厚,内膜组织上皮细胞呈矮柱状,腺体形态改变明显,细胞间质增多,细胞间隙变小,大量炎症细胞浸润、大量腺体、组织增生;阳性药组与丹白颗粒不同剂量组大鼠异位内膜均受到不同程度的抑制,大鼠异位病灶明显变薄,炎症细胞浸润、组织增生及血液供应不同程度减少。 详见图1。

图1 各组内膜组织病理观察
2.3 血管生成相关指标比较
与假手术组比较,模型组大鼠VEGF、MVD 水平升高(P<0.05);与模型组比较,阳性药组、低剂量组、中剂量组、高剂量组大鼠的VEGF、MVD 水平降低(P<0.05),其中高剂量组与阳性药组大鼠VEGF、MVD 水平趋近于假手术组。 详见表2、图2。

图2 各组内膜组织MVD(×100)

表2 各组异位子宫内膜组织VEGF、MVD 表达水平(n=8)
2.4 相关因子水平比较
与假手术组比较,模型组大鼠FSH、LH、E2 表达水平升高,P 表达水平降低(P<0.05);与模型组比较,阳性药组、低剂量组、中剂量组、高剂量组大鼠FSH、LH、E2 表达水平较低,P 表达水平升高(P<0.05)。与阳性药组比较,模型组与低中剂量组的FSH、LH、E2 表达水平高,同时P 表达水平低(P<0.05),高剂量组的FSH、LH、E2 表达水平与阳性药组接近,P高于阳性药组(P<0.05)。 详见表3。

表3 各组大鼠异位子宫内膜组织相关因子水平检测结果比较(n=8)
2.5 氧化应激指标水平比较
与假手术组比较,模型组大鼠SOD、GSH-Px 表达水平降低,MDA 表达水平升高(P<0.05);与模型组比较,阳性药组、低剂量组、中剂量组、高剂量组大鼠SOD、GSH-Px 表达水平升高,MDA 表达水平降低(P<0.05)。与阳性药组比较,模型组与低剂量组的SOD、GSH-Px 表达水平低,同时MDA 表达水平高(P<0.05),中高剂量组的SOD、MDA 表达水平与阳性药组接近,中剂量组的GSH-Px 低于阳性药组,高剂量组的GSH-Px 高于阳性药组(P<0.05)。 详见表4。
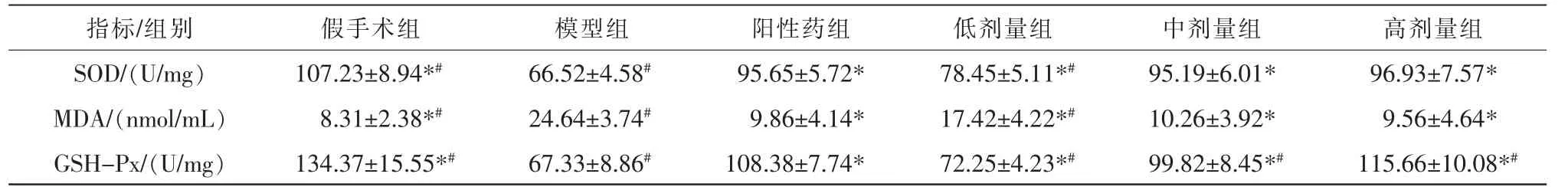
表4 各组大鼠异位子宫内膜组织SOD、MDA、GSH-Px 表达水平比较(n=8)
3 讨论
EMT 是具有生长功能的子宫内膜组织出现在宫腔被覆黏膜以外其他部位的雌激素依赖性疾病,在育龄妇女中发病率约为10%,严重影响女性的生殖健康和生活质量[8]。 子宫内膜受多种内分泌激素调节,激素分泌失衡参与子宫内膜症的发生和发展,异位子宫内膜的异位过程可概括为:黏附→侵袭→血管形成,血管内皮细胞进行侵袭过程中,可以通过释放细胞因子、蛋白水解酶等物质,增加内膜细胞在异位组织上的侵袭能力,促进异位内皮细胞在异位组织的增殖生长[9]。 EMT 患者存在免疫缺陷、侵袭、血管生成等内膜微环境改变,而各种信号通路可通过调控体内酶及细胞因子的表达,进而影响异位内膜的黏附、侵袭、血管生成及凋亡,参与EMT 的发生、发展过程[10-11]。
现代中医认为,“阳虚寒凝,冲任、胞宫气血不畅,瘀血内阻”可导致瘀血阻滞,临床治疗以活血化瘀散结为主,女子易胞宫虚寒,气血不畅,经血瘀滞,以温经散寒、养血和营、化瘀止痛为治法[12-13]。 丹白颗粒由牡丹皮、大血藤、紫花地丁、三棱、莪术、败酱草、白英、白花蛇舌草、川芎、白芍、土茯苓、墓头回、椿皮、当归14 味中药组成,具有清热化瘀、祛湿止痛的功效;本方以中医临床辨证论治为核心,牡丹皮清热凉血、活血散瘀,大血藤败毒消痈、活血通络、祛风杀虫,紫花地丁清热解毒、凉血消肿,三药合用,共奏清热化瘀、祛湿止痛之效,共为君药;三棱苦降辛开,平而不烈,性非猛而建功甚速,配莪术行气破血、消积止痛,且两者均入肝、脾经,可消肝郁之积、理脾虚之滞,败酱草乃手足阳明厥阴药也,善排脓破血,川芎辛温,走而不守,行气开郁,活血止痛,可“上行头目,下行血海”,4 味中药行滞活血、化瘀止痛,为臣药共涤瘀滞以通脉止痛;白英、白花蛇舌草、川芎、白芍、土茯苓、墓头回、椿皮合用以清热解毒利湿、固涩止带,为佐药;当归味甘辛,温而不燥,行而不猛,甘缓调和,能引诸药入冲任,调经血,用之为使;本方君臣佐使俱全,组方合理,用药精当,共奏活血化瘀、祛湿止痛之功。
上述研究中,丹白颗粒可以抑制子宫异位内膜组织的生长,降低异位子宫内膜的体积和重量,并通过抑制VEGF 蛋白的表达,抑制新生血管生成,降低异位子宫内膜组织的MDV;对EMT 大鼠高水平的FSH 和LH 均有抑制作用,降低血清E2 水平,升高P 水平,降低外周血中激素水平,调节内分泌系统的紊乱,高剂量组使其趋于正常水平;调节机体免疫失调和氧化还原失衡,抑制EMT 大鼠血清中MDA 等应激因子的积累,使其趋于正常水平。上述研究从动物实验的角度证实丹白颗粒可以降低大鼠血清氧化应激水平,表明丹白颗粒可能是通过某种炎性通路影响EM 的发展,但仍未阐明其具体的机制,在下一步的研究中,我们拟探明丹白颗粒治疗EMT 的具体信号通路机制,为其在EMT 中的临床应用提供理论支持。 综上所述,不同剂量丹白颗粒对EMT 具有不同程度的改善作用,其机制主要通过调节激素的分泌和抑制过氧化物的积累发挥作用,丹白颗粒具有抗炎和抗氧化作用,通过调节炎症反应和氧化应激反应起到抑制异位内膜黏附、血管生成的作用,从而缓解EMT 病情的发展。

