有机催化靛红衍生酮亚胺与噁唑酮的不对称Mannich型加成反应
黄秋红,李文军,李 鑫,3
(1.南开大学化学学院,天津 300071;2.青岛大学药学院药物化学系,青岛 266021;3.物质绿色创造与制造海河实验室,天津 300192)
手性3,3′-二取代氧化吲哚广泛存在于天然产物和生物活性分子中[1~4],且该类化合物的生物活性与C3位取代基的性质以及立体中心的绝对构型密切相关[5,6]. 因此,开发有效且实用的方法来构建手性3,3′-二取代氧化吲哚化合物具有重要意义[7,8]. 另外,与叔碳手性中心相比,季碳手性中心更富于结构多样性和刚性,因此在天然产物和药物分子中存在更加广泛[9,10]. 发展高效的构建季碳手性中心的方法有助于合成生物活性分子及其类似物,从而促进新药研发[11]. 由于相邻碳的6个非氢取代基存在较大的空间位阻,同时前手性中心取代基的位阻差异性较小,导致高对映选择性地合成该类分子骨架依然面临较大的挑战[12]. 靛红衍生物[13,14]的不对称亲核加成反应是合成含2个连续季碳中心的手性3,3′-二取代氧化吲哚化合物最直接有效的合成方法[15~37],但寻找合适的亲核试剂用于靛红衍生酮亚胺的不对称Mannich型加成仍然面临挑战. 五元环状化合物噁唑酮[38~50]的反应位点多样,且易于转化为重要的α-烷基-α-羟基衍生物[51~55]. 因此,噁唑酮的不对称反应受到广泛关注. 若将噁唑酮作为不对称Mannich型加成反应的亲核试剂,反应不仅能得到含噁唑酮的2个连续季碳中心的手性3,3′-二取代氧化吲哚化合物,还能进一步转化为含α-烷基-α-羟基的手性3,3′-二取代氧化吲哚化合物,从而丰富产物类型. 基于此,本文研究了手性磷酸催化靛红衍生酮亚胺与噁唑酮的不对称Mannich 型加成反应,并能以良好至优秀的收率、优秀的对映选择性以及非对映选择性得到多种3,3′-二取代氧化吲哚化合物. 该反应可以进行扩大化,得到的产物可以进行衍生化反应转化为含α-烷基-α-羟基的手性3,3′-二取代氧化吲哚化合物.
1 实验部分
1.1 试剂与仪器
各种取代的靛红、三苯基膦基亚胺基甲酸叔丁酯、2-溴丙酰氯、2-溴丁酰氯和各种取代的苯甲酰胺,分析纯,上海毕得医药科技股份有限公司;吡啶,分析纯,安徽泽升科技有限公司;碳酸钾、1,4-二氧六环、60-90石油醚(PE)和乙酸乙酯(EA),分析纯,天津渤化工程有限公司;甲基叔丁基醚,分析纯,安徽泽升科技有限公司;反应过程中使用薄层层析色谱(TLC)监测反应;所有用于萃取的有机相均用无水硫酸钠干燥,用旋转蒸发仪浓缩;柱层析分离使用200~300目硅胶,硅胶和薄层层析板均为烟台江友硅胶开发有限公司生产;参照文献[14]方法合成靛红衍生酮亚胺;参照文献[45]方法合成噁唑酮.
Bruker Avance-500 型核磁共振波谱仪(NMR,以CDCl3和DMSO-d6为溶剂),以未氘代的残留试剂作为1H NMR 和13C NMR 的内标(CDCl3:δ7.26 和77.0,DMSO-d6:δ2.50 和39.5),德国Bruker 公司;Daicel Chiralpak IA 型手性色谱柱,日本大赛璐公司;Rudolph Autopolvi 型旋光仪,美国鲁道夫公司;LC-20A 型高效液相色谱仪(HPLC),日本岛津公司;Varian 7.0T FTMS 型傅里叶变换高分辨质谱仪(HRMS),ESI为离子源,美国Varian公司.
1.2 实验过程
将(4R,11bS)-2,6-二[3,5-二(三氟甲基)苯基]-4-羟基二萘[2,1-d:1',2'-f][1,3,2]二氧磷-4-氧化物(4a)、(4R,11bS)-2,6-二(蒽-9-基)-4-羟基二萘[2,1-d:1',2'-f][1,3,2]二氧磷-4-氧化物(4b)、(4R,11bS)-4-羟基-2,6-二(三苯基硅基)二萘[2,1-d:1',2'-f][1,3,2]二氧磷-4-氧化物(4c)、(2s,4R,11bS)-4-羟基-2,6-二(2,4,6-三叔丁基苯基)二萘[2,1-d:1',2'-f][1,3,2]二氧磷4-氧化物(4d)以及(4R,11bS)-4-羟基-2,6-二(菲-9-基)二萘酚[2,1-d:1',2'-f][1,3,2]二氧磷-4-氧化物(4e)等手性磷酸用于靛红衍生酮亚胺与噁唑酮的不对称Mannich型加成反应,考察了不同溶剂、催化剂用量及添加剂等因素对反应立体选择性(e.e.,%)的影响,筛选出最佳催化条件,并应用于不同取代靛红衍生酮亚胺与噁唑酮的反应.
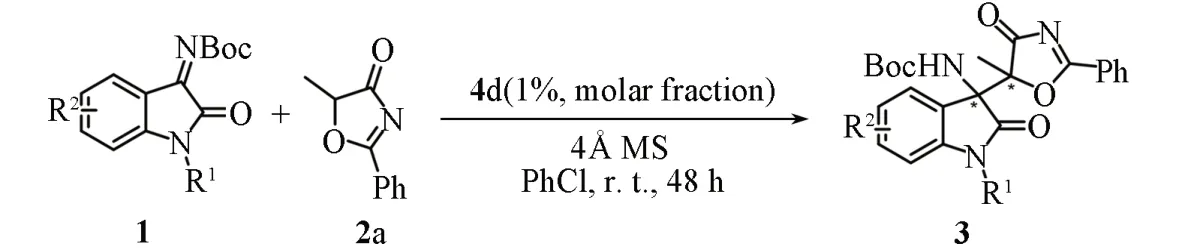
在5 mL反应管中依次加入0.1 mmol靛红衍生酮亚胺(1)、0.12 mmol噁唑酮(2)、1%(摩尔分数)催化剂、20 mg 4Å分子筛(MS)和0.6 mL PhCl,室温下搅拌48 h,用TLC监测反应. 反应完成后,减压浓缩,粗产品经柱色谱[V(石油醚)∶V(乙酸乙酯)=3∶1]分离即得纯净的Mannich 型加成产物[1-苄基-3-(4,5-二氢噁唑-5-基)-2-氧代吲哚-3-基]氨基甲酸叔丁酯(3). 图S1~S51(见本文支持信息)给出所有产物的1H NMR,13C NMR及HPLC谱图.
[1-苄基-3-(5-甲基-4-氧代-2-苯基-4,5-二氢噁唑-5-基)-2-氧代吲哚-3-基]氨基甲酸叔丁酯(3aa),白色固体,产率91%.1H NMR(DMSO-d6,500 MHz),δ:7.65~7.62(m,1H),7.55~7.53(m,2H),7.47~7.46(m,2H),7.42~7.33(m,5H),7.07~7.05(m,1H),6.97~6.95(m,1H),6.86~6.83(m,2H),5.14(d,J=15.0 Hz,1H),4.65(s,1H),1.92(s,3H),1.21(s,9H);13C NMR(DMSO-d6,125 MHz),δ:190.8,185.3,172.9,153.8,143.9,136.9,136.1,130.0,129.8,129.5,129.1,128.6,128.1,125.9,124.7,122.9,122.5,109.1,86.3,80.2,63.1,43.8,28.2,16.1;C30H30N3O5,ESI-HRMS 实验 值(计 算 值),m/z:512.2180(2.2175)[M+];=-31.0(c=1.0 g/100 mL,CHCl3);HPLC[Chiralpak IA,V(Hexane)∶V(EtOH)=80∶20,1.0 mL/min,254 nm],tR=10.7 min(minor),12.2 min(major);96%e.e.
[1-苄基-5-氟-3-(5-甲基-4-氧代-2-苯基-4,5-二氢噁唑-5-基)-2-氧代吲哚-3-基]氨基甲酸叔丁酯(3ba),白色固体,产率87%.1H NMR(DMSO-d6,500 MHz),δ:7.69~7.66(m,1H),7.56~7.50(m,4H),7.41~7.35(m,5H),6.96~6.94(m,1H),6.86~6.82(m,2H),5.09(d,J=15.0 Hz,1H),4.66(s,1H),1.91(s,3H),1.21(s,9H);13C NMR(DMSO-d6,125 MHz),δ:190.2,185.3,172.9,158.3(d,J=238.8 Hz),140.2,136.6,136.2,129.9,129.6,129.1,128.5,128.1,124.7,116.3,116.1,111.1(d,J=24.8 Hz),110.1(d,J=7.7 Hz),86.4,80.4,63.5,43.9,28.2,16.3;19F NMR(DMSOd6,376 MHz),δ:-119.4;C30H29FN3O5,ESI-HRMS 实验值(计算值),m/z:530.2080(530.2086)[M+];=-27.0(c=1.0 g/100 mL,CHCl3);HPLC[Chiralpak IA,V(Hexane)∶V(EtOH)=80∶20,1.0 mL/min,254 nm],tR=11.2 min(minor),12.1 min(major);92%e.e.
[1-苄基-5-氯-3-(5-甲基-4-氧代-2-苯基-4,5-二氢噁唑-5-基)-2-氧代吲哚-3-基]氨基甲酸叔丁酯(3ca),白色固体,产率97%.1H NMR(DMSO-d6,500 MHz),δ:7.71~7.68(m,2H),7.58~7.57(m,2H),7.52~7.51(m,2H),7.43~7.37(m,5H),7.20~7.18(m,1H),6.99(s,1H),6.9~6.90(m,1H),5.10(d,J=15.0 Hz,1H),4.70(s,1H),1.93(s,3H),1.23(s,9H);13C NMR(DMSO-d6,125 MHz),δ:189.8,185.1,172.5,142.6,136.2,135.9,134.0,129.6,129.5,129.3,128.8,128.2,127.8,127.3,126.3,124.4,122.8,110.4,86.1,80.1,63.0,43.59,27.9,15.9;C30H29ClN3O5,ESI-HRMS实验值(计算值),m/z:546.1780(546.1790)[M+];=-33.0(c=1.0 g/100 mL,CHCl3);HPLC[Chiralpak IA,V(Hexane)∶V(EtOH)=80∶20,1.0 mL/min,254 nm],tR=10.9 min(minor),13.3 min(major);96%e.e.
[1-苄基-5-溴-3-(5-甲基-4-氧代-2-苯基-4,5-二氢噁唑-5-基)-2-氧代吲哚-3-基]氨基甲酸叔丁酯(3da),白色固体,产率84%.1H NMR(DMSO-d6,500 MHz),δ:7.70~7.67(m,1H),7.56~7.55(m,2H),7.50~7.48(m,2H),7.42~7.30(m,6H),7.08~7.07(m,1H),6.84~6.83(m,1H),5.07(d,J=15.0 Hz,1H),4.68(s,1H),1.90(s,3H),1.21(s,9H);13C NMR(DMSO-d6,125 MHz),δ:189.4,185.0,171.9,147.9,146.0,137.4,136.4,130.4,130.2,130.2,129.9,128.5,127.4,127.3,125.1,123.7,119.6,118.4,118.2,88.2,80.2,64.1,55.4,45.9,28.4,16.2;C30H29BrN3O5,ESI-HRMS 实验值(计算值),m/z:590.1285(590.1285)[M+];[α]25D=-17.0(c=1.0 g/100 mL,CHCl3);HPLC[Chiralpak IA,V(Hexane)∶V(EtOH)=80∶20,1.0 mL/min,254 nm],tR=11.0 min(minor),14.1 min(major);88%e.e.
[1-苄基-5-甲基-3-(5-甲基-4-氧代-2-苯基-4,5-二氢噁唑-5-基)-2-氧代吲哚-3-基]氨基甲酸叔丁酯(3ea),白色固体,产率96%.1H NMR(DMSO-d6,500 MHz),δ:7.66~7.63(m,1H),7.50~7.49(m,4H),7.39~7.34(m,5H),6.86~6.85(m,1H),6.77(s,1H),6.71~6.70(m,1H),5.09(d,J=15.0 Hz,1H),4.60(s,1H),2.08(s,3H),1.89(s,3H),1.20(s,9H);13C NMR(DMSO-d6,125 MHz),δ:190.7,185.2,172.6,153.7,141.5,136.8,136.0,131.3,130.0,129.7,129.4,128.9,128.4,127.9,124.7,123.5,108.7,86.3,80.1,63.1,43.9,20.9,16.2;C31H31N3O5,ESI-HRMS 实验值(计算值),m/z:526.2329(526.2337)[M+];=-34.0(c=1.0 g/100 mL,CHCl3);HPLC[Chiralpak IA,V(Hexane)∶V(EtOH)=80∶20,1.0 mL/min,254 nm],tR=9.8 min(minor),15.6 min(major);94%e.e.
[1-苄基-6-氯-3-(5-甲基-4-氧代-2-苯基-4,5-二氢噁唑-5-基)-2-氧代吲哚-3-基]氨基甲酸叔丁酯(3fa),白色固体,产率94%.1H NMR(DMSO-d6,500 MHz),δ:7.72~7.69(m,1H),7.54~7.53(m,4H),7.44~7.38(m,5H),7.01(d,J=7.8 Hz,1H),6.95(d,J=7.6 Hz,2H),5.10(d,J=15.0 Hz,1H),4.74(s,1H),1.91(s,3H),1.23(s,9H);13C NMR(DMSO-d6,125 MHz),δ:195.0,190.1,177.8,150.2,141.3,140.1,139.1,134.6,134.3,133.9,133.3,132.9,132.4,129.4,129.3,127.0,114.2,91.1,85.1,67.7,48.5,33.0,21.0;C30H29ClN3O5,ESI-HRMS 实验值(计算值),m/z:546.1782(546.1790)[M+];=-35.0(c=1.0 g/100 mL,CHCl3);HPLC[Chiralpak IA,V(Hexane)∶V(EtOH)=80∶20,1.0 mL/min,254 nm],tR=10.1 min(minor),12.3 min(major);92%e.e.
[1-苄基-6-溴-3-(5-甲基-4-氧代-2-苯基-4,5-二氢噁唑-5-基)-2-氧代吲哚-3-基]氨基甲酸叔丁酯(3ga),白色固体,产率82%.1H NMR(DMSO-d6,500 MHz),δ:7.59~7.56(m,2H),7.4~7.44(m,2H),7.38~7.37(m,2H),7.31~7.18(m,6H),6.97(s,1H),6.72~6.71(m,1H),4.96(d,J=15.0 Hz,1H),4.56(s,1H),1.78(s,3H),1.10(s,9H);13C NMR(DMSO-d6,125 MHz),δ:195.6,174.6,170.9,168.0,155.6,142.1,136.3,134.3,131.1,130.3,129.2,129.2,128.9,128.5,127.7,127.6,126.8,123.8,110.8,80.2,79.3,53.5,43.3,28.6,26.1;C30H27BrN3O5,ESI-HRMS 实验值(计算值),m/z:590.1143(590.1140)[M+];=-47.0(c=1.0 g/100 mL,CHCl3);HPLC[Chiralpak IA,V(Hexane)∶V(EtOH)=80∶20,1.0 mL/min,254 nm],tR=10.9 min(minor),13.3 min(major);94%e.e.
[1-苄基-7-氟-3-(5-甲基-4-氧代-2-苯基-4,5-二氢噁唑-5-基)-2-氧代吲哚-3-基]氨基甲酸叔丁酯(3ha),白色固体,产率85%.1H NMR(DMSO-d6,500 MHz),δ:8.46(s,1H),8.21~8.19(m,2H),7.87~7.84(m,1H),7.69~7.66(m,2H),7.46~7.45(m,2H),7.27~7.21(m,4H),7.05~7.02(m,1H),6.89~6.88(m,1H),6.74~6.73(m,1H),5.05(s,1H),4.87(s,1H),1.84(s,3H),1.31(s,9H);13C NMR(DMSO-d6,125 MHz),δ:189.4,185.0,171.9,146.9(d,J=243.0 Hz),137.4,136.4,130.4,130.2(d,J=9.4 Hz),130.0,128.5,127.4,127.3,125.1,123.7(d,J=6.2 Hz),119.6,118.3(d,J=19.2 Hz),88.2,80.2,64.1,55.4,45.9,28.4,16.2;19F NMR(DMSO-d6,376 MHz),δ:-133.2;C30H29FN3O5,ESI-HRMS 实验值(计算值),m/z:530.2080(530.2086)[M+];=-44.0(c=1.0 g/100 mL,CHCl3);HPLC[Chiralpak IA,V(Hexane)∶V(EtOH)=80∶20,1.0 mL/min,254 nm],tR=9.5 min(minor),12.2min(major);95%e.e.
[1-苄基-7-氯-3-(5-甲基-4-氧代-2-苯基-4,5-二氢噁唑-5-基)-2-氧代吲哚-3-基]氨基甲酸叔丁酯(3ia),白色固体,产率94%.1H NMR(DMSO-d6,500 MHz),δ:8.51(s,1H),8.20~8.19(m,2H),7.86~7.83(m,1H),7.69~7.66(m,2H),7.44~7.43(m,2H),7.25~7.14(m,4H),7.01~7.00(m,1H),6.73~6.72(m,1H),5.21(d,J=20.0 Hz,1H),5.11(d,J=15.0 Hz,1H),1.81(s,3H),1.31(s,9H);13C NMR(DMSO-d6,125 MHz),δ:189.4,185.1,172.9,154.7,139.7,138.4,136.6,132.5,130.5,130.2,130.0,128.6,127.2,126.9,125.2,124.0,122.4,114.8,88.3,80.4,63.6,60.3,45.9,28.5,16.3;C30H29ClN3O5,ESI-HRMS 实验值(计算值),m/z:546.1784(546.1790)[M+];=-44.0(c=1.0 g/100 mL,CHCl3);HPLC[Chiralpak IA,V(Hexane)∶V(EtOH)=80∶20,1.0 mL/min,254 nm],tR=9.9 min(minor),14.3 min(major);94%e.e.
[1-甲基-3-(-5-甲基-4-氧代-2-苯基-4,5-二氢噁唑-5-基)-2-氧代吲哚啉-3-基]氨基甲酸叔丁酯(3ja),白色固体,产率84%.1H NMR(DMSO-d6,500 MHz),δ:7.97~7.96(m,2H),7.82~7.75(m,2H),7.63~7.57(m,4H),7.49~7.46(m,1H),7.36~7.34(m,2H),7.18~7.14(m,2H),7.04~7.02(m,1H),6.62~6.61(m,1H),1.91(s,3H),1.23(s,9H);13C NMR(DMSO-d6,125 MHz),δ:189.6,185.0,170.9,167.4,154.6,143.9,136.4,134.7,132.0,130.4,130.3,130.0,129.9,129.1,128.5,127.0,125.2,123.6,123.0,109.5,88.6,80.0,65.5,63.8,28.4,16.1;C29H28N3O5,ESI-HRMS 实验值(计算值),m/z:498.2015(498.2024)[M+];=-40.0(c=1.0 g/100 mL,CHCl3);HPLC[Chiralpak IA,V(Hexane)∶V(EtOH)=80∶20,1.0 mL/min,254 nm],tR=7.6 min(minor),11.5 min(major);92%e.e.
{1-苄基-3-[2-(4-氟苯基)-5-甲基-4-氧代-4,5-二氢噁唑-5-基]-2-氧代吲哚啉-3-基}氨基甲酸叔丁酯(3ab),白色固体,产率91%.1H NMR(DMSO-d6,500 MHz),δ:7.53~7.47(m,4H),7.41~7.33(m,3H),7.25~7.23(m,2H),7.09~7.07(m,1H),6.99~6.98(m,1H),6.88~6.85(m,2H),5.13(d,J=15.0 Hz,1H),4.68(s,1H),2.24(s,3H),1.92(s,3H),1.23(s,9H);13C NMR(DMSO-d6,125 MHz),δ:189.3,183.8,167.1(d,J=255.8 Hz),143.7,136.4,133.5(d,J=10.0 Hz),130.1,128.7,128.0,127.6,126.8,123.3(d,J=5.6 Hz),122.5,121.9,117.3(d,J=22.4 Hz),109.8,91.3,88.6,79.9,63.9,44.2,28.4,16.4;19F NMR(DMSO-d6,376 MHz),δ:-106.7;C30H29FN3O5,ESI-HRMS 实验值(计算值),m/z:530.2080(530.2086)[M+];=-35.0(c=1.0 g/100 mL,CHCl3);HPLC[Chiralpak IA,V(Hexane)∶V(EtOH)=80∶20,1.0 mL/min,254 nm],tR=9.7 min(minor),11.9 min(major);92%e.e.
{1-苄基-3-[2-(4-溴苯基)-5-甲基-4-氧代-4,5-二氢噁唑-5-基]-2-氧代吲哚啉-3-基}氨基甲酸叔丁酯(3ac),白色固体,产率87%.1H NMR(CDCl3,500 MHz),δ:7.58~7.56(m,2H),7.53~7.51(m,2H),7.42~7.37(m,5H),7.09~7.06(m,1H),6.97~6.96(m,1H),6.87~6.84(m,2H),5.11(d,J=15.0 Hz,1H),4.65(s,1H),1.91(s,3H),1.21(s,3H);13C NMR(CDCl3,125 MHz),δ:190.1,185.4,172.8,142.9,136.5,136.2,134.3,129.9,129.8,129.6,129.1,128.5,128.1,127.6,126.6,124.7,123.1,110.7,86.4,80.4,63.3,28.2,16.2;C30H29BrN3O5,ESI-HRMS实验值(计算值),m/z:590.1283(590.1285)[M+];=-30.0(c=1.0 g/100 mL,CHCl3);HPLC[Chiralpak IA,V(Hexane)∶V(EtOH)=80∶20,1.0 mL/min,254 nm],tR=11.3 min(minor),15.7 min(major);99%e.e.
{1-苄基-3-[2-(4-甲基苯基)-5-甲基-4-氧代-4,5-二氢噁唑-5-基]-2-氧代吲哚啉-3-基}氨基甲酸叔丁酯(3ad),白色固体,产率82%.1H NMR(DMSO-d6,500 MHz),δ:7.56~7.55(m,2H),7.44~7.36(m,5H),7.17~7.15(m,2H),7.07~7.06(m,1H),6.96~6.95(m,1H),6.86~6.83(m,2H),5.17(d,J=15.0 Hz,1H),4.66(s,1H),2.32(s,3H),1.91(s,3H),1.22(s,9H);13C NMR(DMSO-d6,125 MHz),δ:191.0,185.3,172.8,153.8,147.3,143.9,136.9,130.1,130.0,129.9,129.1,128.5,128.1,122.9,122.5,121.8,109.0,86.1,80.3,63.1,43.8,28.2,21.9,16.2;C31H32N3O5,ESI-HRMS 实验值(计算值),m/z:526.2330(526.2337)[M+];=-41.0(c=1.0 g/100 mL,CHCl3);HPLC[Chiralpak IA,V(Hexane)∶V(EtOH)=80∶20,1.0 mL/min,254 nm],tR=11.7 min(minor),19.4 min (major);94%e.e.
{1-苄基-3-[2-(3-甲基苯基)-5-甲基-4-氧代-4,5-二氢噁唑-5-基]-2-氧代吲哚啉-3-基}氨基甲酸叔丁酯(3ae),白色固体,产率89%.1H NMR(DMSO-d6,500 MHz),δ:7.53~7.47(m,4H),7.41~7.33(m,3H),7.25~7.23(m,2H),7.09~7.07(m,1H),6.99~6.98(m,1H),6.88~6.85(m,2H),5.13(d,J=15.0 Hz,1H),4.68(s,1H),2.24(s,3H),1.92(s,3H),1.23(s,9H);13C NMR(DMSO-d6,125 MHz),δ:190.8,185.6,173.0,153.8,144.0,139.2,136.9,136.9,130.3,130.1,129.4,129.1,128.3,128.1,126.9,124.8,123.0,122.6,109.1,86.3,80.3,63.2,43.9,21.1,16.4;C31H32N3O5,ESI-HRMS 实验值(计算值),m/z:526.2330(526.2337)[M+];=-44.0(c=1.0 g/100 mL,CHCl3);HPLC(Chiralpak IA,V(Hexane)∶V(EtOH)=80∶20,1.0 mL/min,254 nm),tR=10.7 min(minor),12.6 min(major);94%e.e..
{1-苄基-3-[2-(2-氯苯基)-5-甲基-4-氧代-4,5-二氢噁唑-5-基]-2-氧代吲哚啉-3-基}氨基甲酸叔丁酯(3af),白色固体,产率83%.1H NMR(DMSO-d6,500 MHz),δ:7.69~7.66(m,2H),7.55~7.53(m,2H),7.48~7.46(m,2H),7.41~7.28(m,6H),7.06(s,1H),6.82~6.81(m,1H),5.06(d,J=15.0 Hz,1H),4.66(s,1H),1.88(s,3H),1.20(s,9H);13C NMR(DMSO-d6,125 MHz),δ:191.0,185.3,172.9,153.8,147.4,143.9,137.0,130.1,130.0,130.0,129.1,128.6,128.1,122.9,122.5,121.9,109.1,86.1,80.3,63.1,43.8,28.2,21.9,16.2;C30H29N3ClO5,ESI-HRMS实验值(计算值),m/z:546.1784(546.1790)[M+];= - 35.0(c=1.0 g/100 mL,CHCl3);HPLC[Chiralpak IA,V(Hexane)∶V(EtOH)=80∶20,1.0 mL/min,254 nm],tR=12.5 min(minor),14.9 min(major);96%e.e.
[1-苄基-3-(5-乙基-4-氧代-2-苯基-4,5-二氢噁唑-5-基)-2-氧代吲哚啉-3-基]氨基甲酸叔丁酯(3ag),白色固体,产率78%.1H NMR(DMSO-d6,500 MHz),δ:8.76~8.75(m,1H),8.13~8.11(m,1H),8.05~8.02(m,1H),7.75~7.73(m,1H),7.47~7.46(m,2H),7.36~7.27(m,4H),7.13~7.12(m,1H),7.03~7.02(m,1H),6.90~6.89(m,1H),6.77~6.76(m,1H),4.92(s,2H),2.69~2.65(m,1H),1.22(s,9H),0.71(t,J=5.0 Hz ,3H);13C NMR(DMSO-d6,125 MHz),δ:190.4,184.5,172.9,153.8,143.8,136.9,132.7,131.5,130.5,130.0,129.1,128.6,128.1,125.9,123.9,123.0,122.5,109.1,86.7,80.2,63.2,43.8,40.5,40.3,40.1,40.0,39.8,39.6,39.5,28.2,26.8,16.1;C31H31N3NaO5,ESI-HRMS 实验值(计算值),m/z:548.5944(548.5948)[M+Na];=-35.0(c=1.0 g/100 mL,CHCl3);HPLC[Chiralpak IA,V(Hexane)∶V(EtOH)=80∶20,1.0 mL/min,254 nm],tR=11.8 min(minor),15.2 min(major);90%e.e.
{1-苄基-3-[1-(4-氯苯甲酰胺基)-2-羟基-1-氧代丙烷-2-基]-2-氧代吲哚啉-3-基}氨基甲酸叔丁酯(5),白色固体,产率65%.1H NMR(CDCl3,500 MHz),δ:7.52~7.36(m,4H),7.19(t,J=7.5 Hz,2H),7.04(d,J=7.2 Hz,1H),6.95(s,1H),6.75(t,J=7.3 Hz,1H),6.63(d,J=7.0 Hz,1H),6.47(s,1H),5.46(d,J=12.9 Hz,1H),4.53(s,1H),1.97(s,3H),1.30(s,9H);13C NMR(126 MHz,Chloroform-d),δ:192.4,186.1,172.0,153.6,143.3,136.3,135.5,135.2,129.9,129.8,128.8,128.7,128.2,127.8,124.2,122.7,122.5,108.4,85.7,80.9,78.1,44.3,28.1,16.3;C30H31ClN3O6,ESI-HRMS 实验值(计算值),m/z:564.0353(564.0350)[M+];=-38.0(c=1.0 g/100 mL,CHCl3);HPLC[Chiralpak IA,V(Hexane)∶V(EtOH)=80∶20,1.0 mL/min,254 nm],tR=8.8 min (minor),9.5 min(major);96%e.e.
2 结果与讨论
2.1 反应条件的优化
选取靛红衍生酮亚胺(1a)与噁唑酮(2a)的反应作为模型,在二氯甲烷中进行催化剂的筛选. 由表1可见,在手性磷酸4a的催化作用下,无反应产物生成(表1中Entry 1). 当使用手性磷酸4b为催化剂时,反应能以17%的收率得到相应产物,但反应的对映选择性为0(表1中Entry 2). 其它类别的手性磷酸催化剂4c~4e也能催化该反应(表1中Entries 3~5),其中催化剂4d表现出最优的产率、对映选择性和非对映选择性(表1中Entry 4). 随后,将筛选出的最佳催化剂4d用于靛红衍生酮亚胺与噁唑酮的不对称Mannich型加成反应中,考察了反应溶剂、催化剂用量以及添加物对反应的影响(表1中Entries 6~12). 由表1 可见,溶剂对于产物的对映选择性影响较小,而对于产物的收率影响较大(表1 中Entries 6~12). 与氯代溶剂(如四氯化碳和1,2-二氯乙烷)相比,反应在苯类溶剂(如甲苯、二甲苯和氯苯)中的收率明显提高. 其中,以氯苯为溶剂时,反应的收率高达92%,且对映选择性也相对较高(表1中Entry 12). 因此,确定氯苯为反应的最优溶剂. 考虑到反应的成本,将催化剂用量降至1%(摩尔分数)并延长反应时间至48 h,该反应仍能以86%的收率和92%的对映选择性得到产物3aa(表1中Entry 12). 此外,添加4Å分子筛能有效提高产物的收率和对映选择性(表1中Entry 13). 综上,确定了最优反应条件:1%(摩尔分数)手性磷酸4d为催化剂,氯苯为溶剂,4Å分子筛为添加物,在室温条件下反应48 h.

Table 1 Screening of reaction conditions for the asymmetric Mannich-type reaction
2.2 靛红衍生酮亚胺的底物拓展

Table 2 Scope of the enantioselective Mannich-type reaction of ketimines
将最优催化条件应用于不同取代的靛红衍生酮亚胺(1)与噁唑酮(2a)的不对称Mannich 型加成反应中,考察了催化剂体系的普适性. 由表2可见,5号位无论是吸电子还是给电子取代的靛红衍生酮亚胺均能较好地适应反应条件,并能以良好至优异的收率(84%~96%)、对映选择性(88%~96%e.e.)以及优异的非对映选择性(均>20∶1d.r.)得到相应产物3aa~3ea. 此外,6号位和7号位吸电子取代的靛红衍生酮亚胺也能与噁唑酮反应,并以良好至优异的收率(82%~94%)、优异的对映选择性(92%~95%e.e.)以及非对映选择性(均>20∶1d.r.)得到相应产物3fa~3ia. 若将靛红衍生酮亚胺中的N-苄基换成N-苯基,反应也能较好地进行,并能以84%的收率、92%的对映选择性以及>20∶1 的非对映选择性得到产物3ja.

a. Conditions:compound 1a(0.1 mmol),compound 2a(0.12 mmol),catalyst(0.005 mmol)in PhCl(0.6 mL)at room temperature;b. isolated yield;c. determined by HPLC analysis;d. determined by NMR analysis;e. 1%(molar fraction)catalyst 4d was used;f. 4Å MS(20.0 mg)was used as additives.
a. Conditions:compound 1(0.1 mmol),compound 2a(0.12 mmol),catalyst 4d(0.001 mmol)and 4Å MS(20.0 mg)in PhCl(0.6 mL)were stirred at room temperature for 48 h;b. isolated yield;c. determined by HPLC analysis;d. diastereoselectivity determined by 1H NMR.

a. Conditions:compound 1a(0.1 mmol),compound 2(0.12 mmol),catalyst 4d(0.001 mmol)and 4Å MS(20.0 mg)in PhCl(0.6 mL)were stirred at room temperature for 48 h;b. isolated yield;c. determined by HPLC analysis;d. diastereoselectivity determined by 1H NMR;e. 2%(molar fraction)catalyst 4d was used.
2.3 噁唑酮的底物拓展
将最优催化条件应用于靛红衍生酮亚胺(1a)与不同取代的噁唑酮(2)的不对称Mannich 型加成反应中,考察了催化剂体系的普适性. 由表3可见,无论是邻位、间位还是对位苯基取代的噁唑酮均能较好地反应,并以良好至优异的收率(82%~91%)、优异的对映选择性(92%~99%e.e.)以及非对映选择性(均>20∶1d.r.)得到相应产物3ab~3af. 其中,噁唑酮芳基取代基的电性对反应结果的影响较小. 若将噁唑酮的甲基换成乙基,尽管反应速率降低但不影响反应的立体选择性. 将催化剂摩尔分数由1%增加至2%,反应才能以78%的收率、90%的对映选择性以及>20∶1的非对映选择性得到产物3ag.

Table 3 Scope of the enantioselective Mannich-type reaction of ketimines
2.4 扩大化和衍生化反应
图1 所示扩大化反应和衍生化反应结果进一步证明了反应的应用潜力. 在最优反应条件下,1.5 mmol的靛红衍生酮亚胺(1a)与1.8 mmol的噁唑酮(2a)可以发生不对称Mannich型加成反应,且未影响反应的收率和对映选择性[图1(A)]. 在对甲苯磺酸条件下,化合物3ac 会发生开环转化为相应的含α-烷基-α-羟基的手性3,3′-二取代氧化吲哚化合物,且产物的对映选择性保持[图1(B)].

Fig.1 Large⁃scale reaction and synthetic transformation
3 结论
研究了手性磷酸催化的靛红衍生酮亚胺与噁唑酮的不对称Mannich型加成反应,以良好至优秀的收率(高达97%)、对映选择性(高达99%e.e.)以及优秀的非对映选择性(均>20∶1d.r.)得到一系列含噁唑酮骨架的手性3,3′-二取代氧化吲哚化合物. 其中,3,3′-二取代氧化吲哚衍生物可用于合成众多抗肿瘤药物、抗生素以及抗真菌药物等,因此,新的手性3,3′-二取代氧化吲哚衍生物的发现与合成为该类重要化合的生理学研究提供了很好的基础,是新的药物分子发现的新契机. 显然,开发新的方法合成手性3,3′-二取代氧化吲哚化合物仍然具有重要意义.
支持信息见http://www.cjcu.jlu.edu.cn/CN/10.7503/20220131.

