基于银离子与DNA相互作用的比率型电化学传感器用于银离子的检测
李玉龙,谢发婷,管 燕,刘嘉丽,张贵群,姚 超,杨 通,杨云慧,胡 蓉
(云南师范大学化学化工学院,昆明 650500)
银被广泛应用于电子、摄影和制药等领域. 银离子(Ag+)能够杀菌消毒,其与细菌、真菌和病毒接触后会因自身具有的超氧化能力而表现出很强的抗菌活性[1]. 因此,Ag+应用于饮用水和生活洗漱用品的消毒,也可作为一种预防妇科疾病的添加剂和手术抗菌材料中的无菌添加剂[2]. 目前,随工业废物和排放物排放到环境中的银离子越来越多,有些甚至渗透到地表水中,污染人类所需的淡水资源[3].银离子浓度过高时,会与人体内的蛋白质发生相互作用从而影响健康,导致发生各种疾病的概率升高,如精氨酸缺乏症等[4,5]. 因此,开发快速、高灵敏的银离子检测技术具有重要意义.
电化学分析方法具有快速、仪器成本低、操作简单和检出限低等优点,近年来引起了广泛关注[6,7]. 研究表明,Ag+可与双螺旋结构的DNA的胞嘧啶碱基(C)形成一种C-Ag-C结构[8~10],为利用DNA技术检测Ag+提供了新的理论基础. 在目前的Ag+的检测方法中,大多数利用单一的电化学信号对Ag+进行定量检测,测定结果易受环境、仪器和电极等因素的影响,导致结果的重现性较差. 比率型电化学传感器引入内置校准信号降低背景信号干扰,以2个信号比值作为定量检测指标,从而提高了检测的重现性和稳定性[11,12]. Gu 等[13]设计了一种用于脑中氯离子(Cl-)活体测量的比率电化学微传感器.
Xu等[14]报道了一种背景信号最小化的hDNA高灵敏电化学比率生物传感器. 同时引入了DNA四面体纳米材料(DNA NTH)消除电极表面的非特异性吸附,因其分子修饰位点丰富可以增加探针的捕获量,提高检测的灵敏度[15,16].
金属有机骨架(MOFs)是一类由无机金属中心(金属离子或金属簇)与桥连的有机配体通过自组装形成的具有周期性网络结构的晶态多孔材料,由于比表面积高、金属开放位点丰富和多种多样的骨架结构而被应用于药物载体、生物传感和催化等多个领域[17~21]. 含官能团的MOFs性能良好,合成后易于修饰. 本文使用的含氨基的Cr-MIL-101 NH2金属有机骨架材料本身可直接作为电化学活性信号物质,且检测过程中不需要酸处理和预处理过程. Cr-MIL-101 NH2可以嵌入大量的贵金属纳米颗粒,嵌入了贵金属的MOFs 材料的稳定性显著提高[22]. 识别元件(如蛋白质、核酸等)可以通过Au—S 键结合到MOFs上,可用于电化学DNA传感器的构建.
二元过渡金属氧化物钴酸锌(ZnCo2O4)具有尖晶石结构,其中锌原子占据四面体位置,而钴原子占据八面体位置[23]. 由于其固有的结构,使得ZnCo2O4具有优异的电荷导电性、电子输运性能和循环稳定性;此外,其价格低廉、自然资源丰富、对环境友好,因此在电化学领域得到了广泛关注[24,25]. 电极材料的电化学性能取决于制备工艺、颗粒的大小、形状和形貌. 本文应用了这种具有优异的电化学性能的圆片状的ZnCo2O4[26],用作基底材料修饰电极.
本文设计了一种基于Ag+和胞嘧啶碱基相互作用的比率电化学传感器,用于Ag+的定量检测. 将Cr-MIL-101 NH2材料标记的单链DNA作为信号探针(Cr-MOFs-SP),电解质溶液二茂铁甲酸作为内部参考探针(Fc-RP). 具体构建过程如下:利用导电性高的Au NPs@ZnCo2O4作为基底材料,然后组装巯基修饰的DNA 四面体. DNA 四面体末端修饰有大量的C 碱基. 当体系中存在Ag+时,Cr-MIL-101 NH2材料标记的DNA 链(T2)与靶物Ag+结合. 随着Ag+浓度增大,检测到的Cr-MIL-101 NH2的信号越来越强,而电解质中二茂铁甲酸的信号基本保持不变,因此构建了比率型电化学传感器,实现对Ag+的定量分析. 本文构建的比率型生物传感器具有较强的抗干扰性,能够消除环境、仪器和电极等因素的影响,并且其灵敏度高,检出限可低至33 pmol/L,可用于实际样品的检测.
1 实验部分
1.1 试剂与仪器
氢氧化钠(NaOH)和氯化银(AgCl)均为分析纯,购自阿拉丁试剂有限公司;一水合檬酸三钠(C6H5Na3O7·H2O)为分析纯,购自盛奥化学试剂有限公司;醋酸钴(C4H6CoO4)为分析纯,购自天津市致远化学试剂有限公司;四水合氯化亚铁(FeCl2·4H2O)和尿素(CH4N2O)均为分析纯,购自西陇化工有限公司;六水合硝酸铬(Cr(NO3)2·6H2O)为分析纯,购自罗恩试剂;乙二醇(C2H6O2)、无水乙醇(CH3CH2OH)和醋酸锌(C4H6O4Zn)均为分析纯,购自广东光华科技股份有限公司;N-羟基丁二酰亚胺(NHS)和1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)均为分析纯,购自美国Sigma公司;2-氨基对苯二甲酸(C8H7NO4)、二茂铁甲酸(C11H10FeO2)和N,N-二甲基甲酰胺(DMF)均为分析纯,购于天津市风船化学试剂有限公司;四氯金酸水合物(HAuCl4·XH2O)为分析纯,购于北京百灵威科技有限公司;聚乙烯吡咯烷酮K30(PVP-K30)为分析纯,购于青岛宝泽化工有限公司. DNA引物购于上海生物工程股份有限公司,序列列于表S1(详见本文支持信息)所示.
TGL16 型高速冷冻离心机(长沙湘智离心机仪器有限公司);TTRⅢ型X 射线衍射仪(日本科学公司);JEM2100 型透射电子显微镜(日本电子株式会社);CHI650E 型电化学工作站(上海辰华仪器公司);K-Alpha+型X射线光电子能谱仪(赛默飞世尔科技).
1.2 实验过程
1.2.1 DNA NTH的制备 将用于构成DNA四面体的四条链Tetra-A,Tetra-B,Tetra-C和Tetra-D链分别溶于一定量的缓冲溶液(20 mmol/L Tris+50 mmol/L MgCl2,pH=8.0)中;然后将4 条DNA 链等量均匀混合,在95 ℃下加热5 min,于4 ℃放置30 min;最后将合成的DNA NTH 与缓冲液以1∶1的体积比混合,混合后浓度为2.5 μmol/L[27].
1.2.2 金纳米颗粒(Au NPs)的制备 参照文献[28]方法制备Au NPs. 将50 mL去离子水与500 μL质量分数为1%的HAuCl4置于圆底烧瓶中;加热搅拌回流,沸腾后快速加入1.75 mL质量分数为1%的柠檬酸三钠溶液;恒温加热一段时间后,溶液颜色变为酒红色;冷却至室温后得到金纳米颗粒溶胶,将其置于4 ℃冰箱中密闭保存.
1.2.3 Cr-MIL-101 NH2的合成 参考文献[29]方法合成Cr-MIL-101 NH2. 将800 mg 六水合硝酸铬、360 mg 2-氨基对苯二甲酸、200 mg氢氧化钠和15 mL去离子水置于反应釜中;超声30 min后,于150 ℃反应12 h,冷却后离心,用N,N-二甲基甲酰胺洗涤. 将沉淀转移到圆底烧瓶中,用40 mL 100 ℃乙醇热溶剂洗涤沉淀24 h,最后将沉淀于80 ℃下干燥.
1.2.4 Au NPs@Cr-MIL-101 NH2的合成 取50 mg Cr-MIL-101 NH2溶于25 mL灭菌水中,在搅拌状态下缓慢加入25 mL Au NPs溶胶,并于室温下搅拌24 h. 反应结束后离心,用灭菌水清洗3次,干燥后,于室温下密封保存.
1.2.5 ZnCo2O4纳米材料的合成 参考文献[30]方法采用溶剂热法合成ZnCo2O4纳米材料. 将0.1 g 聚乙烯吡咯烷酮K30、60 mL乙二醇、0.27 g尿素、0.1835 g醋酸锌和0.4982 g醋酸钴均匀混合于反应釜中,于180 ℃反应24 h,冷却后过滤,用水和乙醇依次洗涤,然后加热至600 ℃热解4 h,得到ZnCo2O4纳米团簇颗粒.
1.2.6 Au NPs@ZnCo2O4的合成 取8 mg ZnCo2O4纳米粒子溶于2 mL 灭菌水中,持续搅拌下滴入2 mL Au NPs溶胶,常温下搅拌24 h,离心后用灭菌水清洗3次. 最后,分散在水中备用(2 mg/mL).
1.2.7 Au NPs@Cr-MIL-101 NH2标记的信号探针T2取10 mg Au NPs@Cr-MIL-101 NH2溶于500 μL 无菌水中,与200 μL 400 mmol/L EDC和200 μL 100 mmol/L NHS混合反应30 min,离心,用PBS缓冲溶液(25 mmol/L,pH=7.4)清洗2 次. 将沉淀物分散到200 μL 无菌水中,加入200 μL 0.5 mg/L 链霉亲和素(SA),而后于4 ℃下反应4 h,SA 上的羧基(—COOH)会与Cr-MIL-101 NH2材料上的氨基(—NH2)结合. 加入250 μL 10 μmol/L的信号探针T2链后,于4 ℃反应2 h,信号探针T2链上修饰的生物素(Biotin)会与SA 结合. 最后,加入1000 μL 10 mg/mL 巯基乙醇于4 ℃下反应1 h,巯基乙醇上的巯基(—SH)会与Au NPs@Cr-MIL-101 NH2材料通过Au—键结合,封闭非特异性活性位点. 将产物以12000 r/min转速离心,用PBS缓冲溶液(0.01 mol/L,pH=7.4)清洗,将产物分散于500 μL灭菌水中,于4 ℃保存待用.
1.2.8 传感器的制备和测量 采用文献[31]报道的方法对玻璃碳电极进行抛光. 取10 μL 壳聚糖与Au NPs@ZnCo2O4的等体积混合液滴于GC 表面,晾干后滴加10 μL DNA NTH,于37 ℃下培育12 h,DNA NTH 底部修饰的巯基(—SH)通过Au—S 键结合到GC 表面. 用PBS 缓冲溶液(0.01 mol/L,pH=7.4)清洗,晾干后滴加10 μL 1%巯基乙醇于37 ℃下孵育10 min,巯基乙醇上的巯基(—SH)与Au NPs@ZnCo2O4通过Au—S 键结合,封闭非特异性活性位点. 用PBS 缓冲溶液(0.01 mol/L,pH=7.4)清洗,晾干后分别滴加5 μL AgNO3溶液和5 μL Au NPs@Cr-MIL-101 NH2/T2复合物,于37 ℃培育1 h,用PBS缓冲溶液(0.01 mol/L,pH=7.4)冲洗,制得所需传感器. 传感器制备流程如Scheme 1所示.
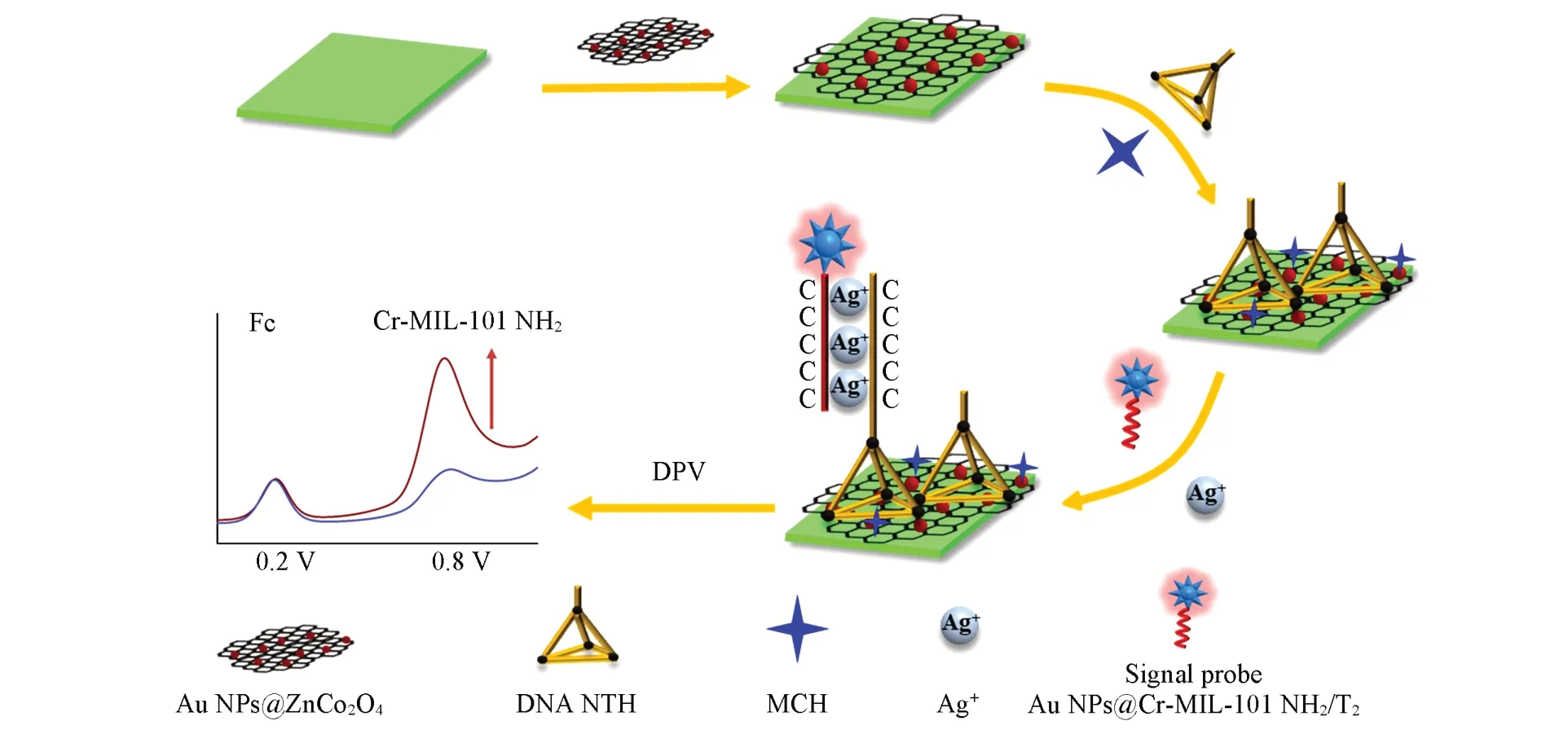
Scheme 1 Schematic diagram of a ratiometric electrochemical sensor for Ag+
电化学实验采用传统的三电极系统:玻璃碳电极作为工作电极,铂丝作为辅助电极,饱和甘汞电极作为参比电极. 在扫描范围为0~1.2 V,脉冲幅度为0.05 V,脉冲周期为0.2 s的条件下,采用差分脉冲伏安法(DPV)在含有0.2 mmol/L二茂铁甲酸的Tris缓冲液中进行测量.
2 结果与讨论
2.1 材料表征
2.1.1 ZnCo2O4材料的表征 利用X 射线衍射技术(XRD)表征了ZnCo2O4材料的晶型结构,结果如图1(A)所示,ZnCo2O4材料峰的位置与标准谱图基本一致[32]. 采用透射电子显微镜(TEM)观察了ZnCo2O4和Au NPs@ ZnCo2O4的结构. 图1(B)为ZnCo2O4的TEM 照片,可见ZnCo2O4的形貌呈片状;图1(C)为Au NPs@ZnCo2O4的TEM照片,可以观察到Au NPs均匀地负载在ZnCo2O4上.

Fig.1 XRD pattern of ZnCo2O4 material(A) and TEM images of ZnCo2O4(B) and Au NPs@ZnCo2O4(C)
利用X射线光电子能谱(XPS)对合成的ZnCo2O4材料进行了分析. 图2(A)为ZnCo2O4的XPS扫描光谱,可见样品中存在C1s,O1s,Co2p及Zn2p,表明材料合成成功. 由图2(B)可看出,Co2p光谱中2个主峰的结合能分别为780.4 和795.2 eV,分别与Co2p3/2和Co2p1/2相关[32]. 在O1s光谱[图2(C)]中,在529.2 和530.8 eV 处有2 个主峰,分别归因于ZnCo2O4晶格氧和氢氧离子的氧;另外在532.2 和533.7 eV 处的2个小峰被认为是由表面结合水或吸附氧产生的. 如图2(D)所示,Zn2p光谱主要拟合成1个峰,结合能1044.4 eV处的峰为Zn2p1/2的特征峰[32].
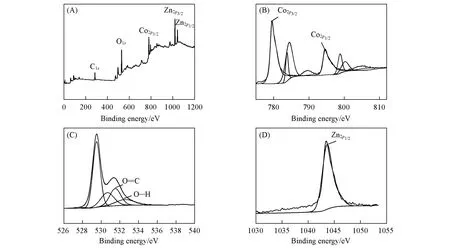
Fig.2 XPS spectra of ZnCo2O4(A)XPS measurement scan spectrum;(B)Co2p;(C)O1s;(D)Zn2p.
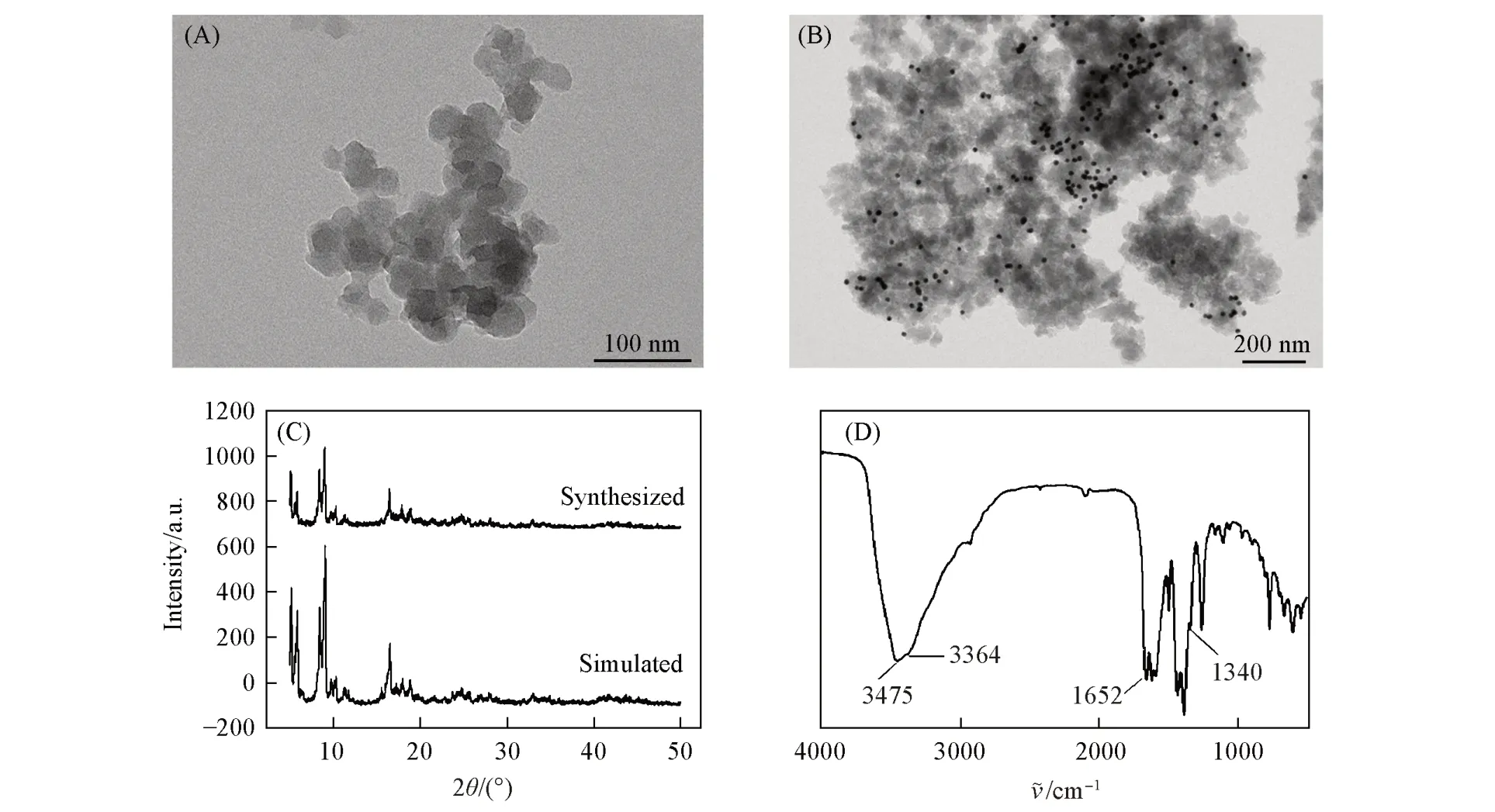
Fig.3 TEM images of Cr⁃MIL⁃101 NH2(A)and Au NPs@Cr⁃MIL⁃101 NH2(B),XRD pattern(C)and IR spectrum(D)of Cr⁃MIL⁃101 NH2 material
2.1.2 Cr-MIL-101 NH2的表征 图3(A)为Cr-MIL-101 NH2的TEM 照片,可以看出,Cr-MIL-101 NH2的形貌呈小圆片状. 图3(B)为Au NPs@ Cr-MIL-101 NH2的TEM 照片,可以看出,Au NPs 已负载在Cr-MIL-101 NH2上,且颗粒分布均匀. 将合成的Cr-MIL-101 NH2材料的XRD 谱图与标准谱图进行比对,结果如图3(C)所示,Cr-MIL-101 NH2材料峰的位置和文献[29]报道基本一致. 采用红外光谱(IR)分析了Cr-MIL-101 NH2材料中含有的化学键和官能团. 由图3(D)可以看出,在3490和3380 cm-1处出现了明显的双峰,归因于胺基的非对称和对称伸缩. 在低频区,1624和1338cm-1处也出现了2个峰,是由芳香胺的N—H弯曲振动和C—N伸缩引起的[29].
实验中采用XPS 对铬的氧化态进行了表征. 图4(A)显示了Cr-MIL-101 NH2的扫描结果,存在C,N,O 和Cr 元素,图4(B)中位于577 eV 处的主峰为Cr(Ⅲ)的特征峰. 由图4(C)得C1s光谱的2 个拟合峰,分别为C—N(288.3 eV)和C—C(284.6 eV)的特征峰[33]. 图4(D)显示N1s主要拟合成3 个峰,分别由N2C(398.8 eV),N3C(400.5 eV)和NHx(399.0 eV)构成. 图S1(见本文支持信息)显示,O1s的光谱峰出现在530.7 eV处,归因于C=O的振动吸收[34]. 上述结果表明,Cr-MIL-101 NH2材料合成成功.
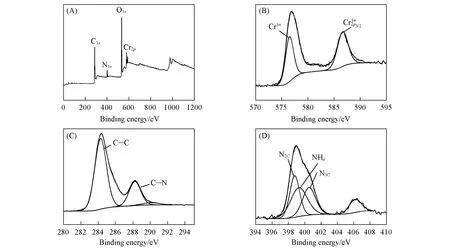
Fig.4 XPS spectra of Cr⁃MIL⁃101 NH2(A)XPS measurement scan spectrum;(B)Cr2p;(C)C1s;(D)N1s.

Fig.5 Gel electrophoresis image of Tetra A(band 1),Tetra A+B(band 2),Tetra A+B+C(band 3),DNA NTH(band 4)(A)and TEM image of DNA NTH(B)
2.1.3 DNA NTH 的表征 采用琼脂糖凝胶电泳表征了DNA NTH 的组装结果. 如图5(A)所示,条带1为组成DNA 四面体末端的DNA 链Tetra A,在电泳中的迁移速率最快. 空间复杂度和分子量的增加会阻碍DNA 的移动. Tetra A 和Tetra B 杂交得到的条带2 迁移速率小于条带1,当Tetra A,Tetra B 和Tetra C 杂交后得到的条带3迁移速率进一步降低,当4条单链一同杂交形成四面体时,分子量更大和空间更复杂导致条带4 的迁移率小于前面的3 条. 条带位置明显的差异表明DNA NTH 的合成是成功的. 同时,还采用TEM进一步验证了DNA NTH的组装结果. 如图5(B)所示,DNA NTH纳米颗粒的大小均匀. 以上结果显示,DNA NTH已成功合成.
2.1.4 Au NPs@Cr-MIL-101 NH2标记信号探针T2的表征 利用紫外-可见光谱表征了信号探针T2的标记结果. 如图S2 所示(见本文支持信息),在加入信号探针T2链反应2 h 后,取其溶液的沉淀Au NPs@Cr-MIL-101 NH2材料(曲线b)和上层清液(曲线c),与相同浓度新配制的信号探针T2链(曲线a)进行紫外光谱测试. 结果表明,在DNA的特征吸收峰260 nm处,直接加入新配制的游离T2链后,检测到的峰值很高,说明溶液中含有大量T2链. 由Au NPs@Cr-MIL-101 NH2材料配制的溶液也可以检测到较高的峰值,说明Au NPs@Cr-MIL-101 NH2材料上标记了大量T2链. 而在标记过程结束后的上层清液中,检测到的峰值很低,说明溶液中只存在少量的T2链. 紫外吸收变化结果表明,加入的信号探针T2链已标记在Au NPs@Cr-MIL-101 NH2材料上.
2.2 实验方案的可行性
为了验证实验设计的可行性,进行了一系列的控制性实验. 图6(A)示出了加入不同DNA 链对DPV响应的影响. 图中谱线a为未加入DNA四面体末端的DNA链(Tetra A)时的DPV响应图,在0.9 V处得到的电化学峰电流信号很低;谱线b和c为未加入Cr-MIL-101 NH2标记的DNA链T2和未加入Ag+时的DPV 响应图,在0.9 V 处检测到的信号依旧很低;当同时加入DNA 四面体、Cr-MIL-101 NH2标记的DNA链T2和Ag+时,信号放大,检测到Cr-MIL-101 NH2在0.9 V处的峰电流响应最大(谱线d). 图6(B)为由控制实验结果得到的柱状图. 以上结果证明该实验方案是可行的.
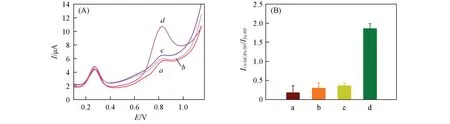
Fig.6 Comparison of DPV response(A)and current ratio(B)under different conditionsa,a. Tetra B-C-D/MCH/Ag++Au NPs@Cr-MIL-101 NH2/T2;b,b. DNA NTH/MCH/Ag+;c,c. DNA NTH/MCH+Au NPs@Cr-MIL-101 NH2/T2;d,d. DNA NTH/MCH/Ag++Au NPs@Cr-MIL-101 NH2/T2.
2.3 电极修饰过程的的电化学表征
采用电化学阻抗谱(EIS)表征了电极的修饰过程. 图7(A)显示了电极表面每个制备过程步骤的EIS 结果. 在裸电极上测得1个小的半圆(谱线a,Ret=80 Ω). 当Au NPs@ZnCo2O4修饰在玻璃碳电极的表面时,阻抗略有增加(谱线b,Ret=240 Ω). 在电极表面修饰DNA NTH 后,产生静电排斥,使Ret增大(谱线c,Ret=800 Ω). MCH 会阻碍电子的转移速率,因此用MCH 封闭后,导致Ret值继续增大(谱线d,Ret=1300 Ω). 当加入Ag+和Au NPs@Cr-MIL-101 NH2/T2后,Ret进一步增大(谱线e,Ret=2100 Ω). 以上结果说明电极层层修饰成功.
进一步采用循环伏安法表征了电极的修饰过程. 如图7(B)所示,裸露的电极显示出具有优良峰形的氧化还原峰(谱线a). 当在裸露的玻璃碳电极上修饰Au NPs@ZnCo2O4后,峰值电流变化很小(谱线b). 与DNA NTH孵育后,相应曲线电流降低(谱线c). 采用MCH封闭非特异性活性位点后,氧化还原峰值电流被明显抑制(谱线d). 当修饰的电极表面与Ag+及AuNPs@Cr-MIL-101 NH2/T2结合后,氧化还原峰值电流进一步降低(谱线e). 以上结果与ESI结果互相印证.
为了考察Cr-MIL-101 NH2作为信号产生物质时信号的来源,研究了配体2-氨基对苯二甲酸和六水合硝酸铬的DPV响应曲线. 由图S3(见本文支持信息)可见,2-氨基对苯二甲酸在0.9 V处检测到很高的电信号,而六水合硝酸铬未检测到. 以上结果表明,Cr-MIL-101 NH2材料的信号来源于有机配体2-氨基对苯二甲酸.

Fig.7 Electrochemical impedance spectra(A)and cyclic voltammogram(B)of different electrode modified interfacesa. bare GC;b. Au NPs@ZnCo2O4/GC;c. DNA NTH/Au NPs@ZnCo2O4/GC;d. MCH/DNA NTH/Au NPs@ZnCo2O4/GC;e. Au NPs@Cr-MIL-101 NH2/T2/Ag+/MCH/DNA NTH/Au NPs@ZnCo2O4/GC. All tests were carried out in 10 mmol/L[Fe(CN)6]3-/[Fe(CN)6]4-containing 0.2 mol/L KCl.
2.4 实验条件优化
实验探究了PBS、乙酸-乙酸钠(CH3COOH-CH3COONa)和Tris-HAc 3种缓冲体系对比率型传感器的影响. 如图8(A)所示,在Tris-HAc 缓冲体系中,有目标物Ag+与空白溶液的电流比值差别最大,其它2种缓冲体系的效果不理想. 所以,选择Tris-HAc 缓冲体系作为该实验的缓冲体系. 为了获得更高的灵敏度,优化了缓冲体系的pH 值. 如图8(B)所示,电流比值随pH 值从6.5 增大到7.5 而增加,并在pH值为7.5时达到峰值;然后随着pH值继续增大,体系的电流响应值逐渐减小. 因此,选择7.5作为最佳pH.
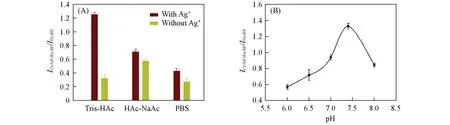
Fig.8 Influence of different types of buffers(A)and pH values(B)on the current response value of the ratiometric sensor
2.5 传感器的响应性能
在最优的实验条件下,测试了传感器对不同浓度Ag+的DPV响应曲线,结果示于图9(A). 可见,随着Ag+浓度的增加,信号探针Cr-MOFs-SP的峰值电流逐渐变大,而参考探针Fc-RP 的响应电流值几乎不变. 图9(B)为电流响应比值随着Ag+浓度变化的曲线. 图9(C)为传感器的校正曲线,电流响应比值与Ag+浓度(0.1~100 nmol/L)的对数呈线性关系,线性方程为ICr-MOFs-SP/IFc-RP=0.8689lgc+1.3169,R2为0.9901. 根据3σ规则算得检出限(LOD)为33 pmol/L. 表1列出了该生物传感器和其它检测Ag+传感器或方法的检出限和线性范围,可以看出本文设计的传感器具有更低的检出限和较宽的线性范围,这主要归因于Cr-MIL-101 NH2的信号放大作用和DNA四面体增加了靶物Ag+的捕获量.
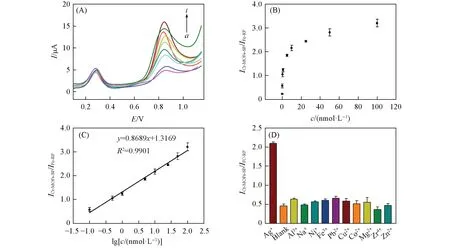
Fig.9 DPV response curves of the sensor to different concentrations of Ag+(A), relationship between the response current ratio and different Ag+ concentrations(B), standard curve between the current response ratio and the logarithmic value of Ag+ concentration(C), and selectivity of electrochemistry sensor(D)(A)a. 0 nmol/L;b. 0.1 nmol/L;c. 0.5 nmol/L;d. 1 nmol/L;e. 5 nmol/L;f. 10 nmol/L;g. 25 nmol/L;h. 50 nmol/L;i. 100 nmol/L.

Table 1 Comparison of different analytical methods for detecting Ag+
2.6 传感器的选择性
采用实际样品中常见的各种金属离子(Al3+,Na+,Ni+,Fe3+,Pb2+,Cu2+,Co2+,Mg2+,Zr4+和Zn2+)代替靶标离子Ag+,考察了该传感器的选择性,结果如图9(D)所示. 在相同条件下,干扰离子的浓度(100 nmol/L)比待测物Ag+浓度(10 nmol/L)高10 倍时,干扰物检测到的电流响应ICr-MOFs-SP/IFc-RP比值明显低于靶离子Ag+的检测比值,表明该传感器具有较高的选择性.
2.7 传感器的稳定性
为了考察该比率型电化学传感器的稳定性和准确性,采用10根电极测量得到30组数据对传感器的稳定性进行了评估,结果如表2 所示,其中a代表30 组数据的平均值,b为30 组数据的标准偏差.图10(A)为3根电极的DPV响应曲线图,不同电极得到的电流比值相差不大. 在图10(B)中,非比率型传感器的峰电流响应值波动幅度大,平均值为10.85 μA,相对标准偏差(RSD)为22.12%,而本文设计的比率型电化学传感器的流响应比值ICr-MOFs-SP/IFc-RP波动幅度显著降低,30次测量结果的RSD为2.91%,平均值为2.76[图10(C)]. 因此,该比率型传感器比非比率传感器更可靠,表现出更高的稳定性和重现性,可降低背景干扰和随机误差,从而获得更准确的数据.

Table 2 Comparison of the proposed ratiometric sensor and non-ratiometric sensor
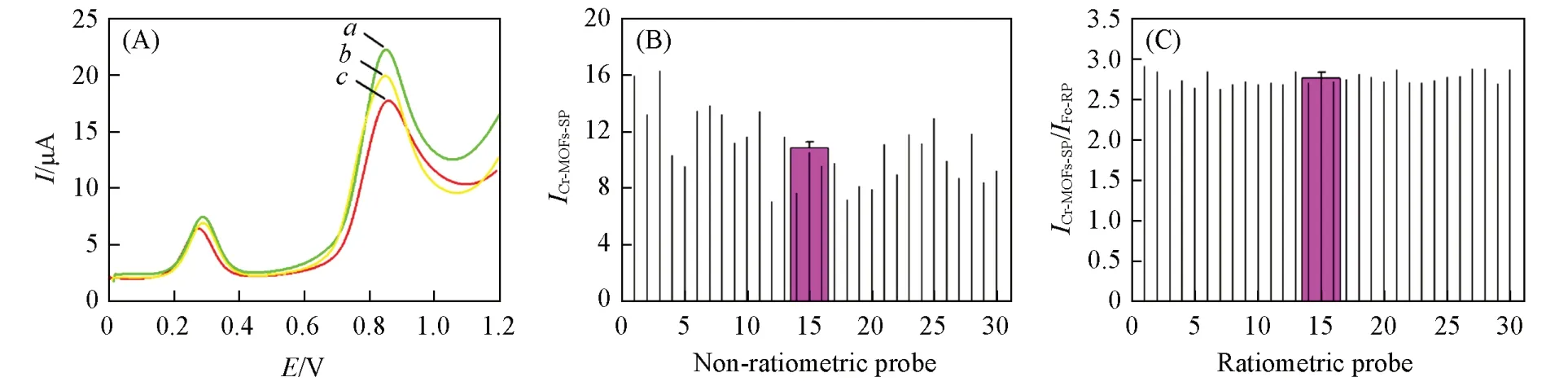
Fig.10 Comparison of ratiometric and non⁃ratiometric sensors(A)DPV curves of three different electrodes;(B)the reproducibility of the non-ratiometric aptamer sensor;(C)the ratiometric sensor.(A)a. ICr-MOFs-SP/IFc-RP=2.80;b. ICr-MOFs-SP/IFc-RP=2.78;c. ICr-MOFs-SP/IFc-RP=2.77.
2.8 回收率的测定
在最优实验条件下,采用标准加入法,将该传感器应用于滇池水样中Ag+的检测. 每个浓度平行测定3次,测试结果如表3所示,回收率在96.8%~103.0%之间,说明所构建的比率型传感器可用于真实水样中Ag+的分析.

Table 3 Recovery and determination of silver ions in the water samples of Dianchi Lake
3 结论
构建了一种基于Ag+与DNA 相互作用以及DNA NTH 的超灵敏电化学传感器,用于Ag+的定量分析. 将电化学性能优异的Au NPs@ZnCo2O4作为固定基质提高导电性能,可以同时捕获更多末端修饰巯基的DNA四面体,从而提高检测的灵敏度. 通过引入电活性物质作为参比探针,在完全相同的修饰条件下,2个信号彼此依赖,降低随机误差的同时又降低了环境干扰. 本文设计的传感器的检测限可低至33 pmol/L. 与非比率型检测方法相比,该传感器的稳定性较好,可用于滇池水样中Ag+的检测.
支持信息见http://www.cjcu.jlu.edu.cn/CN/10.7503/20220202.

