CO2在非质子溶剂与铁基离子液体复合体系中的吸收
崔 伟,赵德银,白文轩,张晓东,余 江
(1.中国石油化工股份有限公司西北油田分公司,乌鲁木齐 830011;2.北京化工大学化学工程学院,环境催化与分离过程研究中心,北京 100029)
在天然气的开采以及生物沼气的利用过程中,存在着大量的H2S与CO2[1~3],其中,H2S可通过湿式催化氧化技术被转化为硫磺,实现资源回收[4,5]. 而在当今“碳中和”的时代背景下,CO2作为C1资源合成化学品的研究已经引起了国内外学者的广泛关注[6,7]. 因此一种高效地捕获分离H2S和CO2的技术具备较好的应用前景.
目前,以络合铁法(Lo-Cat)为代表的碱性水相湿式氧化脱硫技术,需要控制脱硫液的pH(8~9),因此需持续补充碱液来减缓脱硫过程中CO2对体系碱度的影响,并且该工艺容易导致二次污染[8]. 而采用聚乙二醇二甲醚(NHD)等非质子型有机溶剂的同步脱硫脱碳工艺[9],能够高效地实现CO2与H2S的捕获,但需要调控一定的温度和压力才能将两者有效地分离,且无法实现资源化利用. 此外,大量研究表明咪唑基离子液体对H2S和CO2具备良好的吸收特性[10,11].
近十多年来,磁性铁基离子液体(BmimFeCl4)因其兼具常规离子液体饱和蒸气压低、不挥发、溶解性能好以及Lewis 酸催化氧化的特性,在酸性气体的捕集与资源化领域引起了广泛关注[12~15]. Liu等[5]曾对金属基离子液体捕获CO2,并结合电化学技术制备C1化学品的发展趋势进行了展望. 研究表明,BmimFeCl4对H2S和CO2均具备一定的吸收能力,但区别在于铁基离子液体对CO2的吸收仅为单纯的物理吸收过程,而对H2S则是通过氧化还原反应将其转化为硫磺,因此,铁基离子液体同步脱硫脱碳工艺能够同时实现CO2与H2S的分离及H2S的资源化.
针对BmimFeCl4黏度较高的缺点,通过向BmimFeCl4中加入非质子型有机溶剂(聚乙二醇二甲醚NHD、N,N-二甲基乙酰胺)的方式来降低体系黏度,显著地提升了铁基离子液体对酸性气体的吸收性能[4,16]. Zhang 等[17]利用密度泛函理论(DFT)计算与傅里叶变换红外光谱(FTIR),分析了甲醇分子对BmimFeCl4的微观作用机制,并认为溶剂分子的引入会影响铁基离子液体分子网络的形成. 由此看来,铁基离子液体有机溶剂复配体系在未来能源气的开采及生产过程中,对于H2S与CO2协同资源化领域,具备良好的应用前景. 然而目前大量报道都是关于铁基离子液体对硫化氢的氧化吸收,对于铁基离子液体及其复配体系的二氧化碳吸收性能及作用机制的相关研究较少.
N,N-二甲基乙酰胺(DMAC)与聚乙二醇二甲醚(NHD)是两种黏度低、沸点高、热化学性质稳定,且对H2S和CO2具备较强吸收能力的非质子型极性有机溶剂[18]. 本文选择了DMAC和NHD作为铁基离子液体的复配剂,通过改变压力、温度、溶剂配比等因素,考察了铁基离子液体复配体系对CO2吸收性能的影响. 此外还考察了复合体系的吸收-再生循环性能,并通过FTIR表征和DFT计算等手段对其吸收机制进行了分析.
1 实验部分
1.1 试剂与仪器
FeCl3·6H2O,分析纯,天津市福晨化学试剂厂;N-甲基咪唑,分析纯,上海三微有限公司;氯代正丁烷,分析纯,北京益利精细化学品有限公司;乙酸乙酯,分析纯,北京化工厂;聚乙二醇二甲醚(NHD)和N,N-二甲基乙酰胺(DMAC),分析纯,国药集团化学试剂有限公司;二氧化碳,纯度99.9%,北京永圣气体有限公司;氮气,纯度99.9%,北京永圣气体有限公司.
85-1A型恒温磁力搅拌器,控温精度为0.1 K,巩义市予华仪器有限公司;RE-52A型旋转蒸发仪,上海亚荣生化仪器厂;TDL-40B 型离心机,上海安亭科学仪器厂;TENSOR27 型傅里叶变换红外光谱仪,德国布鲁克公司.
1.2 实验过程
1.2.1 铁基离子液体复合体系的制备 采用两步法合成铁基离子液体[19]. 1-丁基-3-甲基氯化咪唑的合成:将N-甲基咪唑与氯代正丁烷在室温下混合,混合均匀后,置于70 ℃的恒温水浴搅拌器中反应72 h,得到的反应产物用乙酸乙酯洗去其中的杂质,然后再放置到温度为70 ℃的旋转蒸发仪中,将产物中的乙酸乙酯去除. 最后将产物置于温度为70 ℃的真空干燥箱中干燥,干燥结束后得到的淡黄色液体即为1-丁基-3 甲基氯化咪唑(BmimCl). 铁基离子液体的合成:将合成的BmimCl 与FeCl3·6H2O 按照摩尔比1∶2混合,在室温条件下搅拌反应24 h,反应结束后溶液分为两相,上层的墨绿色液体即为铁基离子液体,分离后得到纯铁基离子液体(BmimFeCl4). 将合成的铁基离子液体分别与N,N-二甲基乙酰胺(DMAC)和聚乙二醇二甲醚(NHD)按照一定的质量比(1∶0,9∶1,7∶3,1∶1,0∶1)混合,得到铁基离子液体二元复配体系.
1.2.2 CO2溶解度的测定 通过等温压降法来测定CO2在铁基离子液体中的溶解度,实验装置如Scheme 1所示. 将铁基离子液体真空干燥12 h,除去水分与空气,检验装置的气密性后,将30 mL待测体系注入高压反应釜中,通过恒温水浴锅调控吸收温度与搅拌速率. 待温度稳定后,向装置内部通入二氧化碳至所需的压力,记录初始压力PCO2,0,当压力示数30 min 内不发生变化时,视为吸收达到平衡,记录读数PCO2,1.
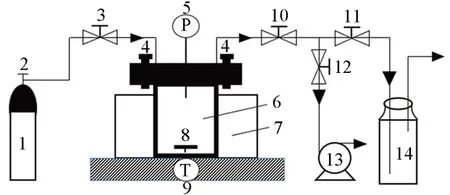
Scheme 1 Experimental device diagram for CO2 solubility determination1. CO2 cylinder; 2. pressure relief valve; 3,10,11,12. gas flow meter; 4. flange; 5. pressure gauge; 6. high pressure reactor;7. thermostatic water bath pot;8. magnetic stirrer;9. temperature controller;13. vacuum pump;14. exhaust gas absorption system.
CO2的吸收量(,mol)采用下式计算,由此得到CO2在BmimFeCl4中的溶解度(α,mol/L):

式中:Vg(mL)为高压反应釜内部气相体积;R(8.314 J·mol-1·K-1)为气体常数;PCO2,0和PCO2,1(MPa)分别为初始状态和平衡后的CO2压力;T(K)为相平衡温度;Z0和Z1分别为反应釜内初始状态和平衡后的CO2压缩因子. 通过文献[20]获取;Vl(L)代表高压反应釜中待测溶液的体积.
1.2.3 再生实验 在温度为298.2 K,初始压力为2.00 MPa下,采用高压反应釜测定待测体系的溶解度. 然后将压力降至常压,反应釜升温至363.2 K,并且用氮气吹扫60 min,实现CO2的解吸. 随后降低体系温度至298.2 K,重新提升体系压力,重复相同流程,再次进行对CO2的吸收实验,循环5次. 根据每次CO2溶解度的变化,计算其再生效率.
1.2.4 红外光谱表征 波数范围为400~4000 cm-1,扫描频率为32次,分辨率4 cm-1,溴化钾压片.
1.2.5 DFT计算 执行Gaussian 09程序包,B3LYP函数用于分子结构优化和弱相互作用的研究. 铁原子和剩余原子的计算分别通过SDD基组和6-311+G(d,p)基组进行[17]. 在计算过程中加入了色散效应的D3(BJ)修正.IRI(Interaction region indicator,相互作用区域指示函数)分析由Multiwfn软件[21,22]执行,结果通过分子可视化程序VMD呈现[23].
2 结果与讨论
2.1 CO2在BmimFeCl4中的溶解度
在一定压力范围(0~2.5 MPa)内,考察298.2,313.2和328.2 K 3个温度条件下,纯铁基离子液体中CO2的溶解度,数据列于表S1(见本文支持信息)中,图1展示了温度和压力对CO2在铁基离子液体中溶解度的影响.
当温度相同时,随着压力的增大,溶解度几乎线性增大,表明铁基离子液体对于CO2的吸收过程符合亨利定律,是一种典型的物理吸收. 在压力保持不变的情况下,随着吸收温度的提高,CO2的溶解度明显降低. 虽然升温能够促进FeCl4-的解离,使其空间结构变得松散,导致铁基离子液体的黏度降低,可增强其传质性能[24],但是升高温度弱化了CO2分子与BmimFeCl4的相互作用,最终导致溶解度显著降低[25,26]. 可见,BmimFeCl4对CO2表现出了一定的吸收性能,但是相对于碳酸丙烯酯(PC)[27]和NHD等常用工业脱碳溶剂,吸收能力依然较低,因此需要通过复配有机溶剂的方式强化吸收过程.

Fig.1 Solubility of CO2 in BmimFeCl4 at different temperatures and pressures
2.2 CO2在BmimFeCl4/有机溶剂复合体系中的溶解度
在不同温度(298.2,313.2,328.2 K)条件下,不同BmimFeCl4/有机溶剂的质量比(1∶0,9∶1,7∶3,1∶1,0∶1),BmimFeCl4/DMAC和BmimFeCl4/NHD两种复合体系对CO2的吸收结果分别列于表S2和表S3(见本文支持信息). 图2展示了不同有机溶剂复配比的铁基离子液体对CO2的溶解能力. 首先,图2中所有复配体系的平衡压力与溶解度均呈线形关系,这表明CO2在复合体系中的溶解符合亨利定律. 对比可知,DMAC吸收CO2的能力要高于NHD[图2(A)和(D)],因此在相同温度与质量比下,复配DMAC的铁基离子液体对CO2的吸收能力更强[图2(A)~(C)和(D)~(F)]. 由于DMAC和NHD对CO2的溶解能力均要强于纯的铁基离子液体,因此复配两种溶剂后,铁基离子液体对CO2的溶解度均显著提升,随着溶剂占比的增加,吸收能力明显增强. 压力越高,对CO2的吸收影响愈发明显,如在温度为298.2 K,压力为0.4 MPa 时,CO2在质量比7∶3 的BmimFeCl4/DMAC 中的溶解度比在纯铁基离子液体中高26.1%,而当压力上升至1.8 MPa时,CO2在该复合体系中的溶解度比在纯铁基离子液体中的溶解度高35.6%. 然而,升高温度会弱化复配溶剂对CO2在铁基离子液体中的溶解. 298.2 K时,相同压力下,质量比9∶1的BmimFeCl4/有机溶剂中CO2的溶解度明显高于纯铁基离子液体[图2(A)和(D)],升高温度至328.2 K,CO2的溶解能力与纯铁基离子液体十分接近,如图2(C)和(F)所示. 有机溶剂影响铁基离子液体对CO2吸收有以下3个方面的因素:溶剂的引入能够降低铁基离子液体的黏度,增强气液传质作用[28];溶剂分子自身能与CO2分子形成氢键和范德华力等相互作用,从而促进CO2在铁基离子液体中的溶解[29];铁基离子液体在氢键及阴离子-π的作用下,形成的空间网络结构对CO2分子的内部扩散起到了关键作用. 研究表明,有机溶剂CH3OH的引入能够改善铁基离子液体阴阳离子对的作用方式,从而使其氢键网络发生变化,影响CO2的吸收[17,30,31].

Fig.2 Relationship between solubility and pressure of CO2 for BmimFeCl4/DMAC(A—C) and BmimFeCl4/NHD(D—F) with different mass ratios of BmimFeCl4/solvent at 298.2 K(A, D), 313.2 K(B, E) and 328.2 K(C,F)
图3 表示不同温度下,当BmimFeCl4/有机溶剂的质量比为7∶3时,CO2的溶解度与压力的关系. 可见,在压力相同的情况下,随着温度的升高,CO2的溶解度明显降低. 当气体压力维持在1.8 MPa 时,温度从298.2 K 升高至328.2 K,CO2在BmimFeCl4/DMAC 和BmimFeCl4/NHD 复合体系中的溶解度分别降低了56.7%和58.7%[图3(A)和(B)]. 这是因为升高温度能够弱化铁基离子液体和溶剂分子与CO2分子的相互作用,从而导致CO2的溶解度降低. 这也表明低温条件下有利于CO2的溶解,而高温更有利于吸收液的再生.

Fig.3 Relationship between the solubility and pressure of CO2 for BmimFeCl4/DMAC(A) and BmimFeCl4/NHD(B)in BmimFeCl4/solvent with mass ratio of 7∶3 at different temperatures
2.3 CO2在BmimFeCl4/有机溶剂复合体系中的亨利系数
依据下式计算了CO2在铁基离子液体/有机溶剂二元混合体系中的亨利系数,计算结果列于表1.
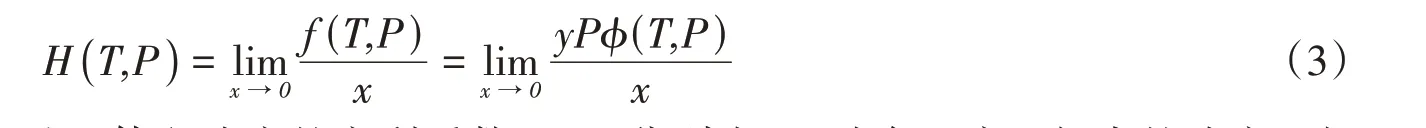
式中:H(T,P)(MPa·L·mol-1)为基于体积浓度的亨利系数;x,y分别为CO2在气、液两相中的浓度;由于铁基离子液体和有机溶剂的难挥发特性,气相中仅有CO2,因此y为1. 通过Redlich-Kwong(RK)状态方程[32]计算得到CO2在不同温度压力下的逸度系数ϕ(T,P):
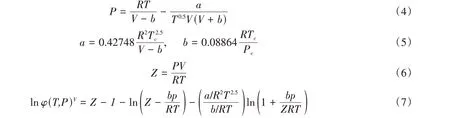
式中:Tc(K)为CO2的临界温度;Pc(MPa)为CO2的临界压力;Z为压缩因子;V(L/mol)为CO2摩尔体积.
根据表1 中的结果,CO2在BmimFeCl4/DMAC 与BmimFeCl4/NHD 复合体系中的亨利系数随着温度的上升而增加,在同等温度下随铁基离子液体质量分数的增加而增大. 并且当温度以及质量配比相同时,CO2在BmimFeCl4/DMAC 复合体系中的亨利系数均小于CO2在BmimFeCl4/NHD 复合体系中的亨利系数. 当体系温度为298.2 K,铁基离子液体/非质子溶剂复合体系的质量配比为7∶3 时,CO2在BmimFeCl4/NHD 复合体系的亨利系数为0.9912 MPa·L·mol-1,然而在BmimFeCl4/DMAC 复合体系中的亨利系数为0.9181 MPa·L·mol-1. 这同样表明复配DMAC 的铁基离子液体对CO2的溶解能力强于复配NHD的体系.
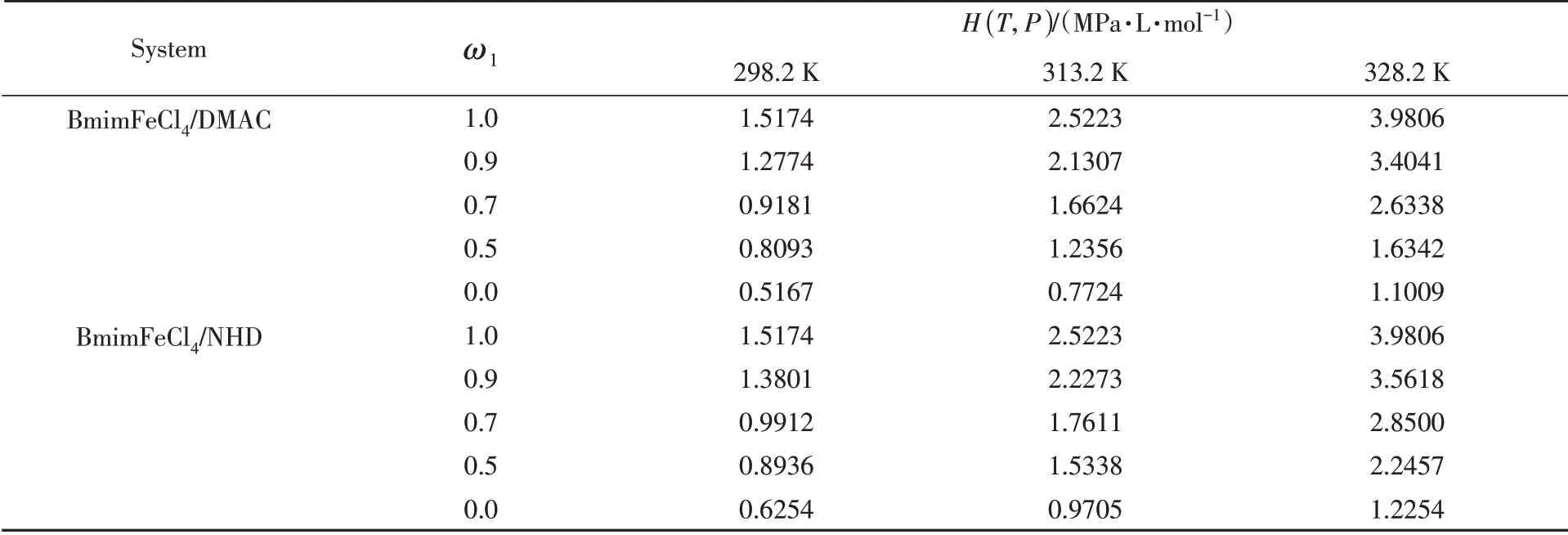
Table 1 Henry coefficients of CO2 in BmimFeCl4 and solvent mixture at different temperatures
2.4 BmimFeCl4/有机溶剂复合体系的再生循环性能
根据图4的测量结果,当BmimFeCl4与非质子溶剂的质量比为7∶3时,两种溶剂复合体系具有相似的CO2吸收性能,在该配比下,两种体系吸收CO2的再生性能结果如图5所示. 两种BmimFeCl4/有机溶剂复合体系经过5次循环吸收CO2后仍有较好的吸收性能,这表明减小压力以及升高温度等措施能够有效地实现铁基离子液体复合体系中CO2的解吸. 对于BmimFeCl4/DMAC来说,循环5次后,其CO2的溶解度仍可达到初次吸收量的99.04%. 这也从侧面印证了该体系对CO2的吸收完全是物理吸收过程.然而对于BmimFeCl4/NHD 体系,循环吸收5 次后,CO2的溶解度下降至初始溶解度的92.53%,相比于复配DMAC 的体系,其吸收能力明显降低. 这表明部分CO2可能在氢键等弱相互作用的引导下[26],进入到离子液体与NHD共同形成的分子网络中,依靠氢键和范德华力等相互作用,形成一种介稳态的缔合结构[17,33],从而导致CO2较难从复合体系中逸出.

Fig.4 Relationship between CO2 solubility and pressure in different systems at 298.15 KMass ratio of BmimFeCl4/aprotic solvent is 7∶3.

Fig.5 Regeneration and recycling performance of BmimFeCl4/aprotic solvent compositeMass ratio of BmimFeCl4/aprotic solvent is 7∶3.
根据铁基离子液体/有机溶剂复合体系的再生结果来看,DMAC 的引入使其在较为温和的条件下(常压、363.2 K、60 min)具备优越的吸收-解吸循环性能,这更有利于CO2的闪蒸分离,拓展了该体系的实用意义. 当该体系应用于同步脱除H2S与CO2时,CO2不会与复合体系发生化学反应,可以通过加压的方式稳定储存在复合体系当中,然而H2S可以通过氧化还原反应,被三价铁转化为硫磺单质,实现其资源化.
2.5 CO2在BmimFeCl4/有机溶剂复合体系中的吸收机制
质量配比为7∶3的BmimFeCl4/有机溶剂复合体系的FTIR表征结果见图6. 3250~3000 cm-1范围内为芳环上的C—H 伸缩振动峰,2960~2800 cm-1范围内为碳链上的C—H 对称和反对称的伸缩振动峰,1590 cm-1处为咪唑环上的碳碳双键的伸缩振动峰[34]. 从图中可以看出,BmimFeCl4/DMAC 复合体系吸收CO2后,并没有新的峰产生,并且在吸收过程中并未观察到明显的现象,由此可判断该体系对于CO2的吸收过程为单纯的物理吸收过程. 对于复合体系BmimFeCl4/NHD而言,吸收CO2后,在2349 cm-1处出现了明显的CO2不对称伸缩振动峰,这代表了CO2的溶解,除此之外,其余位置的峰均未发生明显变化,这同样表明,CO2仅以物理溶解的方式溶于铁基离子液体/NHD复合体系中. 然而,虽然两种体系的吸收过程均为物理吸收,但是它们吸收CO2前后的红外光谱呈现出不一样的变化规律,也说明两种体系与CO2的作用方式存在差异. 对于复配DMAC 的体系而言,吸收CO2后,在减压的条件下,CO2极易从体系中逸出,由此对其进行红外表征才难以观测到CO2的特征峰. 然而对于复配NHD的体系,CO2能够与分子内部存在较强的作用力,减压后,部分CO2仍存在于分子网络当中,因此,红外光谱才能呈现出明显的CO2的特征峰.

Fig.6 FTIR spectra of BmimFeCl4/DMAC(a,a')and BmimFeCl4/NHD(b, b') composite before(a, b)and after(a',b')the absorption of CO2Mass ratio of BmimFeCl4/aprotic solvent is 7∶3.
2.6 CO2与BmimFeCl4/有机溶剂复配体系的微观作用机制

Fig.7 Optimized geometries and corresponding interaction energies of the BmimFeCl4 ion pair(A),BmimFeCl4+CO2(B,C),BmimFeCl4/DMAC+CO2(D—F)and BmimFeCl4/NHD+CO2(G—I)H-bonds are denoted by dashed lines,and the unit of H-bond length is nm.
图7 和图8 分别是CO2分子与复合体系中各组分之间发生作用的结构优化与弱相互作用分析的DFT 计算结果. 以纯BmimFeCl4为吸收剂,CO2分子更容易与相对活泼的2-H 形成氢键(0.2318,0.2663 nm),此时CO2与BmimFeCl4的结合能力(-30.74 kJ/mol)较强,然而,CO2分子与4,5-H的结合能力(-19.00 kJ/mol)则较弱[图7(A)~(C)]. IRI弱相互作用分析表明,CO2分子还与咪唑环和[FeCl4]-存在π-π堆积以及阴离子-π之间的弱相互作用[图8(A)和(B)][35]. 如图7所示,在BmimFeCl4中引入不同有机溶剂后,在BmimFeCl4/DMAC体系中,CO2分子与溶剂分子和[Bmim]+的结合能力(-26.53 kJ/mol)最强,而在BmimFeCl4/NHD 的体系中,CO2则与溶剂分子和[FeCl4]-阴离子存在较强的结合能(-27.26 kJ/mol). 图7(F)表明,由于DMAC 与[Bmim]+上的2-H 形成了较强的氢键(0.2183 nm),所以CO2难以与2-H形成氢键. 由此判断,BmimFeCl4/DMAC体系主要依靠咪唑环与CO2的π-π堆积作用[图8(C)],以及烷基链上的H 与CO2间的氢键作用来实现对CO2的吸收. 然而对于BmimFeCl4/NHD 体系而言,NHD 分子由于具备较多的氢键受体,其与阳离子[Bmim]+形成强的氢键作用和网络,导致CO2分子难以与溶剂分子和阳离子形成较强的氢键作用[图7(I)]. 但是在CO2分子与溶剂分子和[FeCl4]-阴离子之间,CO2分子容易与NHD分子形成对称稳定的氢键(0.2705,0.2671,0.2807和0.2635 nm)[图7(H)].此外,[FeCl4]-阴离子也会与CO2分子存在显著的Cl-π作用[图8(D)],这两种作用是该体系对CO2捕获的主要机制.

Fig.8 IRI color maps of different structures(A,B)BmimFeCl4 at different position;(C)BmimFeCl4/DMAC;(D)BmimFeCl4/NHD. The green area represents weak interaction and the red area represents steric hindrance.
此外,铁基离子液体自身的空间网络结构,也是导致其吸收机制存在差异的主要原因. 研究表明,EmimFeCl4具备阴阳离子交错排列的层状网络结构,这使其内部具备一定规律的孔状结构[30],因此推测BmimFeCl4很可能存在近似的网络结构. 在铁基离子液体中引入DMAC等强极性有机溶剂后,发生的溶剂化作用会显著地弱化阴阳离子间的相互作用,破坏了原有的离子网络结构[图7(D)~(F)][17],导致吸收体系对CO2的束缚能力减弱,因此该复合体系表现出较容易解吸的性能. 对于极性相对较弱的链状分子NHD,其规整的排列方式会使体系的结构较为有序[图7(G)~(I)],该体系依旧保持多孔网络结构的特性,对CO2存在较强的束缚作用,使其难以完全解吸.
3 结论
以两种有机溶剂复合型铁基离子液体BmimFeCl4/DMAC 和BmimFeCl4/NHD 为吸收剂,测定了在293.2~328.2 K温度范围对CO2的吸收能力. 两种复合体系中的有机溶剂均能显著增强CO2在铁基离子液体中的溶解度,低温和高压更有利于CO2的溶解. 依据两类体系吸收CO2的亨利系数,BmimFeCl4/DMAC对CO2的溶解能力强于BmimFeCl4/NHD. 根据FTIR的表征结果,两种脱碳体系中铁基离子液体的官能团结构没有发生变化. 吸收-解吸循环实验结果证明,BmimFeCl4/DMAC 的脱碳性能优于BmimFeCl4/NHD. DFT 计算结果表明,在BmimFeCl4/DMAC 体系中,CO2倾向于与溶剂分子和阳离子相互作用,而在BmimFeCl4/NHD的体系中,CO2更容易与溶剂分子和阴离子相互作用.
支持信息见http://www.cjcu.jlu.edu.cn/CN/10.7503/cjcu20220120.
——以高中化学“氢键”的教学为例

